猪瘟病毒C株检测用国家核酸标准物质的研制
2020-10-10王英超高晓龙宋彦军韦海涛赵启祖冯小宇
王英超,高晓龙,梅 力,高 敏,宋彦军,韦海涛,赵启祖,李 翠,冯小宇
(1.北京市动物疫病预防控制中心,北京 102600;2.中国兽医药品监察所,北京 100190)
猪瘟(classical swine fever,CSF)又称烂肠瘟,是由猪瘟病毒(classical swine fever virus,CSFV)引起的一种高致死性传染病。该病表现为接触性传染,以急性、败血性变化,实质器官出血、坏死和梗死,以及慢性呈纤维素性坏死性肠炎为主要特征。CSF是严重威胁养猪业的传染病之一,被世界动物卫生组织(OIE)列为须通报动物疫病[1],也是我国农业农村部规定的一类动物疫病[2]。近年来我国流行的CSF以非典型性临床症状和病理剖检特征为主[3]。目前CSF病原学检测方法主要是荧光定量RT-PCR[4],此外新兴的检测技术,如环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)也逐渐应用于CSFV检测领域[5]。但是现有的检测试剂种类繁多,检测灵敏度参差不齐,对结果的判定存在较大的误差和争议。
标准物质(reference material,RM)是具有一种或多种足够均匀且确定特性值的物质或材料,广泛用于校准、测试仪器,评价和控制测试方法,实验室量值传递、材料赋值,质量检定、质量控制,质量仲裁,生产过程检测等领域[6]。我国在生物医学检测领域,特别是对于动物病原微生物的标准物质研究相对滞后。因此,本研究制备CSFV核酸检测相关标准物质,以期为检测试剂可靠验证、实验结果判定及精准化疫病防控提供技术保障。
1 材料与方法
1.1 主要试剂
CSFV C株,购自中国兽医药品监察所;PK-15细胞,由北京市动物疫病预防控制中心实验室保存;DMEM低糖培养基,购自Gibco公司;冻干保护剂5%蔗糖牛奶,购自北京中海生物科技有限公司;病毒基因组DNA/RNA提取试剂盒,购自西安天隆科技有限公司;One-Step RT-ddPCR Kit for Probes、Droplet Generation for Probes,均购自伯乐公司;引物、探针,由英潍捷基有限公司合成。
1.2 主要设备
天隆科技自动化核酸提取仪,购自西安天隆科技有限公司;实时荧光定量PCR仪、QX100 Droplet Generator、PX1 Plate Sealer、QX100 Droplet Reader,均购自伯乐(Bio-Rad)公司;普通PCR仪,购自赛默飞世尔科技(中国)有限公司;FDU-1200型冻干机,购自东京理化器械株式会社;104/02型电子天平,购自METTLER TOLEDO公司。
1.3 候选物筛选与鉴定
猪瘟兔化弱毒疫苗(C株)是由我国石门强毒株(属于1.1基因亚型)通过兔体内连续传代致弱而来,对我国的CSF防控具有重要作用,也是世界公认具有良好免疫效果的弱毒疫苗,因此选用CSFV C株制备CSFV核酸检测标准物质。通过测序及序列比对,鉴定购自中国兽医药品监察所的CSFV C株。
1.4 核酸标准物质的制备
培养PK-15细胞生长至70%以上的单层时,弃去培养液,按培养液体积的10%接种经过鉴定的CSFV C株,同时设置正常细胞作为阴性对照。接种完后,将细胞置于37 ℃ 5% CO2培养箱孵育3 h,回收病毒液,补加含2% FBS的DMEM培养液,再置于37 ℃ 5% CO2培养箱静置培养48 h。收获病毒液,进行无菌检验。56 ℃水浴4 h灭活,将病毒培养液与冻干保护剂按1:1的比例等体积混匀,每瓶1 mL分装于冻干瓶内。分装后放入超低温冰箱内预冻24 h,按照EYELA FDU-1200冻干机操作说明进行冻干后保存于(-20±5)℃环境中。
1.5 标准物质检验
1.5.1 物理性状检验 对冻干后的CSFV C株核酸标准物质开展物理性状检验,应呈白色均一粉末。
1.5.2 病毒灭活检验 将CSFV核酸标准物质溶解后接种于PK-15细胞,每天观察细胞病变,连续观察3~7 d,无论有无细胞病变,一律将培养物收获,冻融后再进行传代,每个样品至少盲传3代,盲传3代后,观察各代次细胞,并通过CSFV荧光定量RT-PCR方法对各代次细胞进行检测。
1.5.3 支原体检验 通过支原体培养方式检测制备的核酸标准物质是否存在支原体污染。
1.5.4 其他病毒检验 对猪繁殖与呼吸障碍综合征病毒美洲变异株(PRRSV JXA1)、猪繁殖与呼吸障碍综合征病毒欧洲株(PRRSV LV)、猪圆环病毒1型(PCV1)、猪圆环病毒2型(PCV2)、猪伪狂犬病毒(PRV)、猪细小病毒(PPV)、猪流行性腹泻病毒(PEDV)和猪传染性胃肠炎病毒(TGEV)共八种其他病毒,依据国标等标准检测方法进行检验。
1.5.5 水分检验 依据《中国药典》2015年版一部附录,按照其规程操作,进行水分测定[7]。
1.6 均匀性评估
根据我国《标准物质定值的通用原则及统计学原理》(JJF1343—2012)[8]规定,当总体单元少于500时,抽取单元数不少于15个;当总体单元数大于500时,抽取单元数不少于25个。本批CSFV C株核酸标准物质共制备了300瓶,随机选取15瓶,每瓶取样3次。采用数字PCR方法对核酸标准物质的核酸含量进行检测,通过SPSS 23.0软件对数据进行统计分析,使用方差分析法(F检验)进行均匀性检验。
1.7 稳定性评估
标准物质的稳定性是衡量标准物质的一个重要参数,包括短期稳定性和长期稳定性。短期稳定性与样品运输过程中的外部因素有关,长期稳定性与贮存条件有关。
1.7.1 短期稳定性评估 随机抽取一定量的CSFV C株核酸标准物质并做好标记,分别放置于4、25、60 ℃的环境中。每周定期抽取3管CSFV C株核酸标准物质,每管样品重复检测3次。采用数字PCR方法检测,通过SPSS 23.0软件利用T检验分析数据,P<0.05表示差异显著。
1.7.2 长期稳定性评估 随机抽取一定量的CSFV C株核酸标准物质并做好标记,放置于(-20±2)℃(本品贮存条件)的环境中数月,分别在第0、1、2、4、6、8、11个月,每次抽取3管CSFV C株核酸标准物质,每管样品重复检测3次,采用数字PCR进行检测,计算均值,并利用线性回归方法分析数据。
1.8 开瓶稳定性评估
抽取CSFV C株核酸标准物质3管,每管进行5次开瓶检测,每次检测后需盖紧管盖,置于自封袋中密封,于-20 ℃保存。再次称量前,需60 ℃烘干瓶壁水分,再做后续检测。每管样品重复检测3次,以第1次开瓶的检测数据为对照组,采用数字PCR进行检测,计算均值。通过SPSS 23.0软件利用T检验分析数据,P<0.05表示差异显著。
1.9 标准物质定值
通过具备资质的8家实验室(表1)独立使用数字PCR方法对CSFV C株核酸标准物质的特性值进行测量,获得定值数据。采用狄克逊法和格拉布朗法分别检验8家实验室8组数据的可疑值。采用科克伦法检验平均值间是否等精度,通过SPSS 23.0软件,利用T检验分析数据。若各组测量数据是等精度数据,并且组间平均值无显著性差异(P>0.05),则标准值可用各组数据算术平均值的平均值除以核酸回收率来表示。

表1 标准物质合作测试实验室
1.10 不确定度评定
标准物质定值结果的不确定度包括3部分:标准物质均匀性引入的不确定度、标准物质稳定性引入的不确定度以及标准物质定值过程带来的不确定度。其中,定值不确定度包括不确定度A类评定和不确定度B类评定。不确定度A类评定,对测量数据的标准偏差、测量次数及所要求的置信水平按统计学计算方法进行;不确定度B类评定包含四部分:第一部分是天平称量引入的不确定度,第二部分是稀释引入的不确定度,第三部分是检测仪器引入的不确定度,第四部分是核酸回收率引入的不确定度。
将定值相对不确定度与均匀性相对不确定度、稳定性相对不确定度,按照平方和开方的方法叠加获得相对不确定度,即合成标准不确定度的相对值,记为uCRM。该相对不确定度乘以因子(该因子称为包含因子,记为k),再乘以标准值,得出的不确定度称为扩展不确定度或称总不确定度,记为U。
1.11 量值结果表示
CSFV C株核酸标准物质的量值(copies/mg)=标准值±扩展不确定度。
1.12 临床试用
通过3家不同实验室验证CSFV C株核酸标准物质的产品性能,主要测试产品的均匀性、量值的准确性、产品质量的稳定性。随机抽取核酸标准物质各5管,低温保存运送至试用单位进行荧光定量PCR检测。试用单位在检测日常临床样本时,将试用的核酸标准物质(取样量不少于50 μL)和临床样本同时进行核酸提取后,严格按照检测试剂的说明书将标准物质和临床样本一同进行荧光定量PCR检测,每次检测1管标准物质,每管重复检测2次。
2 结果
2.1 候选物鉴定
购自中国兽医药品监察所的CSFV C株与GenBank编号Z46258.1的CSFV C株核苷酸相似度为100%(图1)。
2.2 标准物质制备
分装冻干,压盖后获得CSFV C株核酸标准物质。
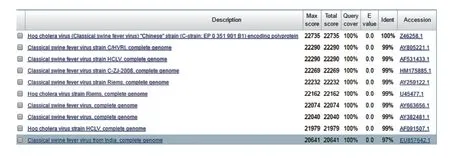
图1 CSFV基因测序及序列比对结果
2.3 标准物质检验
2.3.1 物理性状检验 CSFV C株核酸标准物质呈白色均一粉末(图2)。

图2 CSFV C株核酸标准物质物理性状
2.3.2 病毒灭活试验 未发现细胞病变且经荧光定量RT-PCR检测结果表明,CSFV核酸含量不随培养物代次增加而增加,说明无病毒增殖。
2.3.3 支原体检验 支原体检测为阴性,说明核酸标准物质未受支原体污染。
2.3.4 其他病毒检验 依据国标等标准检测方法,对PRRSV JXA1、PRRSV LV、PCV1、PCV2、PRV、PPV、PEDV和TGEV共8种其他病毒进行检验,检测结果均为阴性(表2)。
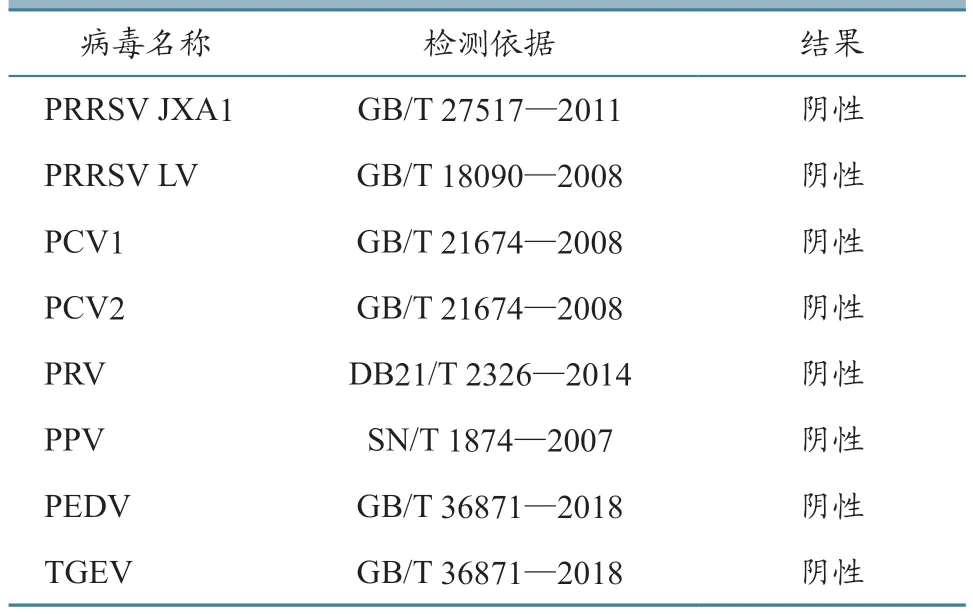
表2 其他病毒检验
2.3.5 水分检验 依据《中国药典》2015年版一部附录,按照其规程操作,进行水分测定,本标准物质含水量均不高于3.0%,符合《兽医检测用核酸标准物质研制技术规范》要求。
2.4 均匀性评估
根据随机抽取的15瓶CSFV C株核酸标准物质每瓶检测3次的数据(表3)、自由度及给定的显著性水平α,由表查询临界值的Fα值,算得F<Fα(F(0.05,14,30)=2.04),表明组内与组间无统计学差异(P>0.05),样品是均匀的(表4)。
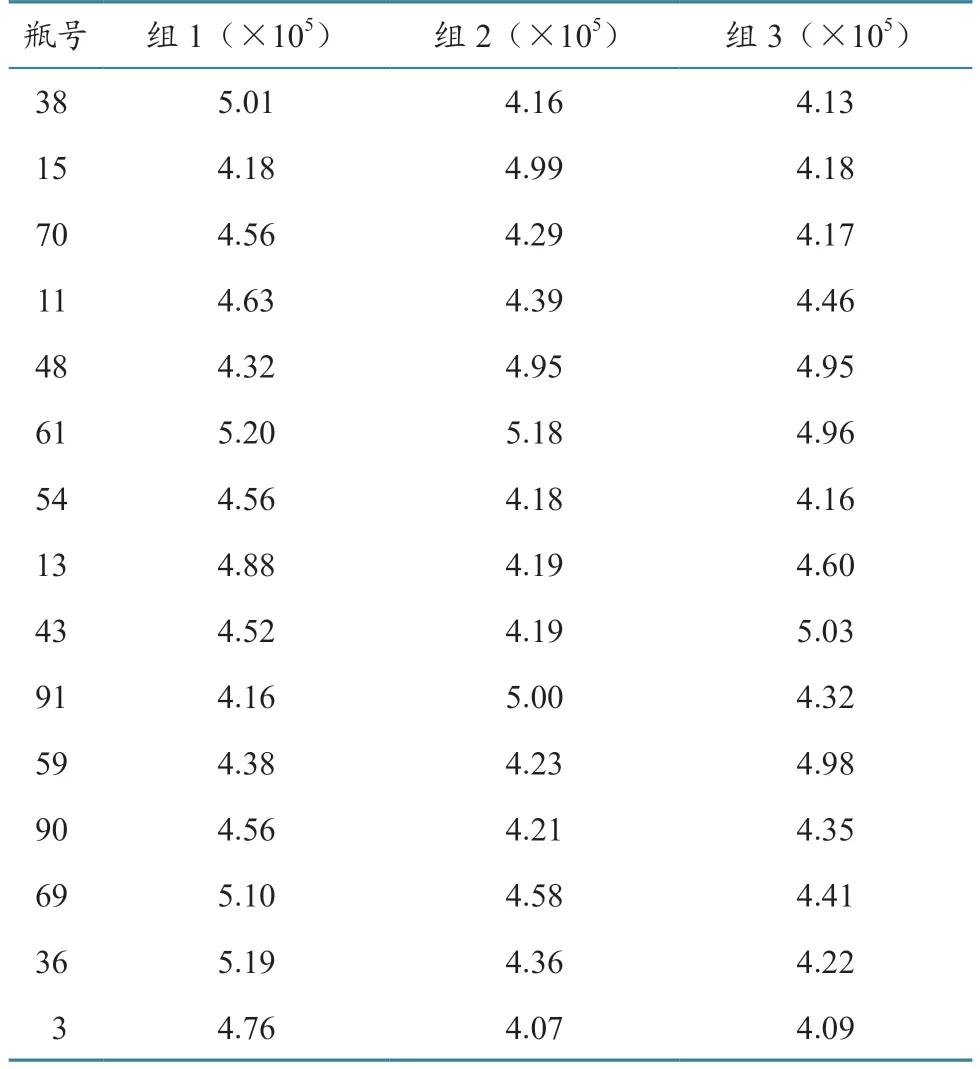
表3 CSFV C株核酸标准物质核酸含量检测结果 单位:copies/mg
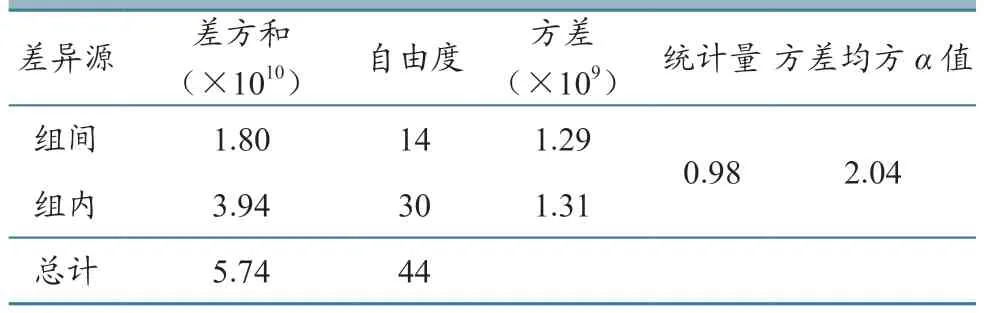
表4 CSFV C株核酸标准物质均匀性方差分析
2.5 稳定性评估
2.5.1 短期稳定性评估 CSFV C株核酸标准物质在4、25和60 ℃环境中放置数周,分别与放置在-80 ℃的标准物质进行配对T检验,检测结果的P值与0.05比较。表5显示,该标准物质在4 ℃下可稳定存放4周,在25 ℃可稳定存放1周,无法存放于60 ℃环境中。
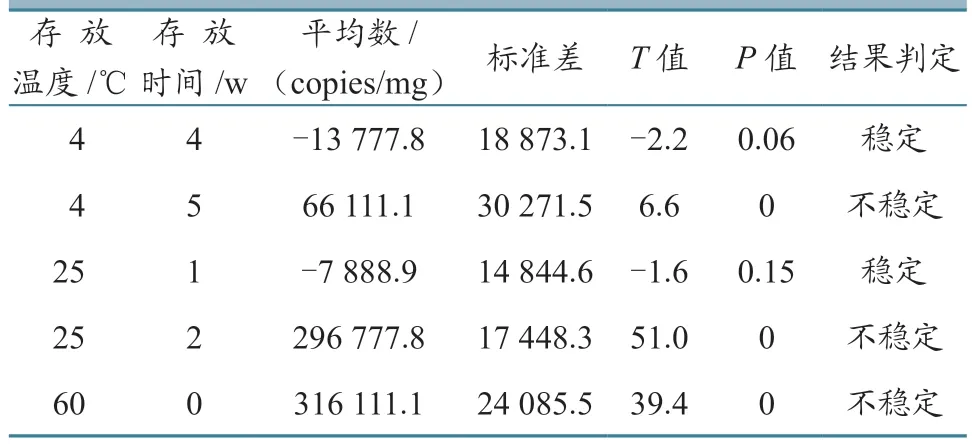
表5 短期稳定性评估结果
2.5.2 长期稳定性评估 对CSFV C株核酸标准物质在-20 ℃贮存条件下稳定性结果进行线性回归分析。第11个月|β1|/s(β1)的结果为1.40,小于对应的T(0.05,5)临界值为(2.57),认为斜率无显著性差异(P>0.05),未观测到不稳定性;第12个月|β1|/s(β1)的结果为4.73,大于对应的T(0.05,5)临界值(2.57),认为斜率存在显著性差异(P<0.05)。故本标准物质在-20 ℃环境下可稳定11个月。
2.6 开瓶稳定性评估
随机抽取3瓶CSFV C株核酸标准物质进行第1~5次开瓶检测,然后将第2~5次的检测结果,分别与第1次进行配对T检验。结果(表6)显示,均显示无显著性差异(P>0.05)。
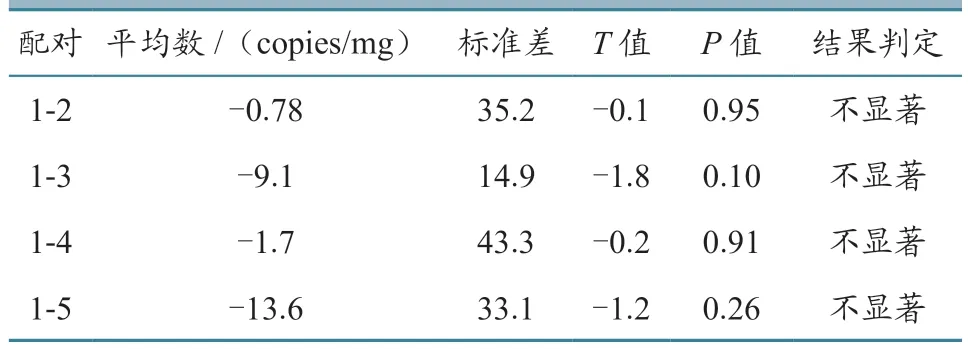
表6 开瓶稳定性t检验结果
2.7 标准物质定值
由8家合作定值实验室统计结果可知,各组测量数据是等精度数据,并且组间平均值无显著性差异,故此,测量结果可用算术平均值表示。
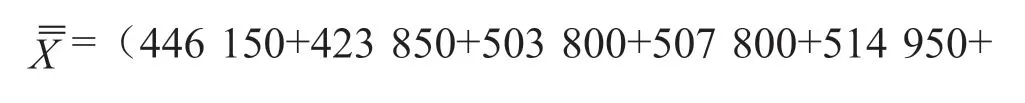
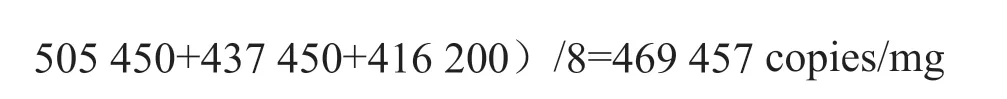
标准值=算术平均值/核酸回收率,其中算数平均值为469 457 copies/mg,核酸回收率为92%,故标准值为5.1×105copies/mg。
2.8 不确定度评定
2.8.1 均匀性引入的不确定度 CSFV C株核酸标准物质均匀性产生的不确定度即为测量结果的标准偏差,其相对标准不确定度(ubb)=(CSFV C株核酸标准物质均匀性测量结果的标准偏差Sbb)/(CSFV C株核酸标准物质均匀性测量结果的平均值)。

2.8.2 稳定性引入的不确定度 稳定性引入的不确定度由CSFV C株核酸标准物质-20 ℃储存11个月的长期稳定性产生的不确定度来计算。

2.8.3 定值过程引入的不确定度 不确定度A类评定通过测量数据的标准偏差、测量次数及所要求的置信水平按统计学计算方法进行。

CSFV C株核酸标准物质不确定度B类评定包含天平称量引入的不确定度、稀释引入的不确定度、检测仪器引入的不确定度以及核酸回收率带来的不确定度。

2.8.4 相对不确定度 定值相对不确定度与均匀性相对不确定度、稳定性相对不确定度按照平方和开方的方法叠加获得相对不确定度,即合成标准不确定度的相对值。
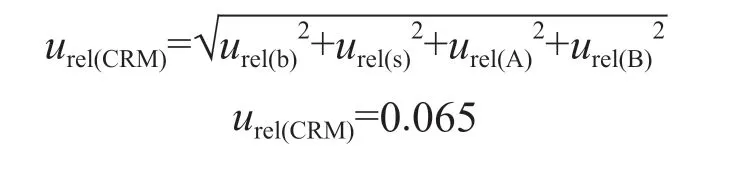
2.8.5 扩展不确定度评定 相对不确定度乘以包含因子(取包含因子k=2),再乘以标准值,即为扩展不确定度,记为U。
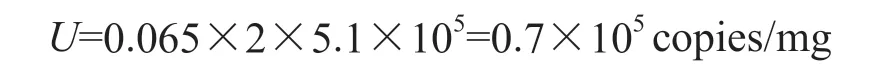
2.9 标准物质的量值
CSFV C株核酸标准物质的量值为(5.1±0.7)×105copies/mg。
2.10 临床试用
3家试用单位检测CSFV C株核酸标准物质的CT值均处于18~22之间,且CV值均小于10%(表7)。试验结果显示,该产品均一性良好、量值的准确度高、产品质量稳定,与临床样本的互通性良好。
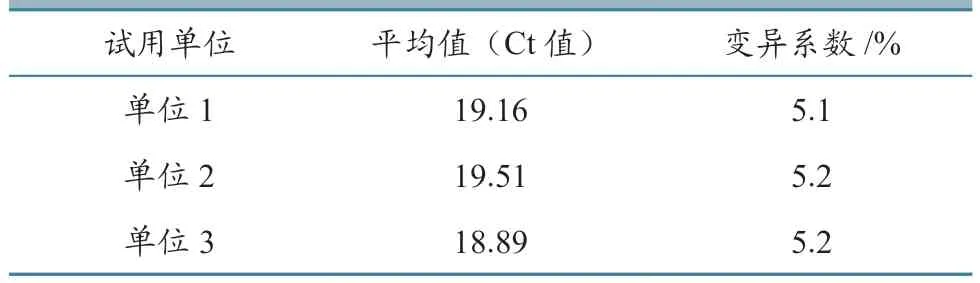
表7 CSFV C株核酸标准物质试用结果
3 讨论
近年来,国际学术机构不断提出“检验结果一致化”的概念和相关技术途径[9],通过可溯源至SI单位的参考物质确保临床检验检测结果的准确性、可比性和溯源性。目前,我国也将病原微生物标准物质的研制提上日程,通过国家一级、二级标准物质进行溯源。标准物质的定值方式也由通过传统的荧光定量PCR技术进行相对定量转变成利用新兴的微滴式数字PCR技术进行绝对定量。
微滴式数字PCR技术[10]是一种新兴的利用绝对定量方式检测核酸的技术。其技术原理是利用数字PCR系统核心的微滴化技术将一份样品分成多个反应的微滴,每个微滴对应1个单独的反应单元,在PCR扩增结束后存在荧光信号(产物)记为1,没有荧光信号(产物)记为0。本质上将传统荧光定量PCR的1个反应变成多个独立反应,大大提高了核酸序列检测的灵敏度和精准度。
本研究采用微滴式数字PCR进行绝对定值,同时严格按照《标准物质定值的通用原则及统计学原理》(JJF1343-2012)规定,对研究制备的CSFV C株核酸标准物质进行均匀性评估、稳定性考察、合作定值、不确定度评定,最终该核酸标准物质通过了全国标准物质管理委员会的评审并获得国家二级标准物质证书[证字第2015 GBW(E)091014]。有证标准物质可以市场流通销售,满足了动物及动物产品质量安全检测领域对标准物质的需求,可用于实验室能力验证、仪器校准和测试、检测方法评价和控制、实验室质量控制、生产过程检测等领域,有利于大幅提升疫病监测、诊断的效率及准确性,有效保障CSF防治工作的开展,推进CSFV核酸分子检测标准化及我国CSFV体外诊断试剂[11]的量值溯源和检测结果一致化。
综上,本研究通过细胞培养CSFV,添加适量的稳定剂和保护剂冻干保存,获得CSFV核酸标准物质。采用数字PCR方法,由多家实验室合作定值,并对数据进行统计分析,确定标准物质的量值和评定不确定度。本研究研制的CSFV核酸标准物质通过了全国标准物质管理委员会的评定,均一性良好、稳定、量值准确度高,可用于动物及动物产品质量安全检测。
