PCV4 SYBR Green I实时荧光定量PCR方法的建立及应用
2020-10-10黄小武闭璟珊韦正吉邹联斌赵子欣闫修魁韩知晓辛佳亮
黄小武,杜 倩,闭璟珊,韦正吉,邹联斌,赵子欣,闫修魁,韩知晓,辛佳亮,郑 敏
(1.柳州市动物疫病预防控制中心,广西柳州 537000;2.广西大学动物科学技术学院,广西南宁 530001;3.广西壮族自治区动物疫病预防控制中心,广西南宁 530001)
猪圆环病毒(porcine circovirus,PCV)属于圆环病毒科(Circoviridae)、圆环病毒属(Circovirus),是目前发现最小的病毒之一[1]。PCV为无囊膜单股正链环状DNA病毒,病毒基因组全长约1.7~2.0 kb,包含两个主要的开放阅读框ORF1和ORF2,分别编码复制酶蛋白(replicase protein,Rep)[2]和衣壳蛋白(capsid protein,Cap)[3]。其中Cap蛋白包含多个中和抗体表位[4]。2019年之前,仅发现了PCV的3个成员。其中,PCV1对猪没有致病性;PCV2和PCV3被认为是猪圆环病毒病的主要病原体,可引起断奶仔猪多系统衰竭综合征(postweaning multisystemic wasting syndrome,PMWS)和猪皮炎与肾病综合征(porcine dermatitis nephropathy syndrome,PDNS)等临床疾病,给养猪业带来了巨大的经济损失[5]。
2019年,我国在湖南省患有呼吸道、消化道疾病和PDNS的猪群中首次检测到了另一种新型猪圆环病毒——PCV4,其与PCV1~3型具有明显的遗传差异[6]。为进一步了解PCV4在国内外的流行情况,迫切需要一种快速、简便、灵敏度高及特异性好的检测方法,为此,本研究拟建立一种针对PCV4的SYBR Green I实时荧光定量PCR检测方法,以期为PCV4相关疫病的早期诊断和分子流行病学调查提供技术保障。
1 材料与方法
1.1 材料、试剂与仪器
PCV1(GXdx115、KX827778),PCV2(疫苗株SX07株),PCV3(Shandong-01、MH107161),猪流行性腹泻病毒(PEDV,疫苗株CV777株)和猪繁殖与障碍呼吸综合征病毒(PRRSV,疫苗株TJM-F92株)等,均由广西壮族自治区动物疫病预防控制中心保存;56份猪临床样本,采集于广西南宁、桂林及河池等地猪场;FastPure® Plasmid Mini Kit质粒小提试剂盒、FastPure® Blood/Cell/Tissue/Bacteria DNA Isolation Mini Kit及DL 15 000 DNA Marker,购自南京诺唯赞生物科技有限公司;SYBR Green I PCR Master Mix,购自美国Promega公司。
1.2 引物设计与合成
根据NCBI上已发表的PCV4基因序列(GenBank登录号MK986820.1),选取Rep基因保守区域,利用Primer 5.0设计合成一对特异性引物,PCV4-QF:5'-AAACAGCATATTGACGCTGG-3';PCV4-QR:5'-CGTTCTGTGCCTGGAATGAT-3',扩增片段长度为146 bp。引物由华大基因科技有限公司合成。
1.3 标准品质粒制备
选择PCV4Rep基因保守区域送华大基因合成,克隆至pUC57载体并命名为pUC57-PCV4。将含有pUC57-PCV4的菌液接种于6 mL含氨苄青霉素的LB液体培养基中,37 ℃震荡培养11 h,按照质粒小提试剂盒说明书提取质粒后于4 ℃保存备用。
1.4 反应条件优化
以pUC57-PCV4质粒为模板,利用方阵法对模板用量、引物浓度、退火延伸温度及时间等条件进行优化,确定最适反应条件。
1.5 标准曲线建立
利用分光光度计测定标准品质粒浓度,并将浓度换算成拷贝数,拷贝数=[6.02×1014×浓度(ng/μL)]/(片段大小×660),获得阳性质粒的拷贝数为5.64×1010copies/μL。对标准质粒进行10倍梯度稀释,以梯度稀释后的质粒作为标准品。用优化后的反应条件进行荧光定量PCR扩增,建立标准曲线和熔解曲线。
1.6 敏感性检测
利用ddH2O对重组质粒pUC57-PCV4进行10倍梯度稀释,分别进行普通PCR与qPCR扩增,比较两种方法检测的最低拷贝数,同时设置阴性对照。
1.7 特异性检测
提取PCV1、PCV2、PCV3、PRRSV及PEDV阳性样品的基因组作为检测模板,以重组质粒pUC57-PCV4为阳性对照,ddH2O为阴性对照。以1.4中优化好的反应体系和条件进行SYBR Green I实时荧光定量PCR扩增,进行特异性试验并分析。
1.8 重复性检测
选取其中3个稀释梯度(5.64×104~5.64×106copies/μL)的标准品质粒作为模板,分别进行3次组内与组间平行试验,比较组内和组间的Ct值及变异系数。验证荧光定量PCR方法的重复性。
1.9 临床样品的检测
将采集的56份猪临床样品根据试剂盒说明书提取基因组DNA,利用本研究中建立的SYBR Green I实时荧光定量PCR方法进行检测。
2 结果
2.1 反应条件优化
通过方阵法对SYBR Green I实时荧光定量PCR反应体系和条件进行筛选和优化,确定最佳反应体系:2×SYBR Green I Master Mix 10 μL,上下游引物各0.3 μL,DNA 1 μL,ddH2O 8.4 μL。反应条件:95 ℃ 15 min;95 ℃ 10 s,62 ℃ 1 min,40个循环。
2.2 标准曲线建立
根据质粒浓度计算出标准质粒的拷贝数浓度为5.64×1010copies/μL,将标准质粒进行10倍梯度稀释后作为模板进行SYBR Green I实时荧光定量PCR扩增。结果显示,Ct值与标准品质粒拷贝数呈良好的线性关系(图1),线性回归方程为y=-3.638x+44.446,R2=0.999。
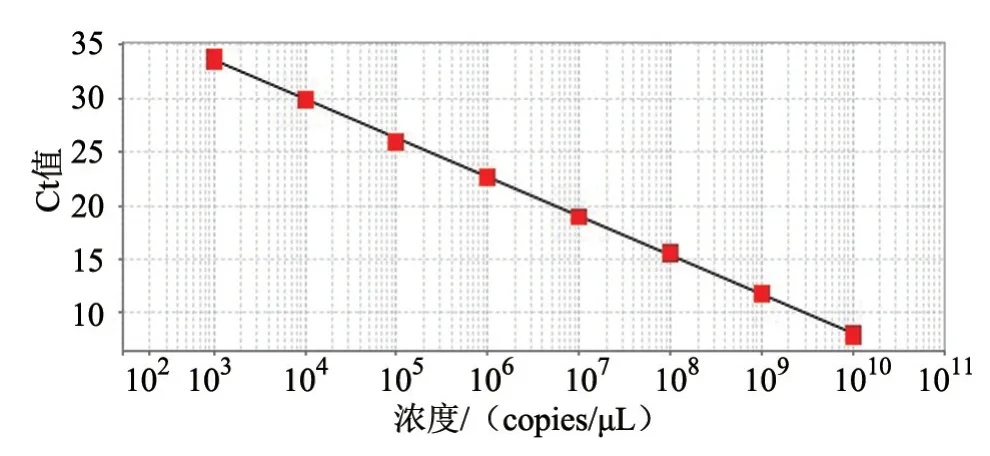
图1 标准曲线
2.3 熔解曲线
对不同拷贝数浓度的标准品质粒进行SYBR Green I实时荧光定量PCR扩增,结果(图2)显示,在82.3 ℃左右可见狭窄、单一的特异性熔解峰,熔解峰高度与标准质粒的浓度呈正相关。
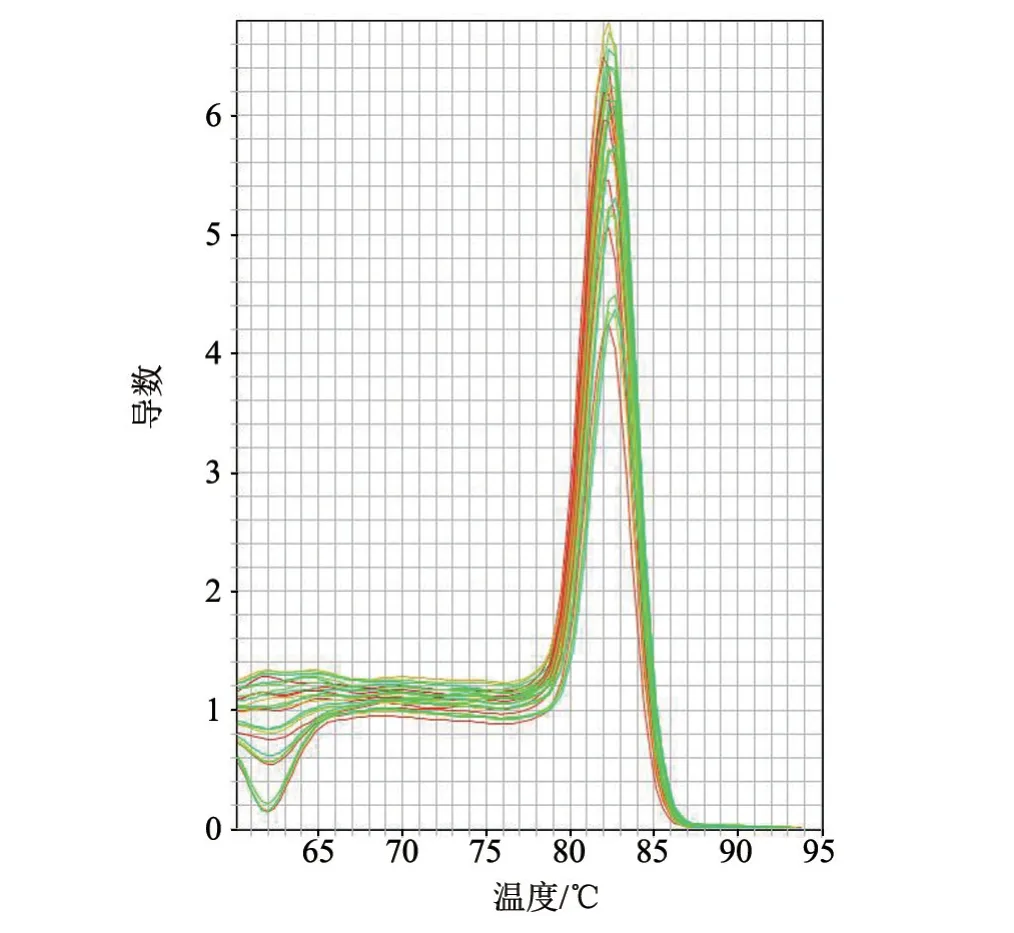
图2 熔解曲线
2.4 敏感性
用5.64×109~5.64×102copies/μL的标准质粒分别进行普通PCR和实时荧光定量PCR扩增,结果如图3和图4显示,实时荧光定量PCR的检测下限为5.64×102copies/μL,而普通PCR的检测下限为5.64×105copies/μL,实时荧光定量PCR方法检测PCV4的敏感性是普通PCR方法的1 000倍。
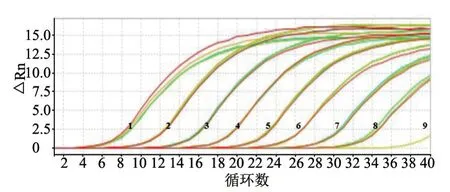
图3 SYBR Green I 实时荧光定量PCR敏感性分析结果
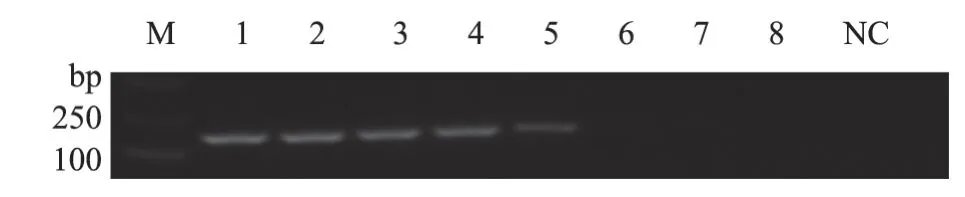
图4 普通PCR敏感性分析结果
2.5 特异性试验
利用本研究建立的SYBR Green I实时荧光定量PCR检测方法,以PCV1、PCV2、PCV3、PRRSV及PEDV基因组DNA为模板,验证方法的特异性。结果(图5)显示,仅PCV4出现特异性扩增,而PCV1、PCV2、PCV3、PRRSV、PEDV及阴性对照均未出现特异性扩增。
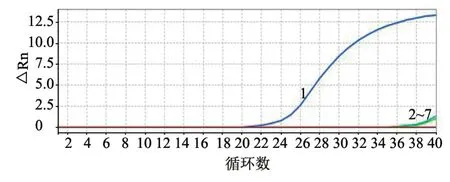
图5 特异性分析结果
2.6 重复性试验
以3个不同稀释倍数(5.64×104~5.64×106copies/μL)的标准品质粒为模板,进行荧光定量PCR扩增,分别进行3次组内和组间的重复性试验。结果(表1)显示,组内变异系数在0.08%~0.38%之间,组间变异系数在0.04%~0.08%之间,均小于2%,表明该方法具有较好的重复性,荧光定量PCR扩增效率稳定。
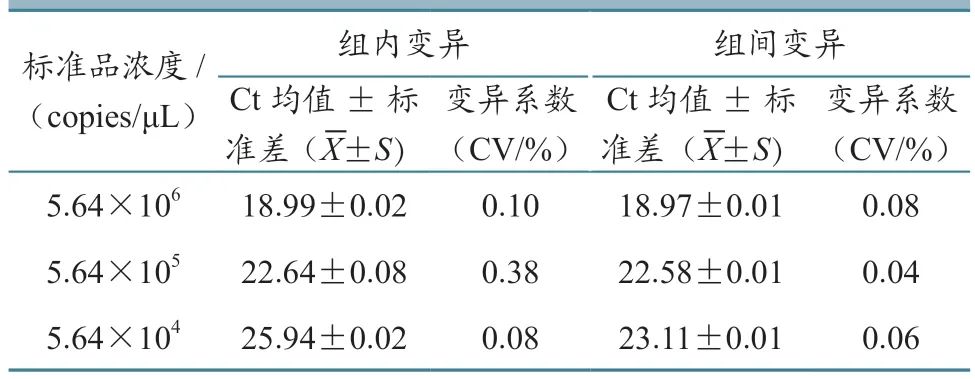
表1 SYBR Green I实时荧光定量PCR检测重复性试验结果
2.7 样品检测
利用本研究中建立的SYBR Green I实时荧光定量PCR检测方法,对56份猪临床样品进行检测,结果有2份样品检测为阳性,阳性率为3.57%(2/56)。其中,Ct值分别为30.148和19.935,拷贝数分别为8.5×103copies/μL和5.4×106copies/μL。将2份阳性样品扩增产物回收后送公司测序,发现与PCV4参考毒株HNU-AHG1-2019同源性为100%。使用普通PCR方法检测上述56份猪临床样品,仅检测到1份样本为阳性,阳性率为1.79%(1/56),且与荧光定量PCR检测结果一致。
3 讨论
PCV是猪圆环病毒病的元凶。多项研究证实PCV主要诱导淋巴细胞的凋亡导致免疫抑制和耗竭,进而促进其他病原体的感染与增殖[7-9]。临床上PCV主要引起PMWS和PDNS。此外,PNP(增生性坏死性肺炎)、PRDC(猪呼吸道疾病综合征)、繁殖障碍、先天性颤抖、肠炎等疾病亦与PCV2感染有重要关联[10]。近年来,PCV在全球多个国家暴发流行,而且流行范围正不断扩大[11]。流行病学调查显示,我国多个省份猪场均检测到PCV2和PCV3,且部分地区阳性率高达80%以上,说明PCV已经在我国广泛传播[12]。此外,PCV2和PCV3均被证实能跨物种传播[13-14]。2019,从我国湖南省有严重临床症状的病猪样本中检测到一种新型PCV—PCV4。通过基因组比对分析,该病毒与PCV1、PCV2和PCV3的全基因组同源性仅为43.2%~51.5%,ORF2的核酸序列同源性仅为24.5%~45%,表明PCV4是一种与PCV1、PCV2和PCV3完全不同的新型PCV。随后河南省和陕西省的猪场均检测到该病毒[15]。流行病学调查表明PCV4可能与PCV2和PCV3相似,引起PMWS和PDNS。
PCV4作为一种新发现的病毒,尚没有成熟稳定有效的检测方法,急需一种敏感性好、特异性高的检测方法。实时荧光定量PCR由于操作简单、适合大量样本检测,已经逐渐在病原微生物检测、临床样品检测和基因研究等方面得到广泛应用。SYBR Green I作为常用的荧光染料,对双链DNA具有高度专一性,且对引物设计要求一般,成本低且操作简便。SYBR Green I实时荧光定量PCR方法已经在PCV2和PCV3检测中得到广泛应用和验证。本试验根据NCBI上已公布的PCV4的Rep基因保守区域设计了1对特异性引物,通过对PCR反应体系和条件进行筛选和优化,以标准品质粒为模板建立一种针对PCV4的SYBR Green I实时荧光定量PCR检测方法。本试验建立的SYBR Green I实时荧光定量PCR方法的标准品与Ct值在5.64×102~5.64×109copies/μL范围内呈良好的线性关系,R2为0.999,检测下限为5.64×102copies/μL。郭慧娟等[16]建立的针对PCV2的荧光定量PCR方法检测下限为6.84×102copies/μL,李卓昕[17]建立的针对PCV3的荧光定量检测方法检测下限为4.24×101copies/μL。以上结果表明本研究建立的SYBR Green I实时荧光定量PCR方法灵敏度能够满足临床检测需要。利用该方法检测PCV1、PCV2和PCV3均未出现特异性扩增,特异性熔解峰均在82.3 ℃,组间和组内的变异系数均小于2%,表明本研究建立的方法重复性好。利用本研究建立的SYBR Green I实时荧光定量PCR方法对56份临床样本进行检测,阳性率为3.57%(2/56),检测结果与测序结果相符,而普通PCR检出率仅为1.78%,说明本研究建立的荧光定量方法更加灵敏可靠,更加适用于临床检测。
综上所述,本研究建立了一个快速、灵敏、特异的PCV4 SYBR Green I实时荧光定量PCR检测方法,能初步满足其临床快速诊断需要。
