基于MRP2的灯盏花素对辛伐他汀药物体内转运过程的影响
2020-10-10鞠爱霞赵娇单万亭孙爽肖洪彬李秋红
鞠爱霞,赵娇,单万亭,孙爽,肖洪彬,李秋红
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
辛伐他汀(Simvastatin,SV)是常用他汀类口服片剂,对3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶有高度的选择性抑制作用,使肝脏胆固醇合成减少而具有显著的降血脂效果,因良好的患者依从性和较少的不良反应而受到广泛关注[1]。临床研究表明[2-6],辛伐他汀能够有效预防心血管疾病,降低病死率。与其他他汀药物(洛伐他汀、阿托伐他汀等)相比,辛伐他汀具有较好的治疗效果, 更能提高患者的生命质量[7]。他汀类药物是被《美国心脏病学杂志》主编称为能和青霉素媲美的药物,用于心血管疾病的一级预防和治疗。但心脑血管疾病机制较为复杂,包括血小板聚集、血液粘稠度增加、多种炎症介质释放等[8-9]。临床研究和实践证实,灯盏花素(Breviscapine,BRE)(药用灯盏细辛的有效成分)具有抗凝改善循环、抗炎抗氧化、抗凋亡、神经保护、防止血栓形成等药理作用[10-14],对心脑血管疾病具有较好的疗效[15-16]。相关研究发现[17-18],灯盏花素与辛伐他汀联用治疗心脑血管疾病疗效优于辛伐他汀单独治疗。辛伐他汀为转运体MRP2的底物[19-20],而灯盏花素对转运体MRP2具有抑制作用,理论推测灯盏花素通过抑制MRP2,使辛伐他汀外排减少,导致辛伐他汀组织分布增加、血药浓度增加、排泄减少等。但目前尚无基于MRP2的灯盏花素与辛伐他汀联用后辛伐他汀转运过程的相关研究。因此,本研究建立高效液相色谱法,考察灯盏花素和辛伐他汀联用后对小鼠体内辛伐他汀的组织分布的影响和大鼠胆汁累计排泄的影响,同时应用逆转录聚合酶链反应(RT-PCR)技术和免疫蛋白印迹 (Western blot)技术测定药物对大鼠肝脏MRP2mRNA表达水平和蛋白表达的影响,为灯盏花素与辛伐他汀两药在临床上的合理应用提供实验支持。
1 材料
1.1 药品与试剂
辛伐他汀对照品(中国食品药品检定研究院,批号:100601-201003),辛伐他汀片(济南利民制药有限责任公司,批号:1511424-3),洛伐他汀对照品(内标,中国食品药品检定研究所,批号:100601-201003),灯盏花素注射液(石药银湖制药有限公司,批号:1011604262),戊巴比妥钠(Merck试剂公司,批号:P11011),动物组织RNA快速抽提试剂盒(上海生工生物工程股份有限公司,批号:D301KA4963),引物序列:MRP2及β-actin引物(上海生工生物工程股份有限公司),Quant One Step RT-PCR试剂盒(北京天根生物技术股份有限公司,批号:P4808),ECL发光液(碧云天生物技术公司,批号:EL0419004),乙腈(TEDIA试剂公司,批号:AS1122-001),氯仿其他试剂均为色谱纯纯,水为超纯水。
1.2 仪器
LC-2010A型高效液相色谱仪(日本岛津公司),KL512型氮气吹干仪(北京成萌伟业有限公司),DY89-II型匀浆仪(宁波新芝生物科技股份有限公司),PTC-200型PCR扩增仪(上海蕴策生物科技有限公司),UV-722型紫外可见分光光度计(日本岛津公司),GIS2010型凝胶图像处理设备(上海天能科技有限公司),AlphaEaseFC4.0型紫外凝胶成像系统(美国),Legra64R型BECKMANAL低温高速离心机(美国贝克曼库尔特有限公司),Direct Detect III型红外微定量分析仪(上海默克化工技术有限公司),BIO-RAD Universal Hood III型成像系统(美国Bio-Bard公司)。
1.3 实验动物
健康SD雄性大鼠,周龄8~10周,体质量180~220 g,健康KM雄性小鼠,周龄6~8周,体质量25~30 g,均购于青岛派特福德白鼠养殖公司SCXK(鲁)2014-004。
2 方法
2.1 给药方案及样品采集
将60只健康KM小鼠随机均分成2组,辛伐他汀组尾静脉注射生理盐水;灯盏花素与辛伐他汀组尾静脉注射灯盏花素(40 mg·kg-1)连续给药7 d,末次给药后同时灌胃辛伐他汀(80 mg·kg-1),两组分别于0.5 h,2 h,4 h,8 h,12 h,24 h处死小鼠,取心、肝、肾、脑组织,取一定量组织,加入适量生理盐水,匀浆,各组织匀浆样品置-20 ℃冷冻保存。
10只健康SD大鼠随机均分成2组,辛伐他汀组:尾静脉注射生理盐水;灯盏花素与辛伐他汀组:尾静脉注射灯盏花素(20 mg·kg-1)给药7 d,末次给药后同时灌胃辛伐他汀(20 mg·kg-1),两组分别采集0~2 h,2~4 h,4~6 h,6~8 h,8~12 h,12~24 h的胆汁样品,记录不同时间段胆汁样品的体积,置-20 ℃冷冻保存。
2.2 生物样品处理
将组织/胆汁样品置于1.5 mL离心管中,加入50 μL洛伐他汀内标溶液,涡旋30 s,加入氯仿1 mL涡旋混合5 min,离心10 min,取上清夜,向离心管中再次加入氯仿1 mL重复上述操作,合并两次上清液,37 ℃氮气吹干,加入100 μL流动相复溶,涡旋 30 s,取上清液进样测定。
2.3 RT-PCR测肝脏MRP2 mRNA表达水平
20只SD大鼠随机平均分成生理盐水组,灯盏花素注射液组,辛伐他汀组,灯盏花素注射液与辛伐他汀组,连续给药7 d,末次给药后禁食12 h,处死,取出肝脏,生理盐水清洗,滤纸吸干水分。用动物总RNA快速抽提试剂盒提取RNA,所得RNA样品进行光密度和凝胶电泳检测,A260/A280值均在1.8~1.9之间,凝胶电泳经AlphaEaseFC4.0型紫外凝胶成像系统处理在5 s,18 s,28 s处有明显条带,说明提取的RNA纯度较高,结构完整。样品按Fast Quant 一步法RNA试剂盒说明书操作进行PCR扩增(引物序列:MRP2:5′sense5′-TTACCTCCATCACCCTCTTCAA-3′,3′Antisens5′-TCGTCTCCTCCCAAATACCTCT-3′;β-actin:5′sense5′-TTCAACGGCACAGTCAAG-3′,3′Antisense5′-CACACCCATAACAAACAT-3′),所得产物进行凝胶电泳(100 V,1 h),并用Image-Pro Plus软件分析灰度值。
2.4 Western blot测肝脏MRP2蛋白表达量
提取肝脏MRP2蛋白,红外微定量分析仪测蛋白浓度。制备8%分离胶和5%的浓缩胶,进行电泳(60 V,30 min;100 V,1.5 h),转膜时间依分子量大小而定MRP2(15 V,20~30 min)、β-actin(15 V,20~30 min),封闭(2 h),进行一抗和二抗孵育,ECL发光显影,Image lab软件测定光密度值和灰度值。目的基因的蛋白相对表达量=目的基因蛋白表达量/内参基因蛋白表达量。
2.5 生物样品中辛伐他汀方法学考察
2.5.1 色谱条件
色谱柱:Diamonsil(R) C18(150 mm×4.6 mm),流动相:乙腈-0.15%冰醋酸水溶液(64∶36,v/v),流速:1.0 mL·min-1,检测波长:238 nm,柱温:25 ℃,进样量:20 μL。
2.5.2 专属性考察
分别取空白生物样品、空白生物样品+洛伐他汀对照品(100 ng/mL)+辛伐他汀对照品,按“2.3”项下方法处理样品后,按“2.5.1”项下色谱条件进样测定。结果表明,生物样品中内源性物质不干扰辛伐他汀和内标的测定。辛伐他汀保留时间分别为13.5 min左右,内标洛伐他汀保留时间分别为10.5 min左右。液相色谱图见图1。
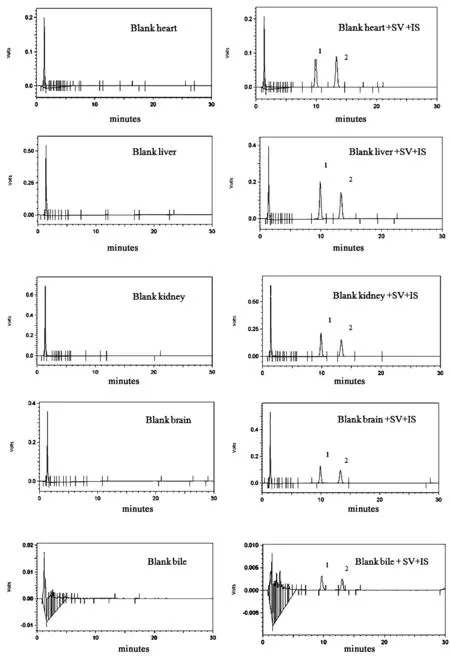
图1 辛伐他汀色谱图(1-内标,2-辛伐他汀)
2.5.3 标准曲线与线性范围
辛伐他汀各生物样品的标准曲线与线性范围如表1所示,r2>0.99,符合生物样品分析要求。
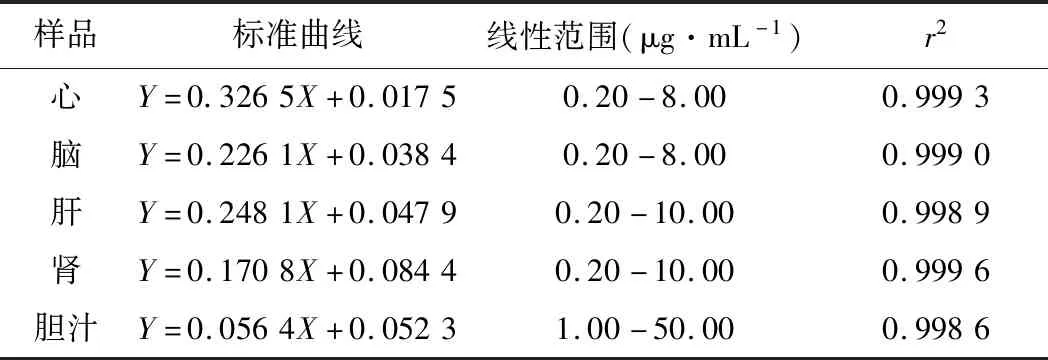
表1 辛伐他汀各生物样品的标准曲线方程
2.5.4 精密度与准确度考察
辛伐他汀日内、日间精密度RSD<10%,相对回收率在90%~110%之间,精密度和准确度达到要求。结果见表2。
2.5.5 稳定性考察
各组织和胆汁生物样品中辛伐他汀的高、中、低3个浓度在室温能稳定保存24 h,于-20 ℃冷冻保存能稳定21 d,解冻-冷冻重复循环3次仍能保持稳定;辛伐他汀标准品贮备液在室温下放置24 h或置于-20 ℃保存30 d后仍然是稳定。
2.6 统计学方法
表2 辛伐他汀的精密度及方法回收率
3 结果
3.1 灯盏花素对辛伐他汀组织分布的影响
辛伐他汀进入小鼠体内后迅速向各组织中分布,结果如表3,在0.5 h即可被检测到,辛伐他汀在各组织中分布浓度由高到低依次为:肝>肾>心>脑。各组织中,辛伐他汀的浓度随着时间的变化如图2所示。与辛伐他汀组比较,灯盏花素和辛伐他汀组显著增加辛伐他汀在各组织中的分布量,尤其在2 h、4 h、8 h、12 h时,肝中辛伐他汀的浓度含量增加均有显著性差异(P<0.05),表明灯盏花素可显著增加各组织中辛伐他汀的分布量,且对于肝脏的药物分布影响最为显著,可能有利于提高肝脏靶器官的药物浓度,从而提高药物的疗效。

表3 各组织不同时间点辛伐他汀的浓度
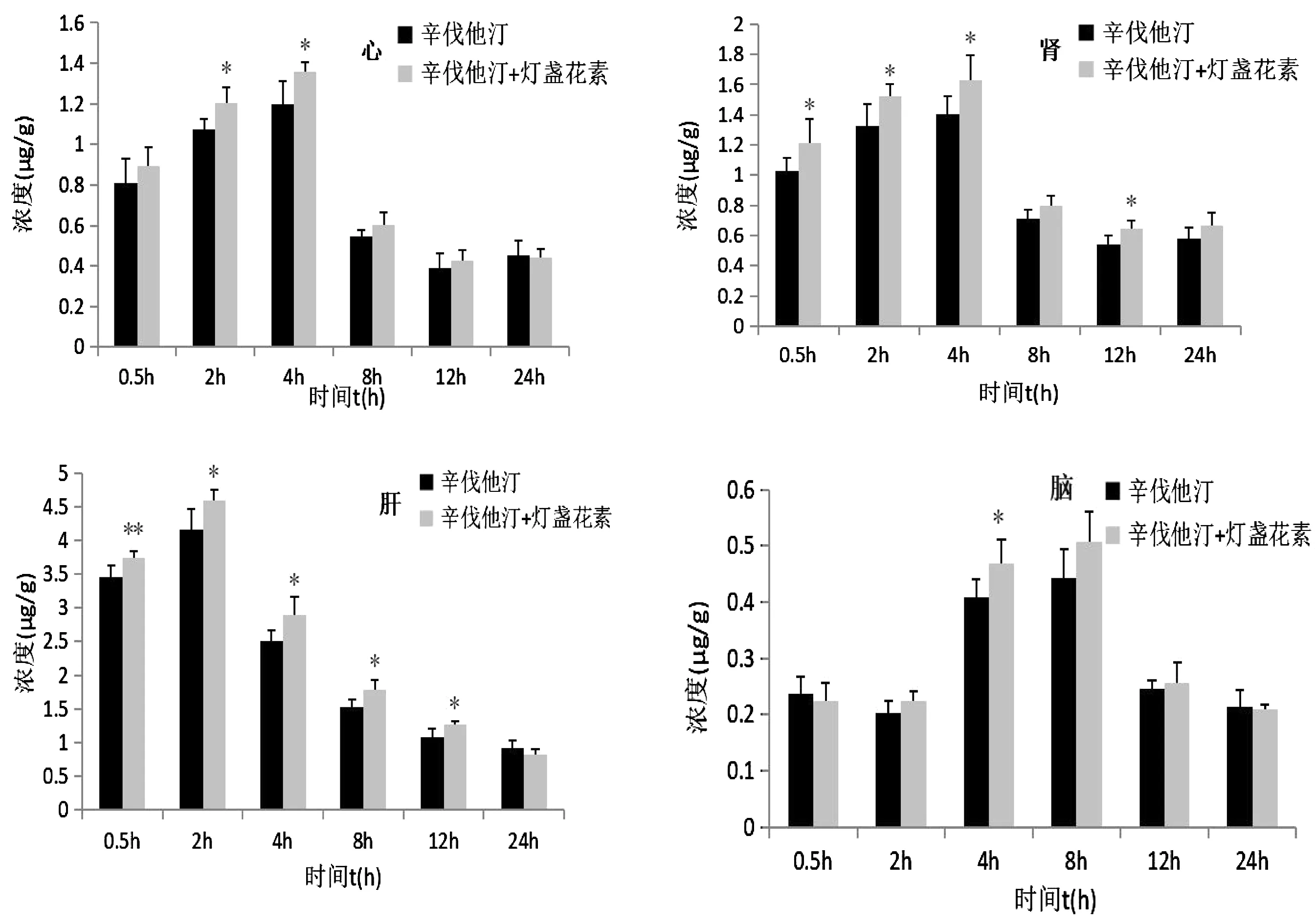
图2 心脏、肾脏、肝脏、脑中辛伐他汀的药物浓度(n=5)
3.2 灯盏花素对辛伐他汀胆汁排泄的影响
辛伐他汀各时间段的胆汁累积排泄量如表4所示,平均胆汁累积排泄量-时间曲线如图5,表明0~2 h内检测到辛伐在胆汁的排泄,2~4 h排泄量最大,6 h内辛伐他汀的排泄速度较快及排泄量较大随后逐渐平缓。与辛伐他汀组相比,灯盏花素与辛伐他汀组的平均胆汁排泄量显著性降低,尤其在4 h~8 h内差距逐渐增大,在24 h内胆汁累积排泄量降低了2.21%,表明灯盏花素抑制辛伐他汀的胆汁排泄。
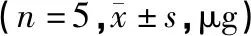
表4 各组辛伐他汀不同时间段的胆汁累积排泄量
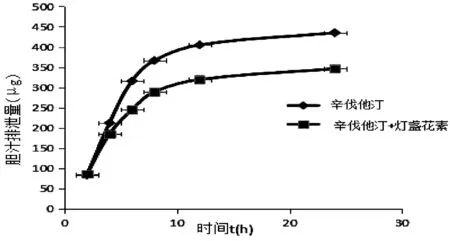
图3 辛伐他汀平均胆汁累积排泄量-时间曲线(n=5)
3.3 MRP2 mRNA表达水平检测结果
辛伐他汀组大鼠肝脏MRP2基因mRNA表达量略低于生理盐水组,但无统计学差异,而灯盏花素组与灯盏花素+辛伐他汀联合组均低于生理盐水组,有统计学差异(P<0.05)。从MRP2基因mRNA PCR扩增图看出,各组大鼠MRP2和β-actin均有表达,虽联合组和灯盏花素单独组大鼠肝脏MRP2基因mRNA表达量都降低,但两者间无统计学差异,表明灯盏花素在mRNA水平上抑制了MRP2基因的表达量。结果见图4、图5、表5。

图4 各组大鼠MRP2基因表达量

图5 MRP2 mRNA PCR扩增图
3.4 MRP2蛋白表达检测结果
分析表明与生理盐水组相比,灯盏花素组,灯盏花素与辛伐他汀联合组以及辛伐他汀组的MRP2蛋白表达均降低,但都无统计学差异。各组大鼠在MRP2蛋白条带均有表达,且联合组的蛋白表达略低于灯盏花素单独组表,但无统计学差异,表明灯盏花素对肝MRP2蛋白表达无影响。见图6、图7、表5。

图6 各组大鼠MRP2蛋白表达
图7 MRP2蛋白相对表达量
表5 各组大鼠MRP2mRNA和蛋白相对表达量
4 讨论
MRP2转运体是ABC家族的成员,广泛存在于小肠、肝脏等组织器官,但在体内表达最高的是肝脏,主要集中在肝细胞胆管侧膜[21],MRP2可以转运谷胱肝肽结合物、葡萄糖醛酸结合物或非结合型有机阴离子化合物,因而可以被多种药物诱导或抑制,同时可能受某些蛋白受体及miRNA[22]等调控影响,从而改变药物在体内的转运,影响药效,产生药物相互作用。
本研究选择临床使用广泛的灯盏花素注射液研究联用后对辛伐他汀的影响及可能机制,结果灯盏花素对辛伐他汀的转运过程产生显著影响,对MRP2 mRNA具有抑制作用但未在蛋白水平显示,可能原因是存在转录后调控及蛋白翻译调控等;同时有研究表明,灯盏花素为葡萄糖醛酸苷,是转运体MRP2的底物[23-24],而辛伐他汀是通过转运体MRP2排泄进入胆汁,两者竞争底物的可能性很大,因此灯盏花素对辛伐他汀转运过程的影响可能是通过灯盏花素抑制MRP2 mRNA转录水平和蛋白水平竞争性抑制一起作用的结果。此外,还有研究[25]证实可能是由于代谢酶CYP3A4介导的药物相互作用,灯盏花素可以抑制CYP3A4酶活性,辛伐他汀是CYP3A4酶的底物,从而抑制辛伐他汀代谢使体内辛伐他汀含量显著增加。
综上所述,本研究结果表明,灯盏花素与辛伐他汀在治疗剂量联合应用后灯盏花素通过抑制MRP2转运体对辛伐他汀体内转运过程产生影响,为两药临床联合应用机制研究提供基础。由于药物间的相互作用受多种因素影响,且存在种属差异,本研究结果具有一定的局限性,因此,在人体内单次或多次给药后灯盏花素对辛伐他汀药物转运过程是否有影响还需进一步研究。
