黄芪甲苷对缺血再灌注诱导的大鼠心肌细胞及线粒体自噬的调节作用机制研究
2020-10-10李旭阳张东伟赵宏月
李旭阳,张东伟,赵宏月
(辽宁中医药大学附属医院沈本医院内二科,辽宁 沈阳 110032)
心肌缺血再灌注损伤是心脏在经受较长时间的缺血后血液再灌注的一种不可逆的损伤,目前研究认为此病的发生会导致氧自由基异常增多、物质代谢改善、细胞内线粒体结构损伤和线粒体功能障碍等一系列的病理变化,上述病理变化相互影响,最终会导致心肌细胞发生凋亡作用[1-2]。目前临床对于抑制线粒体过度自噬的干预药物较多,但效果并不理想。黄芪甲苷属于中药黄芪的主要有效成分,也是黄芪多糖的主要成分,有研究表明[3],黄芪甲苷可在一定程度上对糖尿病肾病肾脏起到保护作用,能够通过内质网应激机制,一方面可抑制细胞凋亡,另一方面还可抑制炎症反应。但目前临床上对于黄芪甲苷对心肌线粒体自噬的影响机制并不完全明确,因此在本文研究中运用黄芪甲苷对心肌缺血再灌注大鼠心肌细胞凋亡以及线粒体自噬的影响,为临床上黄芪甲苷的应用提供新依据。
1 材料与方法
1.1 实验材料
实验动物:选取SPF级75只SD健康雄性大鼠,由常州卡文斯实验动物有限公司提供,体质量220~250 g。所有大鼠均养殖在干净笼子里,室温在(22.1±1.8)℃,相对湿度35%~40%,每天光照12 h,喂饮纯净水,饲养时间1周。本文研究所做实验均获得我院伦理委员会批准。
主要试剂:黄芪甲苷(液体状;纯度≥98%,南京春秋生物工程有限公司,CAS号:84687-43-4);小鼠抗大鼠Bcl-2抗体(上海信帆生物科技有限公司,货号:XFC1532)、小鼠抗大鼠Bax抗体(上海科敏生物科技有限公司,货号:DXT-STB12011)、小鼠抗大鼠Caspase-3抗体(上海恒斐生物科技有限公司,货号:bs-0081R-1),兔抗大鼠PINK1抗体(厦门研科生物技术有限公司,货号:YKA-AF1830a)、兔抗大鼠Parkin抗体(上海恒斐生物科技有限公司,货号:bs-1865R-1)、兔抗人p62抗体(武汉博欧特生物科技有限公司,货号:orb89844)、兔抗人LC3抗体(上海恒斐生物科技有限公司,货号:K000467P)。
1.2 方法
1.2.1 分组、建模及给药
选取75只大鼠,10只作为空白组,其余大鼠建立心肌缺血再灌注模型。参照吴宥熹等[4]研究实验方法建立心肌缺血再灌注模型。在建模前所有大鼠均禁食,使用75 mg/kg的戊巴比妥钠注射于大鼠腹腔行麻醉处理后采取仰卧位将大鼠固定于操作台上,大鼠四肢插入针状电极,之后使用标准Ⅱ导联对大鼠心电图进行记录。连接小动物呼吸机,将大鼠胸骨左缘肌肉组织钝性分离后将第四肋骨切断后将心包膜剪开,暴露出冠状动脉左前降支,之后使用无创缝合丝线在左心耳下方左前降支起始段下2~3 mm处进行进针处理,在动脉圆锥处进行出针处理,之后将左冠状动脉左前降支行结扎处理以引起缺血,以Ⅱ导联心电图ST段明显抬高大于0.1 mV或T波高耸,心肌颜色变暗红色为结扎成功。在缺血处理后的30 min后,再灌注120 min,ST段下降为再灌注成功的标志。建模过程中2只大鼠死亡,4只大鼠因心电图ST段无变化导致建模失败,最终建模成功64只,将建模成功的64只大鼠分为模型组、低、中、高剂量组各16只。建模成功后,低剂量组、中剂量组、高剂量组大鼠腹腔注射1 mg/kg、2 mg/kg、4 mg/kg的黄芪甲苷,每日1次,共干预1周,空白组和模型组不做任何处理。
1.2.2 病理组织学观察
在给药干预结束后随机选取各组中1只大鼠采用断头法处死,取心肌组织,4%多聚甲醛进行固定、脱水透明,浸蜡包埋,脱蜡、HE染色,脱水、透明,待封片晾干后在显微镜下观察大鼠心肌组织病理学表现。
1.2.3 心肌酶检测
在给药干预结束后使用30 mg/kg的戊巴比妥钠注射于各组剩余15只大鼠腹腔行麻醉处理,取腹主动脉血1 mL,3 000 r/min离心10 min,将血清分离出,之后使用ENCOREIO0型自动生化分析仪对各组大鼠乳酸脱氢酶(LDH)、心肌磷酸肌酸激酶(CK)以及谷草转氨酶(AST)等心肌酶进行检测。
1.2.4 心肌梗死面积检测
在心肌酶检测完成后随机选取各组中3只大鼠采用断头法处死,迅速取大鼠心脏,行TTC染色以明确未梗死与梗死心肌,其中未梗死区为红色、梗死区为白色,之后采用BI-2000医用图像分析系统计算大鼠心肌梗死面积。
1.2.5 心肌细胞凋亡情况、心肌细胞自噬体数量检测
在给药干预结束后随机选取各组中6只大鼠采用断头法处死,迅速取大鼠心肌组织,4%多聚甲醛固定24 h后行常规石蜡包埋,沿心脏横轴连续切片,液氮中冰冻保存。其中3份使用TUNEL法检测大鼠心肌细胞凋亡情况,另外3份检测心肌细胞自噬体数量。心肌细胞凋亡情况检测:取液氮中冰冻的切片行脱蜡处理,使用磷酸盐缓冲液进行洗涤,之后将50 μL的TUNEL检测液加入,在温度为30 ℃的避光环境下孵育1 h,再次使用磷酸盐缓冲液洗涤,在荧光显微镜下对心肌细胞凋亡数进行观察计数,之后计算心肌细胞凋亡指数,心肌细胞凋亡指数=阳性细胞数/总细胞数×100。心肌细胞自噬体数量检测:使用电镜观察各组大鼠心肌细胞自噬体数量,取液氮中冰冻的切片使用枸橼酸铅、醋酸双氧铀行双重染色,之后使用透射电镜观察各组心肌细胞自噬体结构,并拍照,使用计算1个铜网孔内自噬体数量,每个样本计数3个铜网孔内自噬体数量,取平均值。
1.2.6 Bcl-2、Bax、Caspase-3、PINK1/Parkin通路蛋白检测
使用Western blot检测各组大鼠心肌线粒体中PINK1/Parkin通路蛋白表达量,在给药干预结束后处死各组中剩余的6只大鼠,采用断头法处死,迅速取大鼠心肌组织,液氮冰冻后研磨,研磨后加入蛋白缓冲液,进行常规蛋白提取,采取BCA法进行定量分析。50 μg的蛋白样品上样后SDS-PAGE电泳,通过蛋白电转到PVDF膜,使用5%的脱脂奶粉TBST进行避光封闭1 h,洗涤之后加入一抗稀释溶液(Bcl-2、Bax、Caspase-3、PINK1、PINK1、p62、LC3Ⅱ按照1∶1 000比例进行稀释),在4 ℃的环境中过夜保存,洗涤后加入二抗稀释溶液(Bcl-2、Bax、Caspase-3、PINK1、PINK1、p62、LC3Ⅱ按照1∶5 000比例进行稀释),在温床中孵育1h后再次洗涤,加入发光液ECL,曝光2~3次,取重叠值。使用软件分析蛋白条带灰度值。设置内参蛋白为GAPDH。
1.3 统计学处理

2 结果
2.1 病理组织学观察
图1为各组大鼠心肌组织病理变化观察图。空白组大鼠心肌纤维排列整齐,无炎性浸润的发生。模型组大鼠心肌细胞增大,心肌纤维排列较为紊乱,间隙肿胀、增宽,心肌纤维缺损。低剂量组、中剂量组、高剂量组大鼠心肌纤维排列稍微规整,间隙肿胀现象消失,可见有横纵纹,存在轻度的心肌纤维颗粒状变性,且存在缺损、断裂,细胞核呈现为圆形,但高剂量组大鼠心肌病理变化改善较为明显。

图1 各组大鼠病理组织学观察图(HE×200)
2.2 各组大鼠心肌酶水平比较
见表1。模型组、低剂量组、中剂量组、高剂量组大鼠血清中CK、LDH、AST均高于空白组,具有统计学差异(P<0.05);低剂量组、中剂量组、高剂量组大鼠血清中CK、LDH、AST均低于模型组,具有统计学差异(P<0.05);高剂量组大鼠血清中CK、LDH、AST均低于低剂量组、中剂量组,具有统计学差异(P<0.05)。
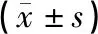
表1 各组大鼠心肌酶水平比较
2.3 各组大鼠心肌梗死面积、心肌细胞凋亡情况、心肌细胞自噬体数量比较
见表2、图2。模型组、低剂量组、中剂量组、高剂量组大鼠心肌梗死面积、心肌细胞凋亡指数、心肌细胞自噬体数量均高于空白组,具有统计学差异(P<0.05);低剂量组、中剂量组、高剂量组大鼠心肌梗死面积、心肌细胞凋亡指数、心肌细胞自噬体数量均低于模型组,具有统计学差异(P<0.05);高剂量组大鼠心肌梗死面积、心肌细胞凋亡指数、心肌细胞自噬体数量均低于低剂量组、中剂量组,具有统计学差异(P<0.05)。
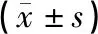
表2 各组大鼠心肌梗死面积、心肌细胞凋亡情况、心肌细胞自噬体数量比较

图2 各组大鼠心肌细胞凋亡情况比较(TUNEL×400)
2.4 各组大鼠心肌组织中Bcl-2、Bax、Caspase-3蛋白表达量比较
见表3。模型组、低剂量组、中剂量组、高剂量组大鼠心肌组织中Bcl-2表达量低于空白组,Bax、Caspase-3表达量高于空白组,具有统计学差异(P<0.05);低剂量组、中剂量组、高剂量组大鼠心肌组织中Bcl-2表达量高于模型组,Bax、Caspase-3表达量低于模型组,具有统计学差异(P<0.05);高剂量组大鼠心肌组织中Bcl-2表达量高于高于低剂量组、中剂量组,Bax、Caspase-3表达量低于低剂量组、中剂量组,具有统计学差异(P<0.05)。
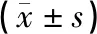
表3 各组大鼠心肌组织中Bcl-2、Bax、Caspase-3蛋白表达量比较
2.5 各组大鼠心肌线粒体PINK1/Parkin通路蛋白表达量比较
见表4。模型组、低剂量组、中剂量组、高剂量组大鼠心肌线粒体PINK1、Parkin、p62、LC3Ⅱ表达量均高于空白组,具有统计学差异(P<0.05);低剂量组、中剂量组、高剂量组大鼠心肌线粒体PINK1、Parkin、p62、LC3Ⅱ表达量均低于模型组,具有统计学差异(P<0.05);高剂量组大鼠心肌线粒体PINK1、Parkin、p62、LC3Ⅱ表达量均低于低剂量组、中剂量组,具有统计学差异(P<0.05)。
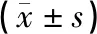
表4 各组大鼠心肌线粒体PINK1/Parkin通路蛋白表达量比较
3 讨论
自噬是生物体生长发育中起着关键的自救行为,当线粒体发生自噬现象后可特异性识别细胞内损伤的线粒体,并可选择性的将其清除,线粒体自噬在调控细胞内环境稳定、线粒体正常形态、功能等有着重要的作用[5]。有研究表明[6-7],当心肌缺血再灌注发生后,在缺血阶段心肌自噬水平显著增加,而处于再灌注阶段时自噬会被进一步的激活,虽然自噬能够对损伤的细胞器、蛋白进行选择性的吞噬清除来对细胞的正常结构和功能进行维持,但对于过度激活的自噬来说,此时的自噬会对细胞器进行过度的清除,进而加重心肌损伤程度。
缺血再灌注会引起心肌自噬体的异常增加,进而诱发自噬作用,将Caspase的级联反应激活引发一系列的线粒体变化,之后将凋亡诱导因子释放,最终促使心肌细胞发生凋亡[8-9]。Caspase家族属于内切蛋白家族,可对细胞凋亡、炎症起到调控作用,Caspase-3为Caspase家族中一个较为重要的因子,可反应出细胞凋亡情况,当其被活化后会对核酸内切酶、细胞骨架蛋白以及降解DNA修复酶起到激活作用,最终对细胞凋亡进行调控[10-11]。Bcl-2家族参与调控细胞凋亡,包括促凋亡、抑凋亡蛋白,促凋亡、抑凋亡蛋白之间的平衡可对细胞正常的凋亡进行维持,但当其失衡后则会双向调节细胞凋亡,Bcl-2可在一定程度上对线粒体中的促进凋亡蛋白起到抑制作用,进而阻止细胞内的细胞色素c对Caspase家族的激活作用[12-14]。本文结果显示,心肌缺血再灌注模型大鼠心肌组织中Bcl-2、Bax、Caspase-3蛋白表达量与空白组相比均呈现为异常的表达,但使用黄芪甲苷治疗的大鼠心肌组织中Bcl-2、Bax、Caspase-3蛋白异常表达状态得到改善,但运用高剂量的黄芪甲苷治疗的大鼠上述蛋白水平改善程度更为明显,此结果说明,黄芪甲苷可在一定程度上改善凋亡蛋白的异常表达,进而抑制心肌细胞凋亡,且呈现为剂量依赖。
PINK1/Parkin通路为介导线粒体自噬的经典通路之一,当线粒体形态、结构发生损伤后,线粒体膜电位会下降,进而引起线粒体外膜聚集较多的PINK1蛋白,进而对Parkin蛋白进行激活,将位于细胞胞浆中的Parkin蛋白转位至线粒体中,进而将p62召集至线粒体基质中,而当p62被召集至线粒体基质中后会和LC3相结合,介导线粒体自噬。LC3Ⅱ属于一种线粒体自噬特异性的信号蛋白,是由LC3Ⅰ和PE泛素样相结合形成的,可将自噬体数量反应出来[15-17]。当较为严重线粒体损伤发生时,会导致线粒体无法通过自噬维持细胞内稳态,进而引起自噬发生紊乱,在一定程度上对线粒体中的促凋亡的蛋白起到抑制作用,进而阻止细胞内的细胞色素c对Caspase家族的激活作用[18-19]。目前临床上已有研究[20]证实黄芪甲苷可调节心肌缺血再灌注大鼠线粒体自噬,但其研究并未明确其作用机制,本研究黄芪甲苷通过作用于PINK1/Parkin通路蛋白,调控通路蛋白以及凋亡蛋白的异常表达,进而抑制心肌细胞凋亡,改善线粒体自噬,证实黄芪甲苷可调节心肌缺血再灌注大鼠心肌细胞及线粒体自噬,进一步明确了其作用机制,为临床上黄芪甲苷的应用提供支持。
综上所述,黄芪甲苷通过作用于PINK1/Parkin通路,共同调控自噬蛋白和凋亡蛋白,进而起到调节心肌缺血再灌注大鼠线粒体自噬,抑制心肌细胞凋亡的作用,且呈剂量依赖。
