去甲氧基姜黄素通过PI3K-Akt-mTOR信号通路调控细胞自噬对心肌缺血再灌注损伤大鼠的保护作用研究
2020-10-10崔健昆耿乃志孟凡吉施丽春田耕杨桂青
崔健昆,耿乃志,孟凡吉,施丽春,田耕,杨桂青
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040; 2.哈尔滨医科大学,黑龙江 哈尔滨 150081;3.烟台中医医院,山东 烟台 264000)
心肌缺血再灌注损伤(Myocardial ischemic reperfusion in jury,MIRI) 指冠状动脉短暂阻塞后再通所造成心肌组织结构损伤加重的病理过程。其发病机制十分复杂,氧化应激、中性粒细胞浸润、钙超载和细胞凋亡等机制均与MIRI关系密切。细胞自噬作为一种内源性保护机制,在 MIRI的发生和进展过程中发挥着重要作用,成为新的治疗靶点[1-2]。mTOR属于PI3K蛋白激酶类家族中成员,是许多与自噬相关的信号通路交汇节点,而且与 MIRI有着密切的联系[3],其中PI3K-Akt-mTOR信号通路对自噬起重要的负调控作用。
去甲氧基姜黄素(Demethoxy Curcumin,DMC)是传统中药姜黄的主要活性成份,作为姜黄素的天然衍生物,二者具有相近的化学结构和相似的药理作用。姜黄素具有具有抗缺血、抗缺氧、清除氧自由基、抗脂质过氧化、抗细胞内Ca2+超载等多种药理作用[4],临床广泛用于心力衰竭、动脉粥样硬化、心律失常等疾病的治疗[5-7],但关于DMC对心血管疾病的作用和机制研究较少。本研究以大鼠心肌缺血再灌注模型为研究对象,以PI3K-Akt-mTOR 信号通路为切入点,探讨DMC通过调控细胞自噬减轻大鼠心肌缺血再灌注损伤的作用及可能机制,为DMC临床应用提供实验依据。
1 材料与方法
1.1 实验动物
清洁级SD大鼠,雄性,体质量(200±20)g,由黑龙江中医药大学实验动物中心提供,许可证号:SCXK(黑)2016004。大鼠在恒温恒湿、明暗交替的环境中适应性喂养5 d。
1.2 药品与主要试剂
去甲氧基姜黄素(DMC),TTC购自美国Sigma公司;CK-MB、LDH、MDA和SOD检测试剂盒,购自南京建成生物工程公司;IL-6、IL-1β、TNF-αELISA试剂盒购自武汉博士德生物公司;抗体GAPDH、LC3Ⅱ、LC3Ⅰ、Beclin1、p62、PI3K、Akt、p-PI3K、p-Akt、mTOR、p-mTOR均购自CST公司。RIPA裂解液、BCA试剂盒、BlueRanger预染蛋白质量标准购自美国 MBI公司。
1.3 主要仪器
BL-420F型生物信号采集系统,成都泰盟;DHX-300型小动物呼吸机,成都仪器厂;Multiscan MK3型酶标仪,美国Thermo公司;Olympus CX31正置显微镜,日本Olympus公司;2135型组织切片机,德国徕佧;164-5051型电泳仪及转膜仪,Gel Doc XR型凝胶成像系统,美国Bio-Rad公司。
1.4 分组给药和模型制备
SD大鼠经心电图筛选合格后,随机分为假手术组、模型组、DMC预处理10、15和30 mg/kg组,每组15只。将DMC用二甲亚砜(DMSO)溶解备用,再用生理盐水稀释至所需浓度,DMC预处理组大鼠腹腔注射给药,每日1次,连续7 d;假手术组和模型组给予等量生理盐水。末次给药后大鼠禁食不禁水12 h,腹腔注射戊巴比妥钠75 mg/kg麻醉后位固定,用标准Ⅱ导联监测大鼠心电图,并连接呼吸机。沿胸骨左缘钝性分离肌肉,剪断第4肋骨,暴露出心脏并打开心包,用无创缝合线在左冠状动脉前降支起始段下2~3 mm 处结扎。以心电图S-T段抬高 ≥0.1 mV 或T波高耸,心肌颜色变暗红色为结扎成功标志,心肌缺血30 min后,打开结扎线再灌注120 min。假手术组大鼠除不结扎外给予相同处理。
1.5 血清指标检测
再灌注120 min后静脉取血静置离心,取血清分装后置于-20 ℃冰箱中保存备用。按照试剂盒操作说明检测血清中CK-MB、LDH、MDA、SOD、IL-6、IL-1β和TNF-α水平。
1.6 TTC法检测大鼠心肌梗死面积
快速取出心脏放入4 ℃生理盐水清洗心腔内血液后,放入-20 ℃冰箱冷冻25 min。将心脏沿结扎线与房室沟平行方向横切成5 片,每片厚约2 mm,1% TTC溶液(pH7.4)中37 ℃染色15 min,吸干水分后的放入10%甲醛溶液中固定。正常心肌染为红色,梗死区心肌呈淡白色。拍照后用Image pro plus6.0图像分析软件计算心肌梗死面积,用缺血面积占左心室面积百分比来表示。
1.7 HE染色观察心肌组织病理变化
取心肌组织10%甲醛溶液中固定24 h,流水冲洗2 h,经脱水、透明、浸蜡后石蜡包埋。切片厚5 μm,常规HE染色,显微镜下观察心肌组织病理变化。
1.8 Western blot检测心肌组织蛋白表达
取缺血区周围的心肌组织称重后放入液氮中保存,采用Western blot法检测心肌组织中LC3Ⅱ、LC3Ⅰ、Beclin1、p62、PI3K、Akt、p-PI3K、p-Akt、mTOR、p-mTOR蛋白表达。取出冻存心肌组织加入适量的液氮充分研磨,用RIPA裂解液提取组织蛋白,BCA测定蛋白浓度,调整各组蛋白浓度,每孔上样30 μg。经 SDS-PAGE电泳分离、转膜、封闭后,加入一抗4 ℃孵育过夜,二抗37 ℃孵育1 h,采用ECL法显色,凝胶成像系统扫描并分析蛋白条带。
1.9 统计学分析
2 实验结果
2.1 DMC对MIRI大鼠血清中CK-MB、LDH、MDA和SOD的影响
与假手术组相比较,模型组大鼠血清中CK-MB、LDH和MDA水平显著升高(P<0.01),SOD活性显著降低(P<0.01);与模型组相比较,DMC预处理组大鼠血清中CK-MB、LDH和MDA水平随着给药浓度的增加而逐渐降低(P<0.01),SOD活性随着给药浓度的增加而逐渐升高(P<0.01),差异有统计学意义。如表1。
2.2 DMC对MIRI大鼠血清中炎症因子水平和心肌梗死面积的影响
与假手术组相比较,模型组大鼠血清中IL-6、IL-1β和TNF-α水平明显升高,大鼠心肌梗死面积显著增加(P<0.01);与模型组相比较,DMC预处理组大鼠血清中IL-6、IL-1β和TNF-α水平随着给药浓度的增加而逐渐降低,大鼠心肌梗死面积逐渐减少(P<0.01),差异有统计学意义。如表2。
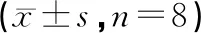
表1 DMC对MIRI大鼠血清中CK-MB、LDH、MDA和SOD水平的影响
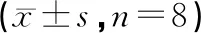
表2 DMC对MIRI大鼠血清中炎症因子水平和心肌梗死面积比率的影响
2.3 DMC对MIRI大鼠心肌组织病理变化的影响
光镜下可见,假手术组大鼠心肌纤维排列规整,胞质和胞核染色均匀,细胞间无充血和炎细胞浸润。I/R组大鼠心肌纤维结构紊乱、断裂,部分心肌细胞溶解、空泡变性,细胞间大量瘀血和炎细胞浸润。DMC预处理组大鼠心肌组织中上述病理改变随着给药浓度的增加在逐渐减轻。如图1。
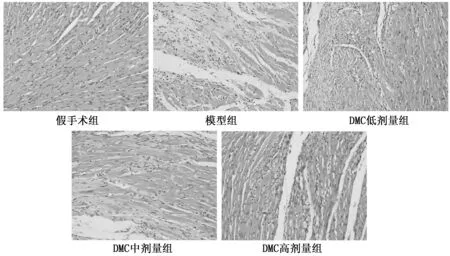
图1 DMC对MIRI大鼠心肌组织病理变化的影响(HE染色×200)
2.4 DMC对MIRI大鼠心肌组织中自噬相关蛋白表达的影响
如图2和表3所示,与假手术组比较,模型组LC3Ⅱ/LC3Ⅰ比值、Beclin1蛋白表达显著增高(P<0.01),p62蛋白表达水平显著降低(P<0.01),差异有统计学意义;与模型组相比较,DMC预处理组LC3Ⅱ/LC3Ⅰ比值、Beclin1蛋白表达降低(P<0.01),与DMC浓度变化呈负相关,p62蛋白表达水平增高(P<0.01),与DMC浓度变化呈正相关,差异有统计学意义。
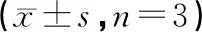
表3 DMC对MIRI大鼠心肌组织中自噬相关蛋白表达的影响
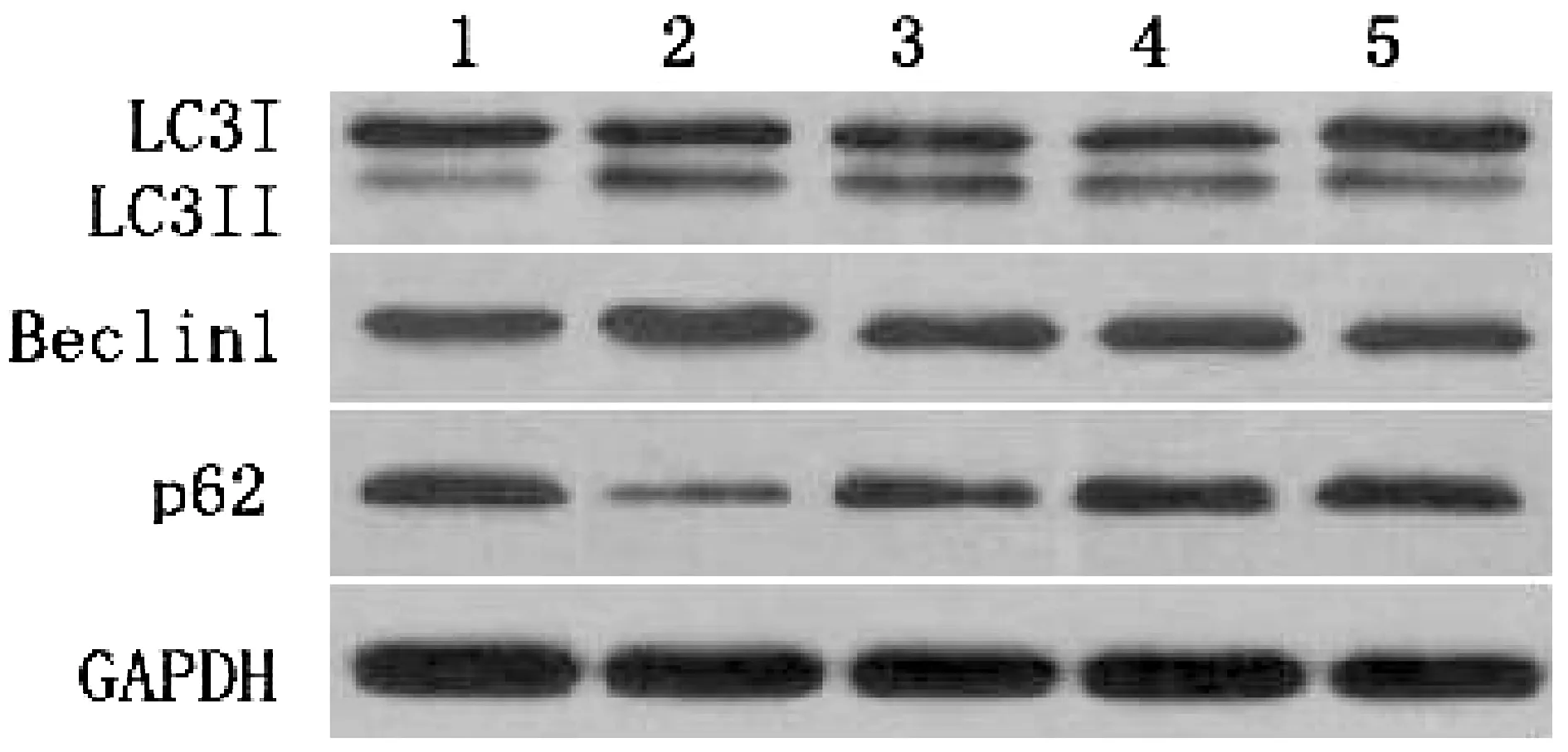
注:1.假手术组;2.1/R模型组;3.DMC低剂量组;4.DMC中剂量组;5.DMC高剂量组
2.5 DMC对MIRI大鼠心肌组织中PI3K-Akt-mTOR信号通路相关蛋白及其磷酸化的影响
如表4和图3所示,与假手术组比较,模型组p-PI3K蛋白表达和p-PI3K/PI3K比值显著降低(P<0.01),差异有统计学意义;与模型组比较,DMC(10、15、30 mg/kg)组的p-PI3K蛋白表达和p-PI3K/PI3K比值均显著升高(P<0.01),与 DMC浓度呈正相关,差异有统计学意义。而各组PI3K蛋白表达无统计学意义。
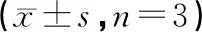
表4 DMC对MIRI大鼠心肌组织中p-PI3K、PI3K蛋白表达的影响
如表5和图3所示,与假手术组比较,模型组p-Akt蛋白表达和p-Akt/Akt比值显著降低(P<0.01),差异有统计学意义;与模型组比较,DMC(10、15、30 mg/kg)组的p-Akt蛋白表达和p-Akt/Akt比值均显著升高(P<0.01),与DMC浓度呈正相关,差异有统计学意义。而各组Akt蛋白表达无统计学意义。
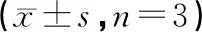
表5 DMC对MIRI大鼠心肌组织中p-AKT、AKT蛋白表达的影响
如表6和图3所示,与假手术组比较,模型组p-mTOR蛋白表达和p-mTOR/mTOR比值显著降低(P<0.01),差异有统计学意义;与模型组比较,DMC(10、15、30 mg/kg)组的p-mTOR蛋白表达和p-mTOR/mTOR比值均显著升高(P<0.01)差异有统计学意义。而各组mTOR蛋白表达无统计学意义。
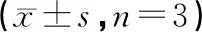
表6 DMC对MIRI大鼠心肌组织中p-mTOR、mTOR蛋白表达的影响

注:1.假手术组;2.1/R模型组;3.DMC低剂量组;4.DMC中剂量组;5.DMC高剂量组
3 讨论
自噬是细胞通过自噬体与溶酶体的结合,来降解自身受损的细胞器和蛋白质的过程,被称为Ⅱ型细胞程序性死亡。自噬是把双刃剑,生理状态下心肌细胞自噬的存在能够维持内环境稳态,缺血缺氧时期自噬的激活有利于细胞存活,在持续缺血缺氧或再灌注阶段,能诱导自噬表达过度增强,对细胞的存活产生不利影响[8-9]。机体对自噬过程的调节较为复杂,有多种信号分子及信号通路参与自噬的调控,其中PI3K-Akt通路是最为经典[10]。
CK和LDH水平变化可以反映出心肌受损伤的严重程度,是常用的心肌损伤标记物,通常存在于细胞质内,在心肌细胞受到时缺血缺氧等损伤时,二者就会由心肌细胞渗漏到血液中,使血清中CK、LDH水平显著升高[11]。为评价MIRI模型大鼠心肌的受损伤程度和DMC干预效果,本研究首先测定了血清中CK-MB、LDH水平,发现I/R模型大鼠血清中CK-MB、LDH水平显著升高,DMC能明显降低CK-MB和LDH水平,其效果呈现一定浓度依赖性,表明DMC预处理可以减轻缺血再灌注对大鼠心肌所造成的损伤。通过进一步检测心肌梗死面积和组织病理学变化 ,发现 DMC能显著减轻大鼠心肌梗死面积,改善组织病理学损伤。
在 MIRI发生发展的病理进程中,炎症级联反应和氧化应激是重要的起始和促进因素,参与了心肌损伤的全过程,其中活性氧(ROS)和炎症细胞因子对细胞自噬的调控有重要作用。在心肌缺血时期,低氧和ATP能量耗竭引起的细胞器损伤激活了心肌细胞自噬,而在再灌注时期,氧化应激所产生的大量ROS加重了细胞器损伤和脂质过氧化,使细胞自噬被过度激活[12]。MDA是氧化应激过程中脂质过氧化的重要产物,其水平高低反映了脂质过氧化程度,SOD 是体内清除ROS重要的抗氧化酶[13]。MIRI引起缺血区周围心肌组织炎性浸润,同时大量释放TNF-α、IL-6和IL-1β等炎症细胞因子,通过炎症级联反应进一步加重了心肌损伤[14]。本研究结果显示,DMC预处理能够显著提高MIRI大鼠血清中SOD活性,抑制MDA的生成,显著降低炎症细胞因子TNF-α、IL-6和IL-1β的水平,且效果呈浓度依赖性变化。表明DMC能够通过抑制MIRI大鼠心肌氧化应激水平,阻断炎症级反应进程,从而起到心肌保护的作用。
LC3、Beclin1、p62蛋白是细胞自噬的重要组成部分,通常作为自噬水平的检测指标。Beclin1通过与PI3KCⅢ和Atg14结合形成三聚体,使自噬相关蛋白聚集并启动自噬。LC3 是典型的自噬标志物,对自噬泡的形成起到关键作用,分为LC3A、LC3B 和 LC3C三种同工型,其中LC3B 分为LC3-Ⅰ型和LC3-Ⅱ型。LC3-Ⅰ型存在于细胞质中,游离的LC3-Ⅰ型能够通过泛素化修饰方式转变为LC3-Ⅱ型,并转移到自噬体膜上,LC3-Ⅱ数量与自噬体数量成正比[15],通过LC3-Ⅱ/LC3-Ⅰ的比值大小可评价判断自噬活性的强弱。p62 能够和待降解物结合,然后再与LC3Ⅱ形成复合物,最后在溶酶体内被降解,p62会随着自噬作用的增加而不断地被消耗[16-17]。为了进一步探讨DMC对MIRI时自噬的调控作用,本实验采用WB法检测心肌组织中自噬相关蛋白LC3、Beclin1和p62 表达。结果显示DMC预处理能显著降低了MIRI大鼠心肌组织中LC3Ⅱ/LC3Ⅰ比率和 Beclin1 蛋白表达,提高p62的蛋白表达,且效果呈浓度依赖性变化。提示自噬参与了MIRI病理进程,表明DMC对心肌细胞过度自噬的激活有明显的抑制作用。Akt属于一种丝氨酸/苏氨酸蛋白激酶,是调控mTOR最重要的直接上游分子,PI3K-Akt信号通路激活以后导致Akt活化产生相应的生理效应,细胞内Akt蛋白的磷酸化水平反映了PI3K-Akt信号通路的被激活的程度[18]。mTOR是PI3K/Akt通路下游最关键的自噬负调控因子,其活性随着MIRI所诱导的自噬情况不同而不断发生动态变化[19]。在MIRI初期mTOR被抑制,心肌细胞自噬不断增强,在后期为防止自噬过多,mTOR 被激活,抑制自噬直至终止自噬[20]。持续性心肌缺血缺氧和再灌注导致的氧化应激损伤和炎症级联反应等病理产物,抑制了mTOR蛋白表达及其磷酸化,ULK1复合体被激活并诱导自噬泡膜形成 ,使mTOR对自噬的抑制作用减弱,自噬活性过度增强[21]。本实验结果表明,DMC预处理可增加I/R模型大鼠受损心肌细胞中PI3K、Akt和mTOR蛋白的磷酸化水平,从而激活PI3K-Akt-mTOR信号通路。表明DMC对MIRI大鼠心肌细胞自噬作用的抑制主要是通过激活自噬上游的PI3K-Akt-mTOR信号通路实现的。
综上所述,DMC预处理可能通过PI3K-Akt-mTOR信号通路,抑制细胞自噬的过度激活,从而抑制氧化应激水平,阻断炎症级联反应进程,减少心肌细胞凋亡,对心肌缺血再灌注损伤具有较好保护作用。
