家蚕丝氨酸蛋白酶抑制剂Bmserpin2对酚氧化酶原激活和抗菌肽基因表达的抑制作用
2020-10-10陶姗姗夏家凤叶崇军
李 冰,孙 帆,陶姗姗,夏家凤,叶崇军,*
(1.农业部蚕桑遗传改良重点实验室,江苏镇江 212018;2.安徽省农业科学院蚕桑研究所,合肥 230061)
丝氨酸蛋白酶级联反应被丝氨酸蛋白酶抑制剂(serine protease inhibitor,serpin)精确调控(Kanost,1999;Gubbetal.,2010)。Serpin家族几乎存在于所有的生物中,拥有多种初级结构形态,且具有保守的结构域,是一种普遍存在的具有亲核丝氨酸残基催化位点的酶。该家族的大多数成员的蛋白质由400~500个氨基酸组成,包含一个连接β折叠结构域A和C的C末端暴露的反应中心环(reactive center loop,RCL)。对serpin家族部分成员参与丝氨酸蛋白酶级联反应的精细调控已有许多研究,显示这些家族成员参与调控的靶点和机制不尽相同,但它们的作用方式主要是通过蛋白互作和限制性蛋白水解实现对靶标蛋白的调节功能(Jiangetal.,2005;Tripathi and Sowdhamini,2008)。
Serpin基因在黑腹果蝇Drosophilamelanogaster(Reichhart,2005)、冈比亚按蚊Anophelesgambiae(Suwanchaichinda and Kanost,2009)、家蚕Bombyxmori(Zouetal.,2009)和棉铃虫Helicoverpaarmigera(Xiongetal.,2015)等昆虫中相继被鉴定。在家蚕中,34个serpin基因目前已经注释鉴定了,并检测了它们在微生物刺激下的表达模式(Zouetal.,2009)。近期研究表明家蚕serpin15能够被球孢白僵菌Beauveriabassiana和藤黄微球菌Micrococcusluteus诱导,负调控酚氧化酶原(prophenol oxidase,PPO)反应和TOLL通路(Liuetal.,2015)。Serpin5通过靶向细胞中的BmHP6和BmSP21下调TOLL和PPO通路(Lietal.,2016)。家蚕Bmserpin6蛋白可能在家蚕的酚氧化酶原激活以及抗菌肽表达过程中发挥负调节作用(李冰等,2016),可能参与蛋白酶介导的家蚕先天免疫方面的调控(Lietal.,2017)。查宏贤等(2011)克隆了家蚕serpin4基因并进行了原核表达和抗体制备。家蚕Bmserpin2在1993年通过克隆表达鉴定,证实是一类抗凝胰乳蛋白酶(Narumietal.,1993),并且在血淋巴和丝腺中基因转录表达量较高(Yonemuraetal.,2012)。但是目前对其生物学功能,特别是参与昆虫天然免疫方面的功能尚不明确。本研究通过原核表达系统得到纯化的重组Bmserpin2蛋白,并通过家蚕体内实验,结合RT-qPCR和酶活性测定等生物学方法,分析Bmserpin2的催化作用以及在家蚕自身免疫通路中的调控作用。
1 材料与方法
1.1 材料与主要试剂
实验中家蚕品种为大造,保存于安徽省农业科学院蚕桑研究所家蚕品种资源库,幼虫期在25±1℃温度下用新鲜桑叶饲养。实验中脂肪体、血淋巴、头等组织取自家蚕5龄第3天幼虫,收集后立即在液氮中快速冷冻,保存于-80℃备用。
革兰氏阳性菌滕黄微球菌购自Sigma公司,Trizol购自Invitrogen公司,胰蛋白酶(trypsin)、胰凝乳蛋白酶(chymotrypsin)、弹性蛋白酶(elastase)、蛋白酶K(protease K)购自上海生工生物工程技术服务有限公司,分子克隆中所用的试剂、cDNA合成试剂盒、荧光定量试剂盒等购自TaKaRa公司,GST Fusion Protein Spin Purification Kit购自金斯瑞公司。
1.2 家蚕组织的总RNA 抽提及 cDNA 合成
取家蚕5龄第3天幼虫(10头)在冰上进行解剖,收集脂肪体、血淋巴、头、中肠、丝腺和表皮组织提取RNA,加入1 mL Trizol,混匀后加入200 mL氯仿,混匀后冰上静置5 min,4℃ 12 000 r/min离心15 min;取上清液500 μL,加入500 μL异丙醇,充分混匀后冰上放置10 min,4℃ 12 000 r/min离心15 min;移出上清,用DEPC水配制的75%乙醇洗涤沉淀3次,通风厨内晾干后用适量DEPC水溶解沉淀,并用紫外分光光度计测定A260/A280来确定纯度和浓度,-80℃下保存备用。
使用TaKaRa公司First Strand cDNA Synthesis Kit试剂盒进行 cDNA第1链的合成,反应体系:5×RT Buffer 1 μL,dNTPs 2 μL,RNase Inhibitor 1 μL,Oligo dT Primer 2 μL,Rever-Tra Ace 1 μL,总RNA 1 μg,加DEPC水至总体积为20 μL。PCR反应程序:37℃ 15 min,85℃ 5 s,4℃ 保存。以cDNA为模板扩增内参引物BmActinA3,检测合成cDNA质量,余下的置于-20℃保存。
1.3 Bmserpin2基因克隆
根据从NCBI数据库家蚕Bmserpin2基因序列(GenBank登录号:XM_012692302.2),采用Premier 5.0 软件设计引物,上海生工生物工程技术服务有限公司合成(表1)。以家蚕血淋巴组织cDNA为模板进行目的基因的PCR扩增克隆。PCR反应体系(10 μL):2×All-in-One PCR Mix 5 μL,正反向引物(0.2 μmol/L)各1 μL,cDNA 1 μL,H2O 2 μL。PCR扩增程序:95℃ 5 min;95℃ 30 s,55℃ 30 s,72℃ 90 s,重复35个循环;最后72℃ 10 min,4℃保存。通过琼脂糖凝胶电泳进行胶分离回收,回收产物连接 pMD18-T载体,阳性克隆送生工生物工程(上海)股份上海生工生物工程技术服务有限公司测序。

表1 实验所用引物Table 1 Primers used in the experiment
下划线序列分别为NdeⅠ和XhoⅠ酶切位点。The underlined sequences are the restriction sites ofNdeⅠ andXhoⅠ,respectively.
1.4 重组蛋白Bmserpin2诱导表达
测序正确后,用NdeⅠ和NotⅠ对1.3节构建的pMD18-T-serpin2进行双酶切,将产物连接到pET-28a(+)中,筛选阳性克隆并通过测序进行鉴定。将重组质粒转入BL21感受态细胞进行培养,挑选阳性克隆在卡那霉素的LB液态培养基中37℃震荡培养12 h;取上述菌液以体积1∶100加入到含卡那霉素的LB培养基中,37℃震荡培养至菌液OD600≈1;加入IPTG至终浓度为1 mmol/L,继续培养6 h后使用12% SDS-PAGE检测重组蛋白表达情况。
1.5 重组蛋白Bmserpin2纯化及Western blot鉴定
目的蛋白大量诱导后收集菌液,4℃条件下5 000 r /min离心15 min,去除上清,用浓度为10 mmol/L、pH为7.4的Tris溶液清洗细胞。4℃条件下5 000 r /min离心15 min,弃上清;以每100 mL诱导后菌液加入4 mL浓度为10 mmol/L Tris的比例重悬,冰上静置30 min;将重悬的沉淀置于冰上超声破碎,然后4℃ 12 000 r/min离心10 min,取上清。按照 GE 公司 GST Fusion Protein Spin Purification Kit 说明书,镍柱亲和结合30 min;10 mmol/L咪唑洗杂蛋白,以100,200,300,400和500 mmol/L浓度的咪唑洗脱目的蛋白。
取纯化后的蛋白质样品进行12% SDS-PAGE检测。40 mA恒流下转膜80 min,用含5%脱脂奶粉的TBST缓冲液封闭1 h。加入一抗(Anti-6×His rabbit polyclonal an-tibody)孵育1 h,加入二抗孵育1 h,其中压片显色用二抗为羊抗兔 IgG-HRP,膜上直接显色二抗为羊抗兔IgG-AP,进行Western blot鉴定。
1.6 重组蛋白Bmserpin2生物学活性测定
为探讨Bmserpin2蛋白的生物学功能,将1.5节纯化定量后的Bmserpin2蛋白分别与胰蛋白酶、胰凝乳蛋白酶、弹性蛋白酶、蛋白酶K进行孵育,以检测Bmserpin2对不同种类蛋白酶的抑制效果,从而确定其生物学活性。
分别取不同蛋白酶各1 μg,不做任何处理,作为对照组;实验组分别按照Bmserpin2蛋白与蛋白酶质量比1∶1和1∶2加入Bmserpin2蛋白,用PBS缓冲液将混合后体积定量至15 μL,冰上孵育10 min,加入浓度为5 mg/mL 的Azocasein的底物185 μL。上述混合液37℃水浴处理20 min后加入TCA 60 μL终止反应;然后10 000 r/min离心3 min,吸取上清200 μL加入等体积浓度为1 mmol/mL的 NaOH显色10 min,分光光度计检测OD436值。
1.7 Bmserpin2基因在家蚕幼虫不同组织中分布情况测定
分别抽提家蚕5龄第3天幼虫的头、中肠、脂肪体、血淋巴、丝腺和表皮组织RNA并合成cDNA,利用RT-qPCR检测Bmserpin2在上述组织中的表达分布情况,以BmActinA3为内参基因。RT-qPCR引物序列见表1,根据荧光定量试剂盒的说明书操作,使用Bio-Rad公司生产的荧光定量PCR仪进行反应:95℃变性30 s;95℃ 50 s,60℃ 30 s,40个循环。每一样品进行3次独立的生物学重复,每个生物学重复来自10头个体。
1.8 重组蛋白 Bmserpin2对家蚕幼虫血淋巴中酚氧化酶原活性的影响
将家蚕5龄第3天幼虫冰上放置20 min后,注射纯化的Bmserpin2蛋白1.5 g,设置不做任何处理和注射等量PBS缓冲液的家蚕5龄第3天幼虫分别作空白和阴性对照组。注射6 h后,每组取5头幼虫取5 mL血淋巴,加入45 mL PBS缓冲液进行稀释,取10 mL稀释的血淋巴加入浓度为10 mmol/mL的多巴胺溶液200 mL,室温下测定OD490值,参考Amparyup等(2009)及Sumathipala和Jiang (2010)的方法测定酚氧化酶原的酶活性,每组进行3次独立重复实验。进一步进行Western blot分析,方法同1.5节。
1.9 重组蛋白Bmserpin2对家蚕幼虫血淋巴中抗菌肽基因表达的影响
已有文献报道家蚕中serpin蛋白与TOLL通路调控相关(Levashinaetal.,1999;Fullaondoetal.,2011),并且抗菌肽基因gloverin2(GenBank登录号:692527)和moricin(GenBank登录号:692365)常用于研究外源刺激下家蚕自身免疫免疫(Li Jetal.,2016;Li Betal.,2017)。为研究Bmserpin2是否也存在同样的生物学功能,以未做任何处理的家蚕作为空白对照,以注射革兰氏阳性菌滕黄微球菌的家蚕作为阳性对照,以注射滕黄微球菌和重组蛋白Bmserpin2混合物作为实验组进行研究,用RT-qPCR的方法检测Bmserpin2对家蚕血淋巴中抗菌肽基因gloverin2和moricin表达的影响。
将家蚕5 龄第3天幼虫冰上放置20 min后,设3组实验:不做任何处理的空白对照组;注射滕黄微球菌20 μL(0.1 μg/μL)和重组蛋白10 μg混合物的实验组;注射滕黄微球菌20 μL(0.1 μg/μL)和PBS的阳性对照组。注射1 h后取血淋巴,参照1.2节方法制备cDNA模板用于RT-qPCR,以BmActinA3为内参基因。反应体系(10 μL):cDNA 1 μL,SYBR Premix Ex TaqTMⅡ 5 μL,上下游引物(10 μmol/L)各0.5 μL,超纯水3 μL,混匀,离心,放入荧光定量PCR仪中进行扩增。反应条件:95℃预变性30 s;95℃变性50 s,60℃退火30 s,72℃延伸10 s,共 40个循环。
1.10 数据分析
使用EXCEL整理实验数据,荧光定量结果采用2-ΔΔCt法进行数据处理。采用SPSS 20.0 进行方差分析,采用Duncan氏多重比较检验法和T检验进行比较,分析目的基因的表达量及不同实验组数据之间差异显著性,其中P<0.05表示样本间存在显著差异,P<0.01表示样本间存在极显著差异。
2 结果
2.1 重组蛋白Bmserpin2的表达纯化
通过大肠杆菌原核表达系统对目的蛋白进行体外表达,并通过镍柱进行亲和纯化得到目的蛋白Bmserpin2。通过不同浓度的咪唑洗脱目的蛋白发现,100~300 mmol/L咪唑即可将大部分目的蛋白洗脱(图1:A)。根据Bmserpin2基因克隆测序结果,软件(http:∥www.bioinformatics.org/sms/prot_mw.html)预测目的蛋白Bmserpin2大小为42.76 kD。根据考马斯亮蓝染色和Western blot的结果分析,纯化后蛋白为6×His融合蛋白,约为45 kD(图1:B)。
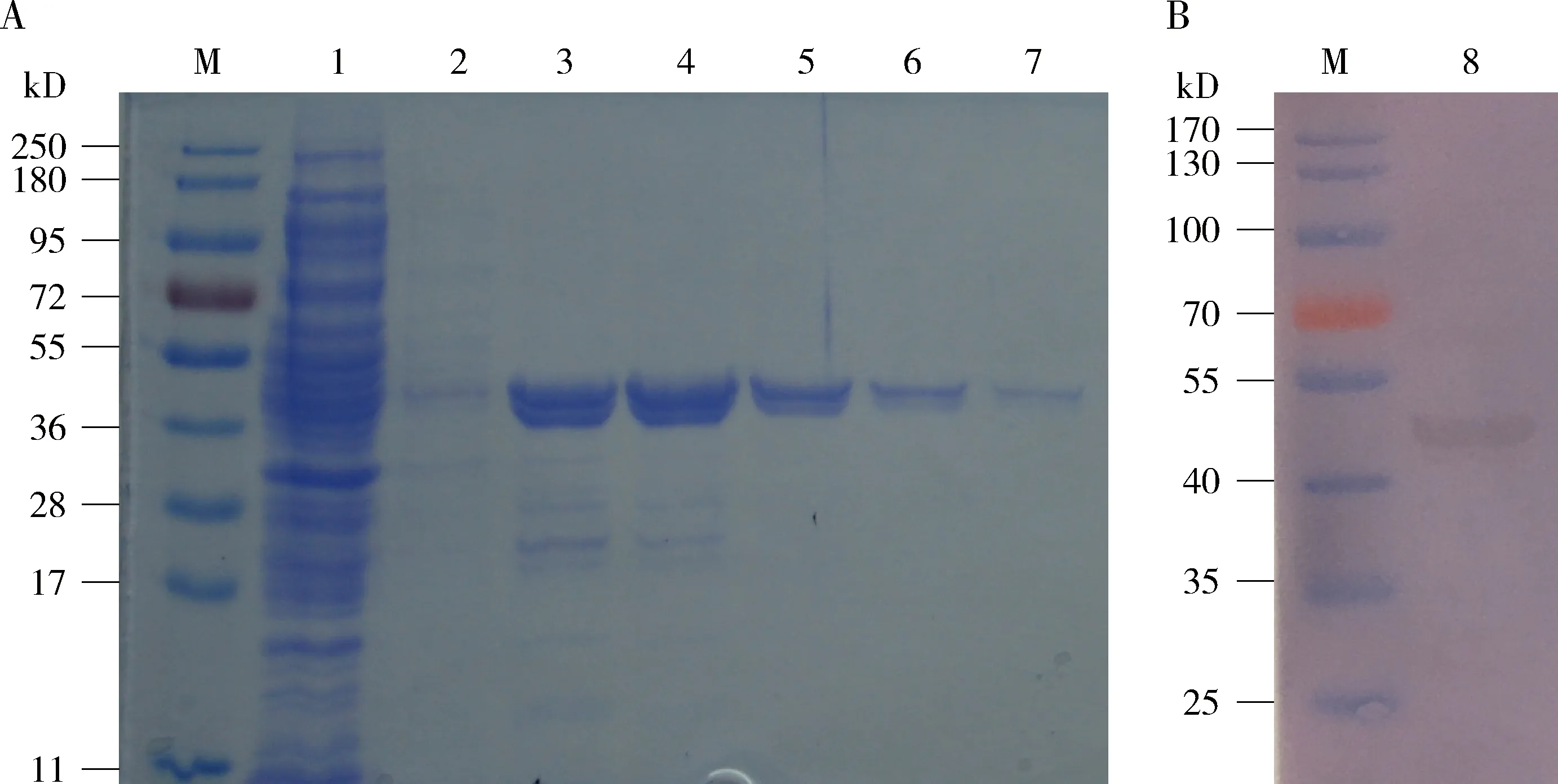
图1 原核表达与纯化重组蛋白Bmserpin2的SDS-PAGE检测(A)及Western blot分析(B)Fig.1 SDS-PAGE (A) and Western blot assay (B) of the recombinant Bmserpin2 after prokaryotic expression and purificationM:蛋白质分子量标准Protein molecular weight marker;1:经 IPTG 诱导的 BL21 菌裂解液BL21 bacteria lysate induced by IPTG;2:洗涤液Washing solution;3-7:分别为100,200,300,400和500 mmol/L 咪唑洗脱的Bmserpin2蛋白的蛋白质溶液Protein solution of Bmserpin2 eluted by 100,200,300,400,and 500 mmol/L imidazole,respectively;8:目的蛋白的His抗体检测Detection of His antibody to the target protein.
2.2 重组蛋白BmSerpin2对不同蛋白酶的生物学活性
结果显示Bmserpin2蛋白对于消化酶胰蛋白酶(图2:A)和弹性蛋白酶(图2:C)有极显著的抑制效果(P<0.01),而对胰凝乳蛋白酶(图2:B)和蛋白酶K(图2:D)影响效果不显著,表明Bmserpin2蛋白对不同蛋白酶具有生物学活性并且表现出催化特异性。
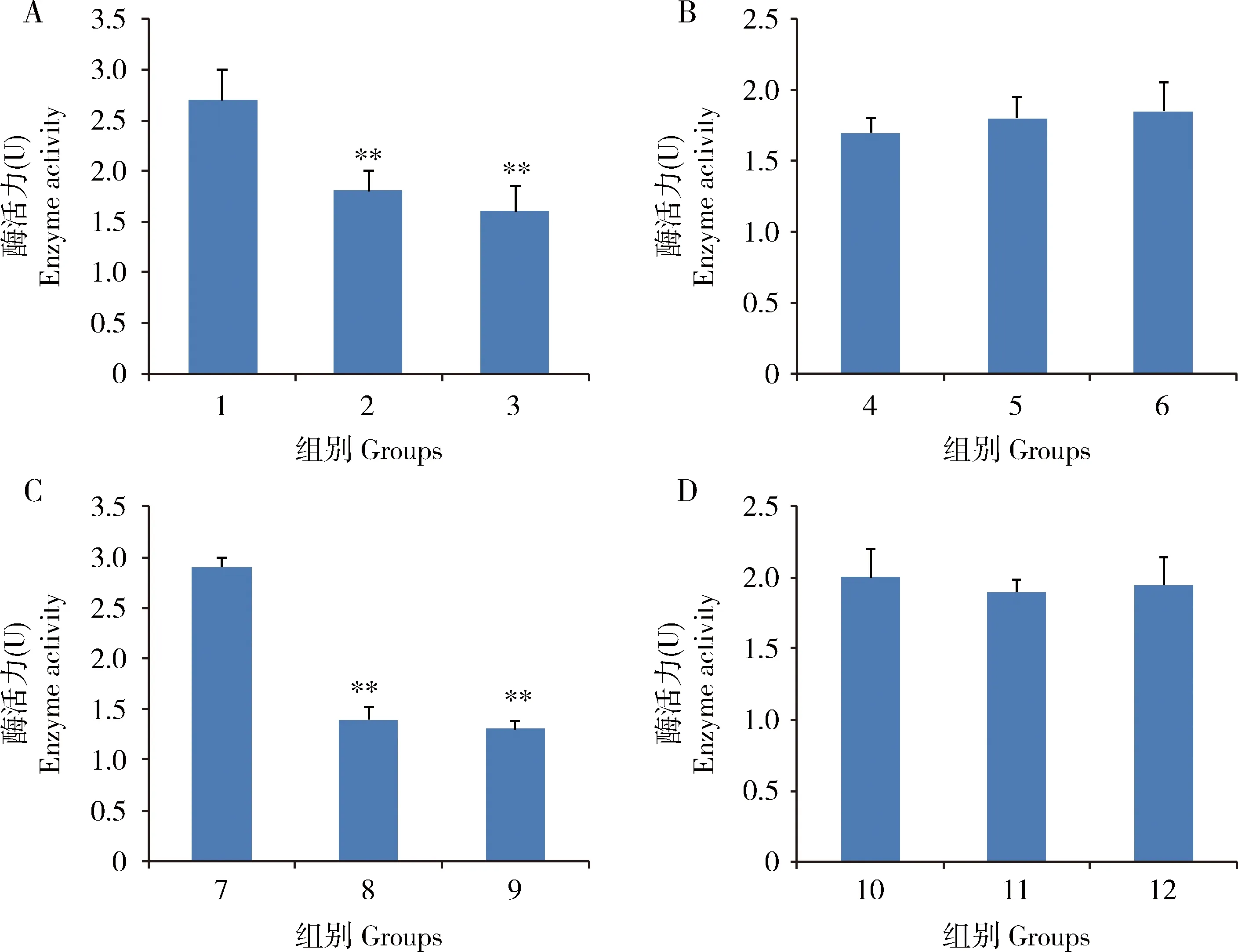
图2 家蚕重组蛋白Bmserpin2对胰蛋白酶(A)、胰凝乳蛋白酶(B)、弹性蛋白酶(C)和蛋白酶K(D)活性的影响Fig.2 Effects of the recombinant Bmserpin2 of Bombyx mori on the activities of trypsin (A),chymotrypsin (B), elastase (C) and proteinase K (D)1,4,7,10:分别为未加Bmserpin2的胰蛋白酶、胰凝乳蛋白酶、弹性蛋白酶、蛋白酶K对照组Control groups of trypsin,chymotrypsin,elastase and proteinase K,respectively,with no Bmserpin2 added;2,5,8,11:分别为Bmserpin2与胰蛋白酶、胰凝乳蛋白酶、弹性蛋白酶和蛋白酶K以1∶1质量比加入的处理组 Treatment groups with Bmserpin2 and trypsin,chymotrypsin,elastase and proteinase K added in 1∶1 mass ratio,respectively;3,6,9,12:分别为Bmserpin2与胰蛋白酶、胰凝乳蛋白酶、弹性蛋白酶和蛋白酶K以1∶2质量比加入的处理组Treatment groups with Bmserpin2 and trypsin,chymotrypsin,elastase and proteinase K added in 1∶2 mass ratio,respectively.图中数据为平均值±标准差;柱上双星号表示OD436值在处理组与对照组间差异极显著(P<0.01,T检验)。Data in the figure are mean±SD,and double asterisk above bars indicates extremely significant difference in OD436value between the treatment group and the control group (P<0.01,T-test).
2.3 Bmserpin2基因在家蚕幼虫不同组织中的表达
结果如图3所示,Bmserpin2在家蚕血淋巴中表达量最高(P<0.05),其次是在脂肪体中,均达到头部中表达量的20倍左右,而中肠和丝腺组织中表达量也达到头部中表达量的5倍左右,表皮中的表达量最低。
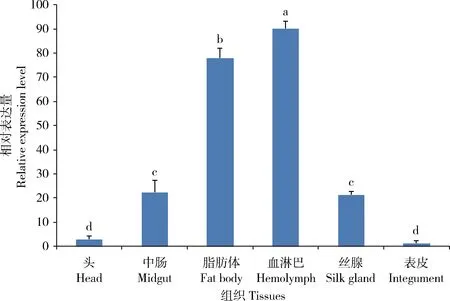
图3 RT-qPCR检测Bmserpin2在家蚕5龄幼虫不同组织中的相对表达量Fig.3 Relative expression levels of Bmserpin2 in different tissues of the 5th instar larvae of Bombyx mori detected by RT-qPCR图中数据为平均值±标准误;柱上不同小写字母表示不同组织间基因相对表达量差异显著(P<0.05,Duncan氏多重比较检验法)。Data in the figure are mean±SE.Different lowercase letters above bars indicate significant differences in the relative expression level of gene among different tissues (P<0.05,Duncan’s multiple range test).
2.4 重组蛋白Bmserpin2对家蚕幼虫血淋巴中酚氧化酶原活性的影响
图4(A)中的结果表明,家蚕5龄幼虫血淋巴中PPO活性在注射重组Bmserpin2蛋白后,较未做任何处理的空白对照组和注射PBS的阴性对照组的显著性降低(P<0.05),为空白对照组的1/4左右,而空白对照组和阴性对照组间差异不显著(P>0.05)。观察不同处理组血淋巴颜色发现,实验组血淋巴黑化程度明显较对照组低 (图4:C)。进一步通过Western blot分析,结果如图4(B)所示,推测Bmserpin2蛋白在家蚕血清中并未与血清中的丝氨酸蛋白酶形成稳定复合物。

图4 重组蛋白Bmserpin2对家蚕5龄幼虫血淋巴中酚氧化酶原活性的影响Fig.4 Effect of the recombinant Bmserpin2 on prophenol oxidase activity in the haemolymph of the 5th instar larvae of Bombyx moriA:酶活性检测Determination of enzymatic activity;B:血淋巴中蛋白的Western blot分析Western blot assay for protein in the hemolymph;C:血淋巴黑化观察Observation of hemolymph melanization.1:不做任何处理的空白对照组Blank control group without any treatment;2:注射等量PBS缓冲液的阴性对照组Negative control group injected with an equal quantity of PBS buffer;3:注射1.5 g纯化的Bmserpin2 蛋白的处理组Treatment group injected with 1.5 g of purified Bmserpin2 protein;M:蛋白质分子量标准Protein molecular weight marker.图中数据为平均值±标准误;柱上不同小写字母表示不同处理组间差异显著(P<0.05,Duncan氏多重比较检验法)。Data in the figure are mean±SE.Different lowercase letters above bars indicate significant differences among different treatment groups (P<0.05,Duncan’s multiple range test).
2.5 重组蛋白Bmserpin2对家蚕幼虫血淋巴中抗菌肽基因表达的影响
结果如图5所示,注射滕黄微球菌和PBS的阳性对照组较空白对照组抗菌肽基因gloverin2和moricin表达上调,而注射滕黄微球菌和Bmserpin2混合物的实验组中gloverin2(图5:A)和moricin(图5:B)的mRNA水平显著性下调(P<0.05)。这一结果表明,Bmserpin2可能抑制了微球菌对抗菌肽的上调作用。
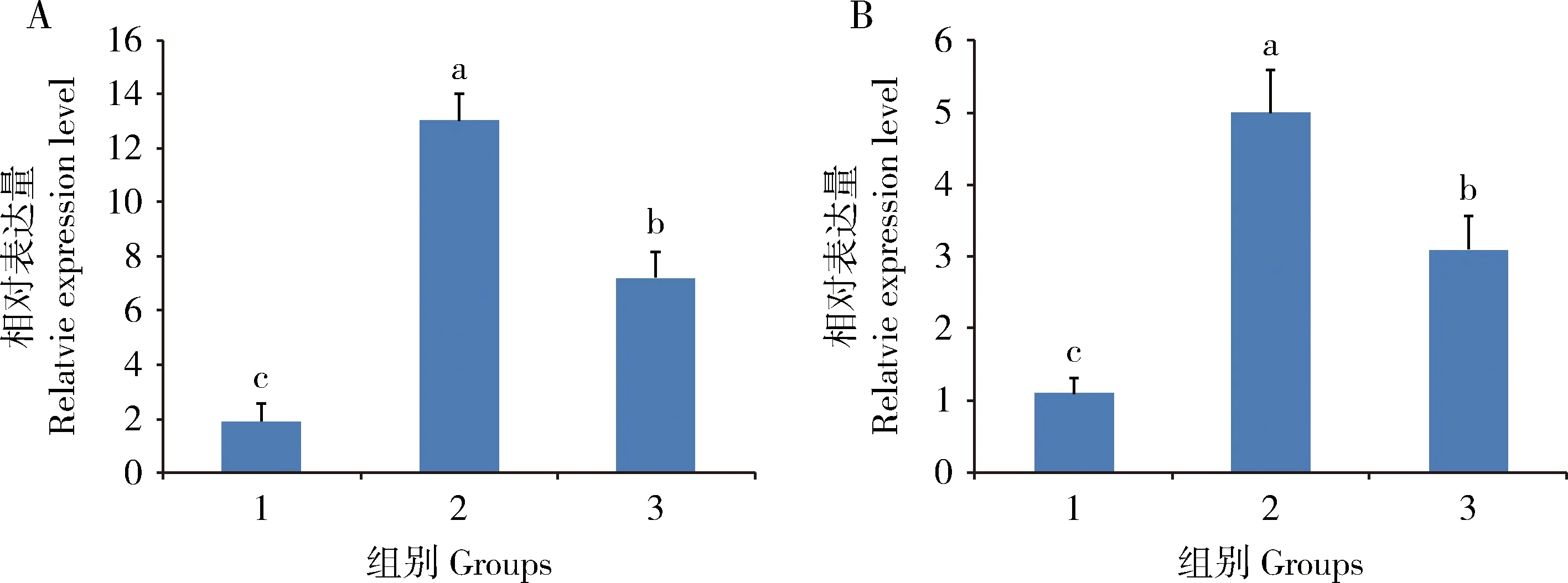
图5 RT-qPCR 检测Bmserpin2蛋白对家蚕5龄幼虫血淋巴中抗菌肽基因gloverin2(A)和moricin(B)表达的影响Fig.5 Effect of the recombinant Bmserpin2 on the expression of antimicrobial peptide genes gloverin2 (A) and moricin (B) in the hemocytes of the 5th larvae of Bombyx mori detected by RT-qPCR1:不做任何处理的空白对照组Blank control group without any treatment;2:注射藤黄微球菌和PBS的阳性对照组Positive control group injected with Micrococcus luteus and PBS;3:注射藤黄微球菌和Bmserpin2蛋白的实验组Experimental group injected with M.luteus and Bmserpin2 protein.图中数据为平均值±标准误;柱上不同小写字母表示不同处理组间差异显著(P<0.05,Duncan氏多重比较检验法)。Data in the figure are mean±SE.Different lowercase letters above bars indicate significant differences among different treatment groups (P<0.05,Duncan’s multiple range test).
3 讨论
昆虫已经进化出有效的先天免疫系统来抵御病原体和寄生虫的入侵(Lemaitre and Hoffmann,2007)。抗菌肽的产生和黑化反应是体液免疫的两个关键反应,在黑腹果蝇中,当入侵的细菌或真菌被识别为非自身成分时,AMPs的mRNA通过TOLL或免疫缺陷(immune deficiency,IMD)途径开始转录进行翻译反应。特别是,IMD通路是由革兰氏阴性菌的识别激活的,而TOLL通路是由革兰氏阳性菌和真菌的识别激活 (Imler,2014)。与NK-kB因子介导的途径不同,黑化反应是无脊椎动物另一种由酚氧化酶(phenoloxidase,PO)催化的普遍的防御机制,该酶由PPO蛋白水解转化后的活性构象 (Jiangetal.,1998)。
本实验通过Bmserpin2组织表达量特异性分析显示目的基因在血淋巴和脂肪体中表达量最高(图3),而血淋巴和脂肪体是家蚕先天性免疫中的两个重要组织,暗示Bmserpin2与家蚕的先天性免疫相关。进一步实验通过将体外表达的重组Bmserpin2注射进家蚕幼虫后,检测血淋巴中的酚氧化酶原活性以及观察血淋巴黑化,结果显示Bmserpin2可以有效抑制PPO活性和血淋巴黑化(图4)。有报道显示在果蝇中,Serpin27A(CG11331)、Serpin28D(CG7219)和Serpin77Ba(CG6680)负调控PPO级联反应(De Gregorioetal.,2002;Ligoxygakisetal.,2003;Tangetal.,2008),本实验结果与其他物种中serpin类似,推测家蚕Bmserpin2蛋白可以通过抑制PPO活性从而调控家蚕先天性免疫防御。同时有文献报道serpin与其对应的特异性的丝氨酸蛋白酶形成复合体,并且复合体是以共价键紧密结合(Boneetal.,1987),但是本研究中未检测Bmserpin2与其他蛋白的结合物,推测Bmserpin2蛋白对于酚氧化酶原的抑制作用是非特异性结合。
进一步实验通过家蚕外源微生物诱导AMPs,并注射重组Bmserpin2蛋白检测相关AMPs基因表达量,结果显示微球菌和Bmserpin2混合注射组中抗菌肽靶基因的转录表达被显著下调(图5)。在果蝇中,Spn43Ac (necrotic,CG1857)和Spn1 (Spn42Dd,CG9456) 负调控TOLL信号通路(Levashinaetal.,1999;Fullaondoetal.,2011),而TOLL通路是由革兰氏阳性菌和真菌的识别激活 (Imler,2014),推测Bmserpin2蛋白是通过抑制抗菌肽基因的表达,从而调控家蚕自身免疫的TOLL通路。TOLL 通路中存在丝氨酸蛋白酶的参与,因此推测Bmserpin2 也可能是通过抑制其通路中某些丝氨酸蛋白酶的活性从而抑制抗菌肽表达的产生。
研究发现,PPO的激活和TOLL通路和是由细胞外剪切域丝氨酸蛋白酶级联介导的 (Kambrisetal.,2006;Anetal.,2009)。在烟草天蛾Manducasexta中,serpin1,serpin3,serpin4,serpin5,serpin6和serpin7也被证实调控PPO活性和TOLL通路 (Zhuetal.,2003;Tong and Kanost,2005;Zou and Jiang,2005;An and Kanost,2010;Anetal.,2011;Suwanchaichindaetal.,2013)。在鞘翅目黄粉虫的幼虫同样也被证实一些serpin负调控PPO和TOLL通路(Jiangetal.,2009,2011)。
综上,本研究表明Bmserpin2可能参与家蚕酚氧化酶原激活和TOLL途径的胞外级联反应的免疫通路,并且使抗菌肽靶基因的转录表达下调。Bmserpin2蛋白对由革兰氏阳性菌和真菌的识别激活的TOLL免疫通路以及调控抗菌肽的作用机理还需进一步研究。
