沙葱萤叶甲表皮蛋白基因的鉴定及表达谱分析
2020-10-10段天凤马红悦庞保平单艳敏张卓然
段天凤,李 玲,马红悦,庞保平,*,单艳敏,张卓然
(1.内蒙古农业大学草原昆虫研究中心,呼和浩特 010020;2.内蒙古自治区草原工作站,呼和浩特 010020)
昆虫表皮具有保护内脏、防止水分蒸发、抵御外部有毒物质和微生物等作用,主要由几丁质和表皮蛋白(cuticular protein,CP)组成。不同类型昆虫表皮的几丁质种类无明显差异,但表皮蛋白会随着昆虫种类、发育阶段、组织特异性的不同而有差异,所以表皮蛋白的种类和数量变化是影响表皮结构及其机械性能的主要因素(Andersenatal.,1995;Cornman and Willis,2010)。表皮蛋白的组成决定了表皮的机械特性,如弹性和坚硬性(Dittmeretal.,2012)。根据几丁结合域(chitin-binding domain,ChtBD)或保守基序,昆虫表皮蛋白主要分为12个家族:CPR,CPF,CPFL,TWDL (Tweedle),CPAP1,CPAP3,CPG,CPLCA,CPLCG,CPLCP,CPLCW和Apidermin(Willis,2010)。昆虫基因组分析表明,表皮蛋白基因约占编码蛋白基因的1%,意味着表皮蛋白在昆虫生长、繁殖、环境适应等过程中可能起着重要作用(Futahashietal.,2008;Ioannidouetal.,2014)。目前在基因组、转录组和蛋白组水平上已有20多种昆虫的表皮蛋白被鉴定和分析(Liuetal.,2019;Volovychetal.,2019)。然而,表皮蛋白的种类和特征在昆虫种类之间差异很大,从体虱Pediculushumanuscorporis的63种到埃及伊蚊Aedesaegypti的305种,而且主要集中于双翅目和鳞翅目昆虫(Ioannidouetal.,2014)。
沙葱萤叶甲Galerucadaurica是近年来在内蒙古草原猖獗发生的一种新害虫,主要取食沙葱Alliummongolium、野韭A.ramosum、多根葱A.polyrhizum等百合科葱属Allium植物。该虫自2009年在内蒙古草原上突然暴发成灾以来,目前发生范围已从2009年锡林郭勒盟的4个旗扩散到锡林郭勒盟、乌兰察布市、呼伦贝尔市、巴彦淖尔市、鄂尔多斯市和阿拉善盟6个盟市的20多个旗县(内蒙古自治区草原工作站内部资料),危害日趋严重,不仅严重影响草原畜牧业生产和牧民的生活,而且使当地本已脆弱的草原生态环境更加恶化。该虫一年发生1代,以卵滞育越冬,以成虫滞育越夏(昊翔等,2015)。单艳敏等(2019)应用RACE技术克隆了一个沙葱萤叶甲表皮蛋白基因GdAbd,并测定了其对温度胁迫的响应。本研究基于本实验室组装的沙葱萤叶甲转录组数据,拟对沙葱萤叶甲表皮蛋白基因进行进一步的鉴定和生物信息学分析,并对鉴定的8个代表性表皮蛋白基因在不同发育阶段及幼虫不同组织中表达谱进行分析,以期为进一步研究表皮蛋白在沙葱萤叶甲生长发育以及抵抗环境胁迫中的作用奠定必要的基础。
1 材料与方法
1.1 供试虫源
2019年3月将越冬卵置于温度25±1℃、相对湿度70%±5%、光周期为14L∶10D的人工气候箱进行孵育,以野韭饲喂。选取沙葱萤叶甲不同发育阶段整个虫体样品以及解剖获得3龄幼虫不同组织样品用于后续实验。
1.2 主要试剂和仪器
RNA提取试剂盒TaKaRa MiniBEST Universal RNA Extraction Kit,Premix TaqTM(TaKaRa TaqTMVersion 2.0 Plus Dye),PrmerScriptTM1st Strand cDNA Synthesis Kit,pMD19-T Vector Cloning Kit,D500 DNA Marker,DL2000 DNA Marker,大肠杆菌EscherichiacoliDH5α感受态细胞均购自大连宝生物工程有限公司;Go Taq® qPCR Master Mix购自Promega公司;核酸琼脂糖凝胶回收试剂盒购自天根生化科技(北京)有限公司;引物合成及序列测定由生工生物工程(上海)股份有限公司完成。其他试剂为国产分析纯试剂。普通PCR仪(T100 Thermal Cycler,Bio-Rad,美国);荧光定量PCR仪(FTC-3000P,Funglyn Biotech,加拿大);超微量分光光度计(NanoPhotometerTMP-Class,德国);智能型人工气候箱(PRX-350C,宁波海曙赛福实验仪器厂)。
1.3 沙葱萤叶甲表皮蛋白的鉴定与分析
利用关键词“cuticular protein”和“cuticle”在本实验室组装的沙葱萤叶甲幼虫和成虫转录组数据库进行直接检索,筛选候选表皮蛋白基因。将检索得到的序列在NCBI网站进行Blast验证,去除无注释信息或者注释信息非表皮蛋白的序列,去除E值大于1×10-5的序列,最后去除重复序列后,利用ORF Finder (http:∥www.ncbi.nlm.nih.gov/gorf/gorf.html)查找候选基因序列的开放阅读框,推测编码氨基酸序列。分别利用 SMART 和CutProtFam-Pred (http:∥aias.biol.uoa.gr/CutProtFam-Pred/search.php)(Karouzouetal.,2007;Ioannidouetal.,2014) 对序列保守结构域进行鉴定及家族分类。
1.4 沙葱萤叶甲表皮蛋白基因的克隆和测序
根据沙葱萤叶甲转录组数据,共筛选出134条注释为表皮蛋白的unigene序列,通过生物信息学分析,选取8条位于不同系统发育树分支上具有完整ORF的表皮蛋白基因片段进行克隆。利用Primer Premier 5.0 软件设计8对引物(表1),沙葱萤叶甲3龄幼虫提取总RNA后用1.5%的琼脂糖凝胶电泳和超微量分光光度计测定质量和浓度,逆转录生成cDNA。PCR反应体系(25 μL):cDNA模板(100 ng/μL) 1 μL,上下游引物(0.2 μmol/L)各1 μL,GoTaq® qPCR Master Mix 12.5 μL及RNase-free Water 9.5 μL。反应程序:94℃预变性3 min;94℃变性 30 s,60℃退火30 s,72℃延伸 2 min,25个循环;72℃延伸7 min。产物经1.5%琼脂糖凝胶电泳检测,然后对产物进行回收,与pMD-19T载体连接,连接产物转入大肠杆菌DH5α感受态细胞中进行转化,吸取转化后产物200 μL涂布含有氨苄西林的抗性LB平板上,过夜培养12~16 h,而后进行蓝白斑筛选。挑取平板上的菌落进行PCR鉴定后,将条带清晰、片段长度相符的合格菌落接种于含有10 mg/mL氨苄西林1.0 mL的LB液体培养基中,37℃ 220 r/min 摇床过夜培养12~16 h。然后送往生工生物工程(上海)股份有限公司进行测序。

表1 引物信息Table 1 Primer information
1.5 沙葱萤叶甲表皮蛋白基因的生物信息学分析
将1.4节的基因测序结果与转录组数据库中鉴定出的表皮蛋白基因片段序列通过DNAMAN软件进行比对。利用ComputePI/MW(http:∥web.expasy.org/compute_pi)进行目的基因编码蛋白质的等电点和相对分子量的预测分析;采用TMHMM Server V.2.0(http:∥www.cbs.dtu.dk/services/TMHMM/)和SignalP 5.1(http:∥www.cbs.dtu.dk/services/SignalP/)软件预测是否具有跨膜域和信号肽;采用NCBI中的BlastP(http:∥blast.ncbi.nlm.nih.gov/Blast.cgi)进行氨基酸序列同源性分析。利用在线工具(http:∥smart.embl-heidelberg.de/)进行蛋白质结构域预测;分别提取CP家族保守的结构域序列,利用ClustalX进行序列比对后,并用在线WebLogo工具(http:∥weblogo.berkley.edu/logo.cgi)绘出结构域LOG0图并分析序列特征及其保守氨基酸出现的频率;利用Mega 6.0软件中的邻接法(neighbor-joining method,NJ method)构建系统进化树,重复运行1 000次。
1.6 沙葱萤叶甲表皮蛋白基因表达谱的RT-qPCR分析
按照TaKaRa MiniBEST Universal RNA Extraction Kit 的操作步骤,提取沙葱萤叶甲不同发育阶段(1龄第3天幼虫15头,2龄第3天幼虫7头,3龄第3,5,7和9天龄幼虫及7日龄蛹及羽化当天雌、雄成虫各3头为1个生物学重复,3个重复)整个虫体样品的总RNA,使用超微量分光光度计和1.0%琼脂糖凝胶电泳鉴定提取的总RNA纯度和质量。按照PrimeScriptTM1st Strand cDNA Synthesis Kit操作说明反转录合成cDNA第1链,稀释10倍作为RT-qPCR分析的模板。以沙葱萤叶甲SDHA(GenBank登录号:KU240575)为内参基因(Tanetal.,2017)(表1),以3龄第3天幼虫的基因表达量作为对照,qPCR方法测定表皮蛋白基因在沙葱萤叶甲不同发育阶段的表达水平。反应体系(10 μL):模板1 μL,上下游引物(10 μmol/L)各0.2 μL,Go Taq® qPCR Master Mix 5 μL,Nuclease-Free Water 3.6 μL。采用两步法PCR程序进行反应,反应程序:95℃预变性10 min;95℃变性15 s,60℃退火1 min,共40个循环;95℃ 15 s,60℃ 15 s,95℃ 15 s。
3龄幼虫体型较大,为便于解剖,选取沙葱萤叶甲3日龄3龄幼虫进行不同组织表达谱分析。按照1.4节方法提取生成不同组织(头部、体壁、消化道和脂肪体)的cDNA,稀释10倍后作为qPCR分析的模板,qPCR内参基因和方法同上,基因相对表达量计算时以头部的基因表达量作为对照。
1.7 数据分析
采用2-ΔΔCt法(Livak and Schmittgen,2001)分析沙葱萤叶甲表皮蛋白基因的相对表达量,不同发育阶段及3龄幼虫不同组织相对表达量差异显著性分析采用单因素分析法(one-way ANOVA,Duncan氏新复极差法)。利用DPS15.0 数据处理系统对数据进行统计分析,数据以平均数±标准误表示。
2 结果
2.1 沙葱萤叶甲表皮蛋白基因的鉴定与序列分析
从沙葱萤叶甲转录组数据库共检索得到134个注释信息为表皮蛋白的序列,选取8条具有完整开放阅读框(ORF)的表皮蛋白基因,命名为GdauCP1-8(GenBank登录号:MN629000-MN629007)。以沙葱萤叶甲cDNA为模板,利用设计的引物,进行中间片段的扩增,获得预期大小的目的片段,测序结果与转录组数据比对一致。8条ORF长度为417~810 bp,编码138~269个氨基酸残基,分子量范围为15~28 kD,等电点为4.45~8.62。SignalP均预测出16~20个氨基酸的信号肽。TMHMM分析表明GdauCP1有典型的跨膜结构,其余表皮蛋白无跨膜区。利用8个基因编码的氨基酸序列在NCBI上进行BlastP比对分析发现,GdauCP3与马铃薯甲虫Leptinotarsadecemlineata表皮蛋白的氨基酸序列一致性最高,为60.00%;其余GdauCP蛋白与玉米根萤叶甲Diabroticavirgiferavirgifera表皮蛋白氨基酸序列一致性最高,在58.52%~80.00%之间。
运用SMART软件进行分析,发现GdauCP1-7属于CPR家族,都具有典型的R&R保守序列结构域G-x(8)-G-x(6)-Y(x代表任意氨基酸,数字代表氨基酸数量);GdauCP1-4都有低度复杂区且有的具有内部重复;GdauCP5-7有的具有低度复杂区但是无内部重复。GdauCP8不含ChtBD结构域,但有两个低度复杂区和4个内部重复。将其保守基序进行WedLogo分析发现,GdauCP1-4属于RR-2亚家族,保守基序为G-x-Y-L-x(3)-D-G-x(2)-R-x-V-Y-T-x-D-x(3)-G;GdauCP5-7属于RR-1亚家族,保守基序为G-x(8)-G-x(6)-Y-x-A-x(3)-G;GdauCP8的亚家族归属未确定。
采用从NCBI上搜索的3种鞘翅目昆虫的44条表皮蛋白氨基酸序列构建系统进化树,可以看出分为3支,GdauCP1-4聚为一类,该类属于RR-2亚家族;GdauCP5-7聚为一支,该类属于RR-1亚家族,这两个分支都属于CPR家族,所以为一大支;GdauCP8单独为一类,该结果与WedLogo分析结果一致(图1)。
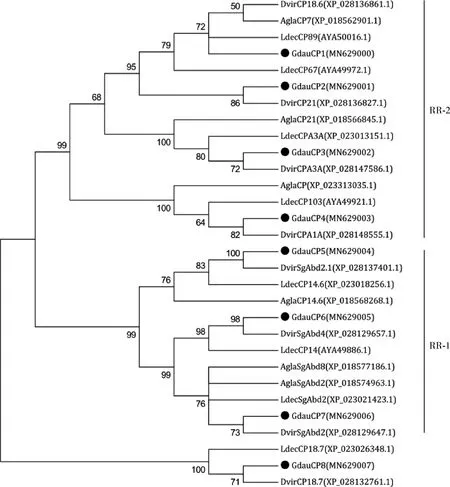
图1 基于氨基酸序列的沙葱萤叶甲及其他昆虫表皮蛋白系统进化树(邻接法,1 000次重复)Fig.1 Phylogenetic tree of cuticular proteins from Galeruca daurica and other insects based on the amino acid sequences (neighbor-joining method,1 000 replicates)CPs来源物种Origin species of CPs:Ldec:马铃薯甲虫Leptinotarsa decemlineata;Dvir:玉米根萤叶甲Diabrotica virgifera virgifera;Agla:光肩星天牛Anoplophora glabripennish.
2.2 沙葱萤叶甲不同发育阶段表皮蛋白基因的表达谱
从图2可知,8个GdauCP基因在沙葱萤叶甲不同发育阶段的表达水平均存在显著差异(P<0.05),其中GdauCP2,GdauCP4,GdauCP5和GdauCP6在1龄幼虫期的表达水平明显高于其他发育阶段,特别是GdauCP4约为对照3龄第3天幼虫中表达量的15 000倍,GdauCP4和GdauCP5的表达量在其他发育阶段间无显著差异(P>0.05);GdauCP3,GdauCP7和GdauCP8在蛹期的表达水平显著高于其他发育阶段(P<0.05),分别约为对照3龄第3天幼虫的50,2 000和200倍,且GdauCP7和GdauCP8的表达量在其他发育阶段间无显著差异(P>0.05);GdauCP1在3龄第3天幼虫期表达水平最高,其次为3龄第5天幼虫期,再次为2龄幼虫;除GdauCP2在成虫中表达水平较高外(约为对照3龄第3天幼虫的300倍),其他GdauCP基因在成虫中的表达水平均很低。
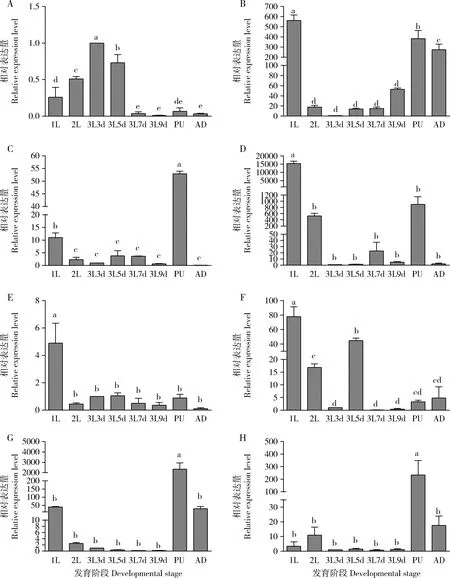
图2 沙葱萤叶甲表皮蛋白基因GdauCP1-8在不同发育阶段的表达分析Fig.2 Expression profiles of GdauCP1-8 at different developmental stages of Galeruca dauricaA:GdauCP1;B:GdauCP2;C:GdauCP3;D:GdauCP4;E:GdauCP5;F:GdauCP6;G:GdauCP7;H:GdauCP8.1L:1龄幼虫1st instar larva;2L:2龄幼虫2nd instar larva;3L3d:3龄第3天幼虫Day-3 3rd instar larva;3L5d:3龄第5天幼虫Day-5 3rd instar larva;3L7d:3龄第7天幼虫Day-7 3rd instar larva;3L9d:3龄第9天幼虫Day-9 3rd instar larva;PU:蛹Pupa;AD:成虫Adult.图中数据为平均数±标准误;柱上不同字母代表不同发育阶段间基因表达量差异显著(P<0.05,Duncan氏新复极差法)。Data in the figure are mean±SE,and different letters above bars indicate significant differences in the gene expression level among different developmental stages (P<0.05,Duncan’s new multiple range method).
2.3 沙葱萤叶甲幼虫不同组织中表皮蛋白基因的表达谱
沙葱萤叶甲GdauCP基因在3龄幼虫不同组织间表达水平也存在显著差异(P<0.05),其中:GdauCP1在头部和体壁中的表达水平显著高于在消化道和脂肪体中的(P<0.05);GdauCP2和GdauCP8在脂肪体中的表达水平明显高于在其他组织中的(P<0.05),其他组织间差异不显著(P>0.05);GdauCP3,GdauCP4,GdauCP6和GdauCP7在消化道中的表达量最高,GdauCP3,GdauCP4和GdauCP6的表达量在其他组织间差异不显著(P>0.05),GdauCP7在头部的表达水平显著高于在体壁和脂肪体中的(P<0.05);GdauCP5在体壁中表达量最高,其他组织间表达量差异不显著(P>0.05)(图3)。
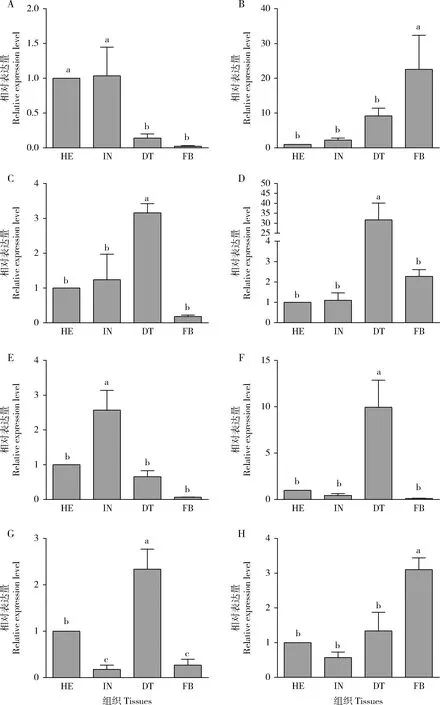
图3 沙葱萤叶甲表皮蛋白基因GdauCP1-8在3龄幼虫不同组织中的表达分析Fig.3 Expression profiles of GdauCP1-8 in different tissues of the 3rd instar larvae of Galeruca dauricaA:GdauCP1;B:GdauCP2;C:GdauCP3;D:GdauCP4;E:GdauCP5;F:GdauCP6;G:GdauCP7;H:GdauCP8.HE:头部Head;IN:体壁Integument;DT:消化道Digestive tract;FB:脂肪体Fat body.图中数据为平均数±标准误;柱上不同字母代表基因表达量在不同组织间差异显著(P<0.05,Duncan氏新复极差法)。Data in the figure are mean±SE,and different letters above bars indicate significant differences in the gene expression level among different tissues (P<0.05,Duncan’s new multiple range method).
3 讨论
表皮蛋白是昆虫体壁的重要成分,昆虫表皮的形成和发育过程离不开表皮蛋白的参与,其中分布最广、数量最多的家族是CPR家族,包括RR-1,RR-2和RR-3等3个亚家族,其含有一个Rebers &Riddiford基序(R&R Consensus)(Rebers and Riddiford,1988)。我们从沙葱萤叶甲幼虫和成虫的转录组数据中,共筛选出134条注释为表皮蛋白的unigene序列,通过构建系统发育树,本研究选取不同分支上8条具有完整ORF的代表性表皮蛋白基因进行原核表达、序列分析及表达谱分析。结构域和系统进化分析表明,GdauCP1-4属于RR-2亚家族,GdauCP5-7属于RR-1亚家族,GdauCP8与马铃薯甲虫LdecCP18.7和玉米根萤叶甲DvirCP18.7一样未确定类型。系统进化分析(图1)表明,除GdauCP1最先与马铃薯甲虫LdecCP89聚为一支,其他7个GdauCP蛋白均首先与玉米根萤叶甲表皮蛋白聚为一支。说明沙葱萤叶甲与玉米根萤叶甲亲缘关系最近,这与它们的分类地位相一致。
表皮蛋白基因在昆虫不同发育阶段或不同组织部位具有不同的表达模式,意味着其可能具有不同的功能(刘晓健等,2019)。在家蚕Bombyxmori翅原基中,RR-1表皮蛋白基因在化蛹之前和之后表达,RR-2 表皮蛋白基因在化蛹当天表达,表明RR-1和 RR-2表皮蛋白基因在家蚕翅原基内外表皮构建中具有不同的功能(Shahinetal.,2016,2018)。在本研究中,8个表皮蛋白基因在沙葱萤叶甲不同发育阶段表达模式不同。GdauCP4-6在1龄幼虫中高度表达,特别是GdauCP4约为对照3龄第3天幼虫中表达量的15 000倍(图2:D),可能在1龄幼虫表皮形成过程中起着重要作用。然而,中红侧沟茧蜂Microplitismediator大多数表皮蛋白基因表达量随幼虫龄期的增加而升高(Volovychetal.,2019)。GdauCP7和GdauCP8在蛹期的表达量最高,分别约为对照的2 000和200倍(图2:G,H),可能与蛹期表皮形成或羽化有关。除GdauCP2在成虫中表达量较高外,其他GdauCP基因在成虫中均低表达(图2:B)。转录组学分析也表明,马尾松毛虫Dendrolimuspunctatus绝大多数表皮蛋白基因在成虫期低表达,只有少数在成虫期高表达(Yangetal.,2017),但松墨天牛Monochamusalternatus表皮蛋白基因MoalICP在成虫中表达量最高(许雯等,2014)。贾盼等(2019)研究发现,飞蝗Locustamigratoria表皮蛋白基因LmAbd-2在各个龄期内表皮形成时期呈周期性高表达,可能与表皮的合成和沉积有关。在本研究中,虽然对3龄幼虫期也进行了不同日龄的划分,但未发现类似现象。可能与昆虫或表皮蛋白种类有关,也可能与发育阶段划分不够细致有关。今后应将1龄幼虫、2龄幼虫和蛹期进行更细致的划分,以确定沙葱萤叶甲表皮蛋白基因表达是否也有类似现象。
沙葱萤叶甲表皮蛋白基因组织特异性表达分析表明,不同GdauCP表达模式不同。GdauCP1在沙葱萤叶甲3龄幼虫头部和体壁中表达量最高(图3:A),家蚕表皮蛋白BmCPAP3-G也具有类似的表达模式(张薇薇等,2017)。GdauCP5在3龄幼虫体壁中高度表达,而在其他组织中低表达(图3:E)。飞蝗LmAbd-2也在体壁中高表达而在其他组织中低表达,在飞蝗蜕皮过程中参与内表皮的形成(贾盼等,2019)。GdauCP2和GdauCP8在沙葱萤叶甲3龄幼虫脂肪体中的表达量明显高于其他组织中的(图3:B,H),Majerowicz等(2017)在黑腹果蝇Drosophilamelanogaster的研究中也获得了相同的结果。GdauCP3,GdauCP4,GdauCP6和GdauCP7在沙葱萤叶甲3龄幼虫消化道中的表达量最高(图3:C,D,F,G),飞蝗的2个表皮蛋白基因Obst-D和Obst-E也主要在消化道中表达(王燕等,2015)。
近年来RNAi技术的快速发展,极大地促进了昆虫基因功能的研究。目前已有人应用该项技术研究了赤拟谷盗Triboliumcastaneum(Arakaneetal.,2012)和褐飞虱Nilaparvatalugens(马艳等,2013;Luetal.,2018;Panetal.,2018)表皮蛋白基因的功能,表明表皮蛋白基因在昆虫表皮的形成过程中起着重要作用。这些研究为后续深入挖掘沙葱萤叶甲表皮蛋白基因的功能具有重要的参考价值。昆虫表皮蛋白生物学功能的解析,不仅可以为深入认识昆虫表皮发育机制提供参考,而且可以为开发害虫防治新技术提供理论依据。
