尼妥珠单抗同步放化疗对局部晚期不可切除食管癌的疗效及安全性研究
2020-10-09方萍
方萍

[摘要] 目的 探讨尼妥珠单抗同步放化疗对局部晚期不可切除食管癌的疗效及应用安全性,为临床选取治疗方案提供参考。 方法 选取2017年1—12月解放军联勤保障部队第九○二医院收治的局部晚期不可切除食管癌患者94例为研究对象。根据随机数字表法将其分为观察组与对照组,每组47例。对照组采用同步放化疗治疗,观察组在对照组的基础上联合采用尼妥珠单抗治疗。比较两组近期疗效,1、2年生存率,毒副作用严重程度。结果 观察组治疗有效率、控制率高于对照组,差异均有统计学意义(均P < 0.05)。观察组1、2年生存率高于对照组,差异均有统计学意义(均P < 0.05);两组治疗后恶心呕吐、皮疹、放射性肺炎、放射性食管炎、骨髓抑制严重程度比较,差异无统计学意义(P > 0.05)。 结论 尼妥珠单抗同步放化疗治疗局部晚期不可切除食管癌能够提高近期效果,延长患者生存期,且耐受性好、安全性高,可推广应用。
[关键词] 食管癌;晚期;尼妥珠单抗;同步放化疗;疗效;安全性
[中图分类号] R735.1 [文献标识码] A [文章编号] 1673-7210(2020)08(a)-0152-04
[Abstract] Objective To explore the efficacy and safety of Nitzumab combined with concurrent radiotherapy and chemotherapy in the treatment of locally advanced unresectable esophageal cancer, and to provide a reference for clinical treatment. Methods From January to December 2017, 94 cases with locally advanced unresectable esophageal cancer in the 902th Hospital of Chinese′s People′s Liberation Army were selected as the study subjects. They were divided into the observation group and the control group according to the random number table method, with 47 cases in each group. The control group was treated with concurrent radiotherapy and chemotherapy, and the observation group was treated with Nitzumab on the basis of the control group. The short-term efficacy, one-year and two-year survival rates, severity of toxic and side effects were compared between the two groups. Results The effective rate and control rate of the observation group were higher than those of the control group, and the differences were all statistically significant (all P < 0.05). The one-year and two-year survival rates of the observation group were higher than those of the control group, and the differences were statistically significant (P < 0.05). There were no significant differences in the severity of nausea and vomiting, rash, radiation pneumonia, radiation esophagitis and myelosuppression between the two groups(P > 0.05). Conclusion Nitzumab combined with concurrent radiotherapy and chemotherapy can improve the short-term efficacy and prolong the survival time of patients, and has the advantages of good tolerance and high safety, which has a application value.
[Key words] Esophageal cancer; Advanced stage; Nitzumab; Concurrent radiotherapy and chemotherapy; Efficacy; Safety
食管癌是一種常见的消化道恶性肿瘤,在我国的发病率和死亡率均较高。据统计,我国食管癌发病率居常见恶性肿瘤第6位,死亡率居第4位[1-2]。食管癌患者通过手术切除治疗可较为彻底的清除病灶,提高生存率。但由于食管癌患者初诊时大多已处于中晚期,失去手术治疗机会,只能选择放化疗等非手术治疗手段。虽然放化疗技术不断进步,在一定程度上提高了治疗效果,但治疗失败率及转移复发率仍居高不下。因此,探索新的治疗方法,提高晚期不可切除食管癌患者的治疗效果,延长患者生存时间仍是临床面临的一大挑战。近年研究发现[3-4],食管癌患者的表皮生长因子表达异常上升,因此有学者提出可通过抗表皮生长因子受体抑制剂来提高食管癌治疗效果。尼妥珠单抗是抗表皮生长因子受体的人源化单克隆抗体,其在抗肿瘤方面的疗效已得到证实[5]。因此,本研究对局部晚期不可切除食管癌患者给予尼妥珠单抗同步放化疗治疗,旨在评估其疗效及应用安全性,现报道如下:
1 资料与方法
1.1 一般资料
选取2017年1—12月解放军联勤保障部队第九〇二医院肿的94例局部晚期不可切除食管癌患者为研究对象。纳入标准:①符合食管癌诊断标准并经病理学、食管CT检查确诊[6];②处于食管癌晚期;③患者知悉本研究,并自愿参加。排除标准:①存在远处转移者;②合并其他肿瘤者;③合并其他不可控内科疾病者;④可通过手术切除者;⑤有放化疗禁忌证者;⑥预计生存期少于3个月者。本研究经医院医学伦理委员会批准。根据随机数字表法将其分为观察组(47例)与对照组(47例)。观察组男27例,女20例;年龄33~71岁,平均(57.49±6.71)岁;临床分期:Ⅲ期22例、Ⅳ期25例。对照组男24例,女23例;年龄31~70岁,平均(56.49±7.25)岁;临床分期:Ⅲ期26例、Ⅳ期21例。两组一般资料比较,差异无统计学意义(P > 0.05),具有可比性。
1.2 方法
对照组采用同步放化疗治疗,具体方法:①放疗:所有患者均使用调强适形放疗。CT对患者病灶进行模拟定位,从C2开始向L4扫描,层厚为5 mm,层距为5 mm。由2位医师共同进行靶区及危及器官勾画。放疗剂量为1.80~2.01 Gy/次,1次/d,1周5次,治疗6~9周。放疗期间可根据患者靶区剂量分布、器官受照剂量等调整放疗剂量,总剂量为56~66 Gy,脊髓最大受照剂量≤45 Gy。②化疗:化疗采用TP方案(多西紫杉醇+顺铂),多西紫杉醇60 mg/m2,顺铂20 mg/m2,给药方式为静脉滴注,每周3次,21 d为1个周期,共4个周期。化疗期间每周进行1~2次血常规检查,每周期化疗前对患者进行心电图、肝肾功能检测。
观察组采用尼妥珠单抗结合同步放化疗治疗,具体方法:①放化疗:同对照组。②尼妥珠单抗(生产厂家:百泰生物药业有限公司;生产批号:20170104)用药前使用异丙嗪和地塞米松进行防过敏处理。然后将200 mg尼妥珠单抗加入250 mL的0.9%氯化钠溶液中静脉滴注,滴注时间不少于1 h。尼妥珠单抗治疗从放疗第1天开始,每周1次,共治疗6~9次,直至化疗结束。
1.3 观察指标
①比较两组近期疗效,包括治疗有效率和控制率。②随访2年,比较两组1、2年生存率。③比较两组治疗期间急性毒副作用严重程度。放疗毒副作用根据美国肿瘤放射治疗协作组标准进行评定,化疗毒副作用根据WHO毒副作用标准进行评价,根据严重程度分为0~4级,等级越高提示毒副作用程度越严重[7]。
1.4 疗效评价标准
近期疗效评定标准[8]:①完全缓解:患者治疗后肿瘤病变全部消失,且持续时间>1个月。②部分缓解:患者治疗后肿瘤病灶较治疗前缩小50%及以上,且持续时间>1个月。③稳定:患者治疗后肿瘤病灶较治疗前缩小50%以下或者增大25%及以下。④进展:患者治疗后肿瘤病灶增大超过25%或出现1个或多个新增病灶。有效率=(完全缓解+部分缓解)例数/总例数×100%。控制率=(完全缓解+部分缓解+稳定)例数/总例数×100%。
1.5 统计学方法
采用SPSS 20.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用百分率表示,组间比较采用χ2检验。以P < 0.05为差异有统计学意义。
2 结果
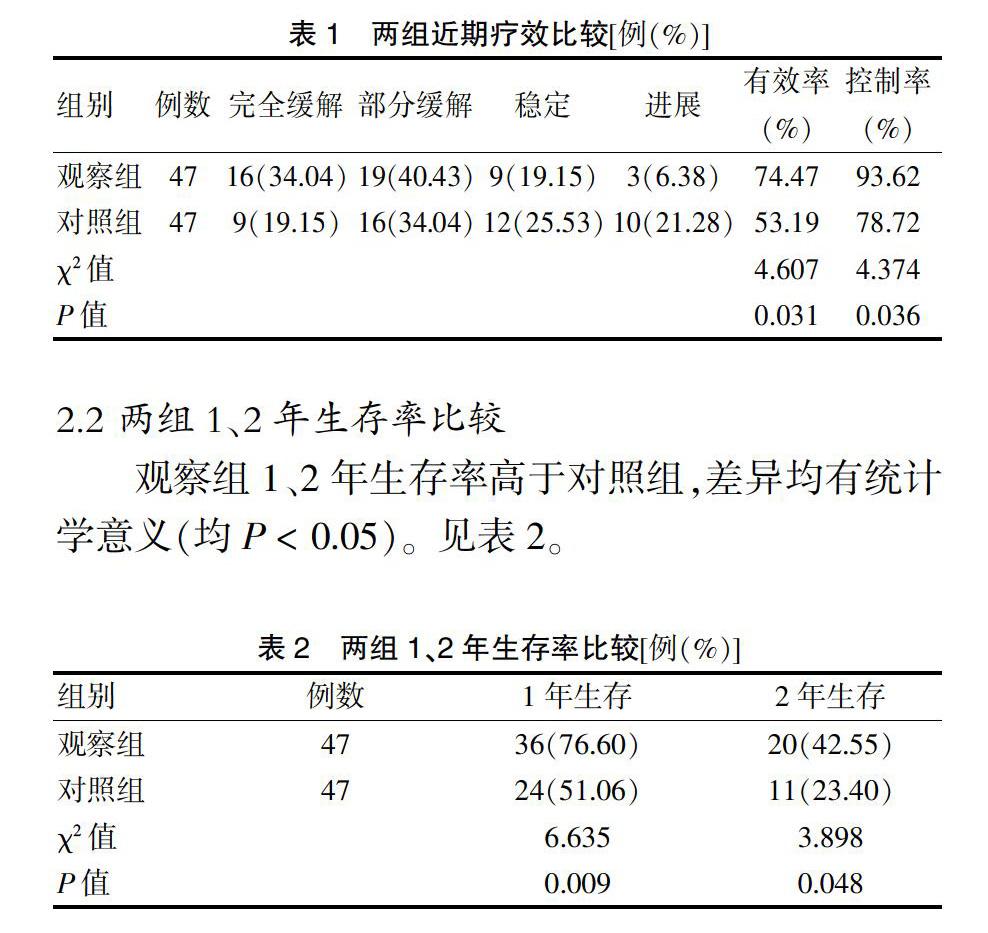
2.1 两组近期疗效比较
2.2 两组1、2年生存率比较
2.3 两组治疗后急性毒副作用严重程度比较
3 讨论
我国是食管癌高发国家。据统计,我国每年食管癌新发病例数约占全球总发病人数的50%[9]。由于70%左右的食管癌患者确诊时已不能进行手术切除治疗,导致其死亡率也居高不下[10]。目前,同步放化疗是治疗局部晚期不可切除食管癌的标准治疗方案[11]。虽然近年放化疗技术不断发展与进步,局部晚期不可切除食管癌患者的5年生存率已有所提高,但仅为20%~30%[12]。提高局部晚期不可切除食管癌患者的临床疗效,延长生存期,成为临床治疗的难点。
随着对肿瘤治疗研究的深入,关于分子靶向治疗恶性肿瘤的研究逐渐增多,以表皮生长因子为靶点的靶向药物开始应用于多种恶性肿瘤的治疗,且取得了确切疗效,成为治疗恶性肿瘤的第4种形式[13-14]。大量研究證实,表皮生长因子受体在食管癌中呈现出高表达状态,其可通过与配体结合参与肿瘤细胞的增殖、生长及凋亡过程,且其表达水平也影响着化疗敏感度[15-16]。因此,通过抑制表皮生长因子受体在机体中的表达能够产生一定的抗肿瘤作用。尼妥珠单抗是我国第1个引入的用于恶性肿瘤治疗的单抗药物。食管癌中表皮生长因子受体的表达率为50%~70%,具备实施尼妥珠单抗治疗的可行条件[17]。尼妥珠单抗治疗食管癌的作用机制包括以下两点:①以表皮生长因子受体为靶点,通过竞争性的抑制表皮生长因子受体与其配体的结合来阻断肿瘤细胞增殖及新生血管生成,促进肿瘤细胞的凋亡;②通过诱导抗体和补体依赖的细胞毒性机制来削弱肿瘤细胞的生物合成作用,抑制肿瘤细胞生长、转移,使其逐渐凋亡,发挥抗癌作用。此外,表皮生长因子受体的过度表达会影响放化疗的敏感性,而尼妥珠单抗通过抑制表皮生长因子受体的过度表达,也可增强放化疗敏感性[18-22]。目前,已有报道提出应用尼妥珠单抗与常规放化疗联合治疗局部晚期不可切除食管癌[23],但对于该治疗方法的疗效及安全性仍有待进一步研究。
本研究结果显示,观察组治疗有效率、控制率高于对照组(均P < 0.05);2年生存率高于对照组(P < 0.05)。这是因为尼妥珠单抗同步放化疗治疗可发挥协同作用,不仅发挥了放化疗和尼妥珠单抗自身抗肿瘤作用,同时也通过尼妥珠单抗增强了放化疗的治疗效果。放疗的主要急性毒副作用为放射性肺炎,化疗则会出现恶心呕吐等胃肠道反应、骨髓抑制等副作用。尼妥珠单抗治疗则可能出现皮疹、发热、头晕等症状。本研究结果显示,两组治疗后恶心呕吐、皮疹、放射性肺炎、放射性食管炎、骨髓抑制严重程度比较,差异无统计学意义(P > 0.05),且各毒副作用严重程度也未见明显差别。提示尼妥珠单抗联合放化疗治疗安全性高,既不会导致患者毒副作用增多,且尼妥珠单抗治疗自身毒副作用轻微,无需干预即可自行缓解。
综上所述,尼妥珠单抗同步放化疗治疗局部晚期不可切除食管癌能够提高近期疗效,延长患者生存期,且耐受性好、安全性高,可推广应用。
[参考文献]
[1] 李路路,郭宇飞,张睿,等.尼妥珠单抗联合IMRT治疗根治性放化疗后局部复发食管癌的临床研究[J].长治医学院学报,2019,33(2):134-137.
[2] Nayan N,Bhattacharyya M,Jagtap VK,et al. Standard dose versus high dose radiotherapy with concurrent chemotherapy in esophageal cancer:A prospective randomized study [J]. South Asian J Cancer,2018,7(1):27-30.
[3] 刘向明,马明全.食管癌分子靶向治疗的新进展[J].国际生物医学工程杂志,2018,41(6):549-555.
[4] Castro C,Peleteiro B,Morais S,et al. An explanatory and predictive model of the variation in esophageal cancer incidence on the basis of changes in the exposure to risk factors [J]. Eur J Cancer Prev,2018,27(3):213-220.
[5] 师颖瑞.食管癌后程加速超分割调强适形放疗及和其联用尼妥珠单抗的研究[C].中国抗癌协会中国医师协会.第九届中国肿瘤内科大会、第四届中国肿瘤医师大会暨中国抗癌协会肿瘤临床化疗专业委员会2015年学术年会论文集.2015:641.
[6] 中国抗癌协会食管癌专业委员会编.食管癌规范化诊疗指南[M].北京:中国协和医科大学出版社,2013.
[7] 高献书.食管癌放射治疗指南[M].北京:中国医药科技出版社,2011.
[8] 方文涛.通过食管癌TNM新分期(第八版)解读2017年NCCN食管鳞癌诊疗指南[J].中华胃肠外科杂志,2017, 20(10):1122-1126.
[9] 陈邓林,陈俊民,王琳.尼妥珠单抗在局部晚期食管癌治疗中的应用进展[J].现代肿瘤医学,2018,26(2):318-321.
[10] 翟医蕊,惠周光,梁军,等.同步尼妥珠单抗联合放化疗治疗不可切除局部晚期食管鳞癌的疗效分析[J].中国临床医生杂志,2019,47(9):1052-1055.
[11] Tachimori Y,Ozawa S,Numasaki H,et al. Comprehensive Registry of Esophageal Cancer in Japan,2011 [J]. Esophagus,2018,15(3):1-26.
[12] 吴小源,邢文群,李雪,等.尼妥珠单抗联合术前同期放化疗治疗局部进展期食管鳞癌初步临床研究[J].中华放射肿瘤学杂志,2019,28(3):185-187.
[13] Schlottmann F,Herbella FAM,Patti MG. Volume and Outcomes in Esophageal Cancer Surgery:Diagnosis and Treatment [M]. Esophageal Cancer,2018.
[14] 張家化,杨俊卿,罗映.单抗类抗肿瘤代表药物上市后安全信号的挖掘与评价[J].中国新药杂志,2019,28(13):1654-1660.
[15] Joob B,Wiwanitkit V. Folate intake and risk of esophageal cancer [J]. Eur J Cancer Prev,2019,28(4):382.
[16] Visser E ,Markar SR,Ruurda JP,et al. Prognostic Value of Lymph Node Yield on Overall Survival in Esophageal Cancer Patients:A Systematic Review and Meta-analysis [J]. Ann Surg,2018,269(2):261-268.
[17] 刘新彦,李建斌,李志强,等.尼妥珠单抗联合顺铂治疗鼻咽癌的临床研究[J].中国临床药理学杂志,2018,34(13):1504-1507.
[18] Semenkovich TR,Meyers BF. Surveillance versus esop-hagectomy in esophageal cancer patients with a clinical complete response after induction chemoradiation [J]. Ann Transl Med,2018,6(4):81.
[19] 陈晓钟,金厅.靶向表皮生长因子受体治疗鼻咽癌的研究进展[J].浙江医学,2018,40(13):1415-1418,1423.
[20] 龚星,田添,梁素美,等.尼妥珠单抗联合卡培他滨片对局部晚期鼻咽癌的临床疗效[J].中外医学研究,2019, 17(24):26-27.
[21] 孙健达,胡丹,冯会亭,等.尼妥珠单抗治疗局部晚期鼻咽癌的临床观察[J].中国现代医生,2019,57(20):89-93.
[22] 孙健达,胡丹,冯会亭,等.尼妥珠单抗治疗局部晚期鼻咽癌的近期疗效及不良反应分析[J].中国医药科学,2019, 9(8):54-57.
[23] 郭银.尼妥珠单抗对食管鳞癌ECA-109细胞放射敏感性的影响及机制研究[D].石家庄:河北医科大学,2015.
(收稿日期:2020-04-21)
