小黄鱼边角料的酶解工艺及酶解液性能研究
2020-10-09丁慧璞欧阳伟虹黄玉婷王志江刘利萍
丁慧璞 欧阳伟虹 黄玉婷 张 捷 王志江 刘利萍
(1浙江万里学院生物与环境学院,浙江 宁波 315100;2浙江医药高等专科学校制药工程学院,浙江 宁波 315100)
小黄鱼在加工过程中会产生50%左右的边角料,鱼类边角料含有丰富的蛋白质和微量元素。然而,鱼类边角料腥味重,多数企业对其深加工技术不到位,导致企业对于边角料的储存与利用较为困难,大部分作为鱼饲料低价出售,有些边角料甚至废弃造成环境污染[1]。目前对鱼类边角料开发利用多采用酶解技术,如姜绍通等[2]用中性蛋白酶对白鲢鱼骨进行酶解开发鱼汤,经酶解后鱼腥味明显减弱,熬煮的鱼汤中游离氨基酸含量增加,鱼汤呈鲜香味,且其酶解产物具有抗氧化性和抑菌性;施永清等[3]利用碱性蛋白酶和酸性蛋白酶对鲫鱼鱼鳞进行酶解制备了抗菌肽,其对副溶血弧菌的抑菌圈直径高达27.72 mm;涂丹等[4]采用碱性蛋白酶酶解罗非鱼鱼鳞制备了鱼鳞蛋白降血压活性肽;董亚飞等[5]采用复合蛋白酶和风味蛋白酶对带鱼下脚料进行酶解制备锌螯合物;Ji 等[6]用木瓜蛋白酶酶解小黄鱼蛋白,得到的酶解产物对·OH、DPPH 自由基的清除效率随着水解度的增大而增大,证明了利用酶法水解小黄鱼蛋白质可制备具有抗氧化性的水解产物。
生物酶解技术运用于食品制作可显著改善食品的风味[7]。通过生物酶解小黄鱼边角料可产生大量的L-氨基酸和多肽,在酶解温度下与还原糖发生美拉德反应改善产品风味[8]。酶制剂类型、酶解程度对酶解产品的品质,如氨基酸态氮含量、鲜味等均有较大影响,甚至可能产生苦味肽,严重影响产品的风味[9-10]。因此,研发适宜的酶解条件是小黄鱼边角料开发浓缩鱼汤的基础。
本研究在前期小黄鱼边角料脱腥工艺试验的基础上,以氨基酸态氮含量为指标,优化小黄鱼边角料的酶解工艺条件,获得富含氨基酸、多肽的小黄鱼边角料酶解液;并对小黄鱼边角料酶解液进行分离纯化,得到不同分子量的多肽,对酶解多肽的抗氧化性和抗菌活性进行评价,旨在为利用小黄鱼边角料制备具有功能活性的浓缩鱼汤及其产业化提供数据支撑。
1 材料与方法
1.1 试验材料与试剂
小黄鱼边角料,宁波兰洋水产食品有限公司;KA66 酵母抽提物(批号2017012202E9),安琪酵母股份有限公司;碱性蛋白酶(酶活力为2×105U·g-1)、木瓜蛋白酶(酶活力为8×105U·g-1)、酸性蛋白酶(酶活力为5×104U·g-1),宁波丰肽生物科技有限公司;福林酚(1 mol·L-1),国药集团化学试剂有限公司;L-谷胱甘肽(L-glutathione,纯度>99.0%,氧化型,GSH),北京索莱宝科技有限公司; N,N,-甲叉双丙烯酰胺、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三羟甲基甘氨酸(trimethylolglycine,Tricine)、三羟甲基氨基甲烷(trihydroxymethyl aminomethane,Tris 碱)、考马斯亮蓝G-250、甲醛、氢氧化钠、酚酞、乙醇、邻苯二甲酸氢钾、三氯乙酸、五水硫酸铜、酒石酸钾钠、硫酸亚铁、水杨酸、过氧化氢、铁氰化钾、氯化铁、磷酸二氢钠、磷酸氢二钠,均为分析纯,国药集团化学试剂有限公司;Lowery 蛋白定量试剂盒,南京莱富赛生物科技有限公司;1,1-二苯基-2-苦肼基自由基(1,1-diphenyl-2-bitter hydrazine radical,DPPH),梯希爱化成工业发展公司;牛血清蛋白,上海申航生物科技有限公司;枯草芽孢杆菌(Bacillus subtilis)、酵母菌(Saccharomyce)、大肠杆菌(Escherichia coli.) 和金黄色葡萄球菌(Staphylococcus aureus),浙江万里学院微生物实验室。
1.2 主要仪器与设备
PowerPacTMBasic 型电泳仪,美国Bio-rad 公司;T6型紫外分光光度计,北京普析通用仪器公司;6-16K型低速大容量冷冻离心机,德国Sigma 公司;透析袋(压平宽度34 mm,直径22 mm,分子截留300 Da),美国Viskase 公司;R-200 型中低压层析系统,广东瑞柏仪器科技有限公司;2.6 cm×30 cm DEAE-52 层析柱,上海生工生物工程技术服务有限公司;SHA-B 型恒温振荡器,常州国华电器有限公司;R201O 型旋转蒸发仪,巩义市予华仪器有限公司。
1.3 小黄鱼边角料的酶解试验
1.3.1 酶解液的制备工艺 冰冻小黄鱼边角料→解冻、漂洗、沥干→按固液比1∶2 加水制鱼糜→添加酵母抽提物脱腥→添加蛋白酶进行酶解→煮沸灭酶→离心(4 000 r·min-1,5 min)→小黄鱼酶解液[11]。
1.3.2 酶制剂的筛选 选取木瓜蛋白酶、碱性蛋白酶、酸性蛋白酶3 种酶对脱腥后小黄鱼鱼糜进行酶解,酶解时按底物蛋白固定加酶量为120 U·g-1,其中碱性蛋白酶在55℃、pH 值9 条件下酶解[12];木瓜蛋白酶在50℃、pH 值7.0 条件下酶解[13];酸性蛋白酶在55℃、pH 值3.0 条件下酶解[3],酶解时间均为0.5 h。以氨基酸态氮含量为指标[11],比较3 种酶的酶解效果。
1.3.3 酶解工艺的单因素试验 以氨基酸肽氮含量为指标,称取100 g 鱼糜12 份,固定酶解温度55℃,分别进行以下酶解试验:按底物蛋白加酶量107 U·g-1,酶解液pH 值9,考察不同酶解时间(0.5、1、2、4 h)对酶解液中氨基酸态氮含量的影响;按底物蛋白加酶量107 U·g-1,酶解时间0.5 h,考察酶解液不同pH 值(8、9、10、11)对酶解液中氨基酸态氮含量的影响;酶解时间0.5 h,酶解液pH 值9,考察不同底物蛋白加酶量(107、215、322、430 U·g-1)对酶解液中氨基酸态氮含量的影响。上述酶解反应完毕,灭酶活,离心,取5 mL 上清液稀释至50 mL,测定稀释液中氨基酸态氮含量。
1.3.4 酶解工艺优化 根据单因素试验结果选择底物蛋白加酶量为107、215、322 U·g-1,酶解时间为0.5、1、2 h,酶 解pH 值为9、10、11,利用Design-Expert 8.0.6 软件,采用Box-Behnken 中心组合试验设计,以氨基酸态氮为指标,优化小黄鱼边角料酶解条件。试验因素水平见表1。
1.4 小黄鱼边角料酶解液的分离纯化
1.4.1 酶解液中多肽含量的测定 采用双缩脲法[14]测定最优条件制备的酶解液中的多肽含量。以0、2、4、6、8、10 mg·mL-1牛血清蛋白为标准溶液,测定A540nm,得标准曲线y=0.047x+0.005 9,R2=0.996 8。
1.4.2 DEAE-52 柱分离纯化酶解液 参照文献[15]的方法并略作调整,将最适酶解条件下制备的酶解液离心,过0.45 μm 膜,上样2 mL,流速1.5 mL·min-1,于190 nm 波长处检测吸光度值。收集分离组分全峰,重复多次,合并相同组分。将分离组分用透析袋透析至中性后旋蒸浓缩至5 mL,于-20℃保存备用。
1.4.3 Tris-Tricine-SDS-PAGE 凝胶电泳测定多肽分子量 参照文献[16]的方法并略作调整。夹层胶、浓缩胶和分离胶的体积分数分别为10%、10%、16.5%。将响应面优化所得酶解液多肽配制成10 mg·mL-1的溶液,于95℃保温5 min,10 000 r·min-1离心2 min 后,再与标准蛋白Marker 溶液分别上样5 μL 进行电泳(电泳条件:恒压30 V 通过浓缩胶和夹层胶、恒压100 V 通过分离胶)。
1.4.4 福林酚法测定各组分中多肽含量 参照文献[17]的方法并略作调整。取6 支试管分别加入0.00、0.02、0.04、0.06、0.08、0.10 mg·mL-1牛血清蛋白溶液各1 mL,根据试剂盒测试说明书进行后续操作,反应完成后于500 nm 波长处测定吸光度值,根据所得标准曲线计算肽含量:y=2.29x-0.004 1,R2=0.991 8。
1.5 小黄鱼边角料酶解液的抗氧化性测定
1.5.1 酶解液对自由基清除率的测定 样品预处理:于5 mL 酶解液中加入5 mL 10%三氯乙酸,漩涡混匀后静置10 min,4 000 r·min-1离心5 min,收集上清液稀释2、3、4、5 倍备用。
·OH 清除率测定:参照文献[18]的方法测定。
DPPH 自由基清除率测定:参照文献[19]的方法并略作调整。取1.5 mL 待测酶解液至1.5 mL 含0.10 mmol·L-1DPPH 自由基的95%乙醇中,混匀,避光静置30 min,于517 nm 波长处测定吸光度值,记为Ax;以1.5 mL 水和1.5 mL DPPH 自由基溶液作空白组,测定吸光度值,记为A0;以1.5 mL 待测酶解液和1.5 mL 95%乙醇作样品对照,测定吸光度值,记为Ax0。同时,以谷胱甘肽(glutathione,GSH)为阳性对照。按照公式计算自由基清除率:

1.5.2 酶解液还原力的测定 参照文献[20]的方法测定。
1.6 小黄鱼边角料酶解多肽的抑菌性测定
1.6.1 多肽对4 种微生物的抑菌性比较 参照文献[21]的方法。取浓度为1×106CFU·mL-1枯草芽孢杆菌、酵母菌、金黄色葡萄球菌和大肠杆菌菌液各50 μL于5 支试管中,分别加入100 μL 的无菌蒸馏水、多肽组分Ⅰ~Ⅳ(浓度为100 μg·mL-1),再加入液体培养基至5 mL,37℃摇床培养24 h 后测定菌悬液的A600nm。
1.6.2 多肽组分Ⅲ对4 种微生物生长的抑制 每种菌液(1×106CFU·mL-1)各取50 μL 于不同试管中,分别加入100 μL 蒸馏水、多肽组分Ⅲ(浓度为100 μg·mL-1),再加入液体培养基至5 mL,考察不同菌在0、3、6、12、18、24 h 的生长情况,并以A600nm为纵坐标,时间为横坐标绘制细菌生长曲线。
1.7 数据处理
试验数据以平均数±标准差表示,平行3 次。用Design Expert 8.0.6 软件对响应面试验数据进行统计分析。用SPSS 17.0 软件的Duncan 法对数据进行显著性分析。
2 结果与分析
2.1 酶制剂的筛选
由图1可知,木瓜蛋白酶和碱性蛋白酶在最适酶解条件下酶解液的氨基酸态氮含量分别为0.273 4、0.267 6 g·100 g-1,极显著高于酸性蛋白酶(0.208 1 g·100 g-1)和未酶解组(0.212 g·100 g-1)。比较碱性蛋白酶、木瓜蛋白酶酶解液的风味和口感,选择碱性蛋白酶为酶制剂。
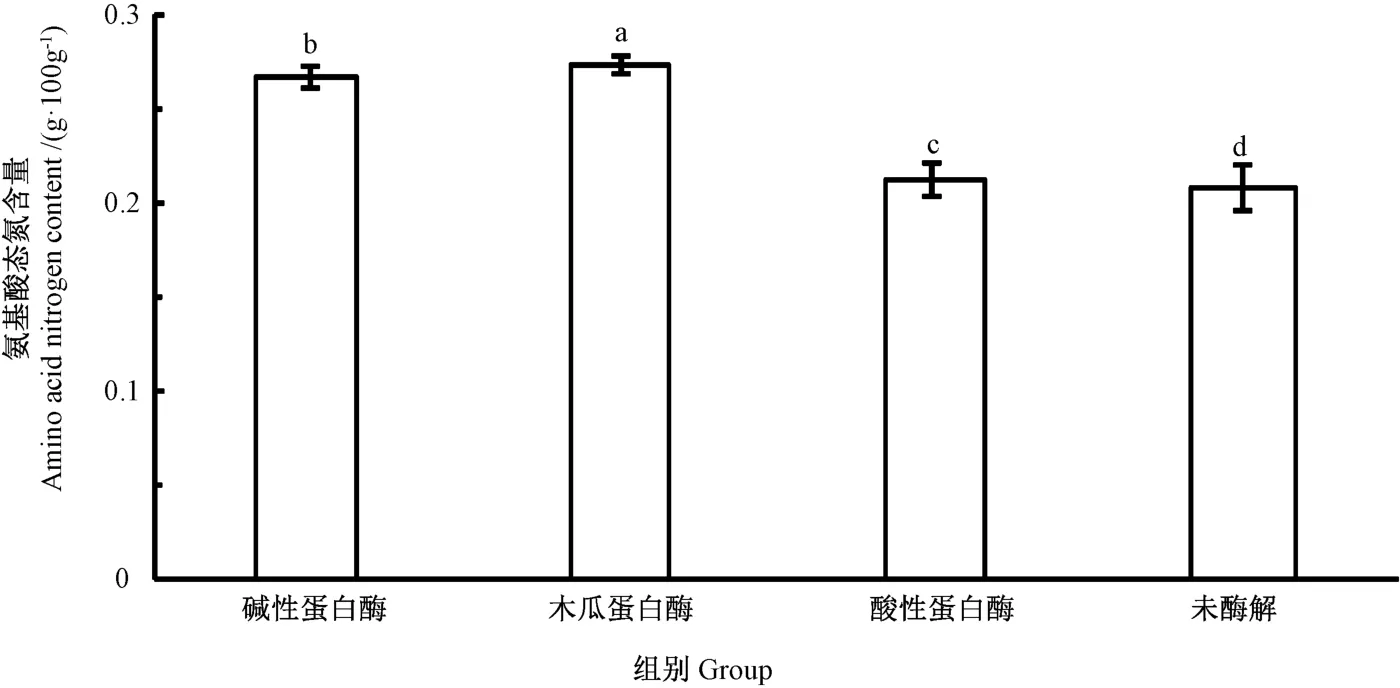
图1 不同酶制剂酶解小黄鱼边角料酶解液中氨基酸态氮的含量Fig.1 Amino acid nitrogen content in enzymatic hydrolysis of small yellow croaker scraps with different protease
2.2 酶解工艺的影响因素试验结果
2.2.1 酶解时间的影响 由图2可知,小黄鱼边角料酶解液中氨基酸态氮含量随酶解时间延长而增加,酶解2 h 后,其水解度变化趋缓。这可能是由于酶解初始,底物与酶的质量浓度均较高,接触面较大,酶解速度较快,水解度增幅较大;随着反应进行,酶量减少,酶解液中游离肽不断积累,水解度趋缓。因此后续进一步对酶解时间0.5~2 h 进行优化。

图2 酶解时间对小黄鱼边角料酶解液氨基酸态氮含量的影响Fig.2 The effect of enzymolysis time on amino acid nitrogen content in enzymatic hydrolysate of small yellow croaker scarps
2.2.2 酶解液pH 值的影响 由图3可知,氨基酸态氮含量随酶解液pH 值增加而增大,当pH 值为8 时最低,当pH 值介于9~10 时,氨基酸态氮含量增幅较大,而pH 值为10~11 时,氨基酸态氮含量变化趋于平缓。后续进一步对酶解液pH 值9~11 进行优化。

图3 pH 对小黄鱼边角料酶解液氨基酸态氮含量的影响Fig.3 The effect of pH on amino acid nitrogen content in enzymatic hydrolysate of small yellow croaker scarps
2.2.3 加酶量的影响 由图4可知,小黄鱼边角料酶解液中氨基酸态氮含量随着加酶量增加呈先增加后缓慢减小的趋势。当加酶量达到215 U·g-1时酶解液中氨基酸态氮含量达到0.298 1 g·100g-1;随着加酶量继续增加,氨基酸态氮含量反而略有下降,可能是酶解产物与酶形成复合物,阻碍了底物与酶的结合,减缓了蛋白水解。因此后续进一步对加酶量107 ~322 U·g-1进行优化。

图4 加酶量对小黄鱼边角料酶解液氨基酸态氮含量的影响Fig.4 The effect of enzyme dosage on amino acid nitrogen content in enzymatic hydrolysate of yellow croaker scraps
2.3 响应面优化酶解工艺的结果及验证
2.3.1 响应面回归模型的建立与分析 对表2进行回归分析得到相应的二次响应面回归方程:
Y=0.40+0.077A+0.014B+0.031C-1.0×10-4AB-1.70×10-3AC+4.13×10-3BC-0.012A2-8.01×10-3B2-0.023C2。
由表3可知,回归模型P<0.000 1,模型极显著;一次项A、B、C,二次项C2对小黄鱼边角料酶解液中氨基酸态氮含量影响极显著(P<0.01),二次项A2对小黄鱼边角料酶解液中氨基酸态氮含量影响显著(P<0.05),说明加酶量、酶解液pH 值与酶解时间对酶解效果影响显著。失拟项P=0.051 7,表明模型拟合程度良好;根据F值得出各因素对小黄鱼边角料酶解液中氨基酸态氮含量的影响表现为A>C>B。相关系数R2=0.992 7,说明响应值的变化有99.27%与所选变量有关。模型的校正系数=98.32%,说明不确定因素对试验结果的干扰较小,该模型与数据拟合度较高,比较可靠[22],可用于分析和预测小黄鱼边角料酶解液中氨基酸态氮含量。

表3 回归模型的方差分析Table3 Analysis of variance of regression model

表2 酶解条件的Box-Behnken 响应面试验结果Table2 Box-Behnken response surface experiment results of enzymatic conditions
2.3.2 响应面结果分析 响应曲面中等高线的曲率大小可以直接反映出因素之间的交互作用,曲率越大并呈椭圆形表示两因素的交互作用明显,曲率越小并呈圆形表示两因素的交互作用不明显。由图5可知,交互项AB、BC、AC对结果影响不明显,出现这种情况可能与试验中各因素水平范围不够精细有关。但从响应面图可以看出,加酶量的增加和酶解时间的延长,有利于酶解液中氨基酸态氮含量的增加。但酶解越彻底得到的酶解液色泽越深,且会产生具有苦味的多肽,影响产品的外观和风味。
通过模型预测小黄鱼边角料酶解的最优条件为:采用碱性蛋白酶,在固液比1∶2,酶解温度55℃,加酶量322 U·g-1、酶解液pH 值11、酶解时间2 h 条件下,预测酶解液中氨基酸态氮含量为0.490 6 g·100 g-1。在此条件进行3 次验证试验,结果为0.545 2 g·100 g-1,相对标准偏差为5.10%,表明该酶解工艺条件稳定可行。
2.4 酶解液中多肽的分离纯化结果
2.4.1 酶解多肽分离纯化与分子量测定 由图6可知,小黄鱼边角料酶解液经DEAE-52 层析柱分离得到4 组多肽,组间完全分离。随分离时间的延长,收集的组间多肽量依次减少,说明小黄鱼边角料经碱性蛋白酶酶解得到的是不同分子量的多肽混合物,这与碱性蛋白酶专一性差、有多个酶切位点有关[23]。分离得到的组分Ⅰ~组分Ⅳ多肽的凝胶电泳图如图7所示。测定得到组分Ⅰ、Ⅱ、Ⅲ中多肽的分子量分别为14.4~20.1 kDa、5.8~7.8 kDa、<3.3 kDa,组分Ⅳ未出现蛋白条带,这可能是其分子量太小所致。

图5 各酶解因素的交互作用对酶解液氨基酸态氮含量的影响Fig.5 Effect of interaction of various enzymatic factors on amino acid nitrogen content in enzymatic hydrolysate
2.4.2 酶解多肽含量测定结果 小黄鱼边角料酶解液中蛋白多肽含量较高,采用双缩脲试剂法测定;对于分离得到的组分多肽含量采用Folin-酚法测定,酶解液及各组分多肽含量见表4。
2.5 体外抗氧化测定结果
2.5.1 自由基清除率 图8是小黄鱼酶解多肽与阳性对照组GSH 对·OH 的清除率,均呈现浓度依懒性,经拟合分别得方程为:酶解液y=3.47x+45.67,R2=0.982 4;谷胱甘肽y=7.95x+6.57,R2=0.992 3。酶解液和GSH 对·OH 清除能力的IC50值分别为1.25、5.46 mg·mL-1,说明小黄鱼边角料酶解液在一定浓度范围内对·OH 的清除能力强于GSH,当小黄鱼酶解多肽浓度为8.62 mg·mL-1时,对·OH 的清除率约为80%,这与酶解液中多肽的-NH2或-COOH 与Fe2+络合阻断了·OH的生成有关[24]。

图6 小黄鱼边角料酶解多肽的DEAE-52 层析柱梯度洗脱曲线Fig.6 DEAE-52 column gradient elution curve of enzymatic hydrolysate of small yellow croaker scraps

表4 小黄鱼边角料酶解液与组分Ⅰ~组分Ⅳ中多肽的含量Table4 Polypeptide content in enzymatic hydrolysate and Ⅰ~Ⅳfractions of small yellow croaker scraps/(μg·mL-1)

图7 各组多肽的SDS-PAGE 电泳图Fig.7 SDS-PAGE electrophoresis of polypeptide of all fractions
图9是小黄鱼酶解液与阳性对照GSH 对DPPH自由基的清除率,也呈现浓度依懒性。经拟合分别得方程为:酶解液y=2.06x+14.85,R2=0.819 2;谷胱甘肽y=689.80x+18.37,R2=0.992 0,对应的IC50值分别为17.07 和0.05 mg·mL-1,表明小黄鱼边角料酶解液对DPPH 自由基的清除率弱于GSH。但是随着小黄鱼边角料酶解液多肽浓度的提高,其对DPPH 自由基的清除率也逐渐增强,当小黄鱼酶解液多肽浓度为25.59 mg·mL-1时,对DPPH 自由基的清除率为61.26%。这与酶解多肽能提供类似氢供体的氨基酸有关,这些氨基酸亲近DPPH 自由基形成稳定结构,达到清除DPPH 自由基的效果[25]。

图8 小黄鱼边角料酶解多肽对·OH 的清除率Fig.8 Scavenging rate of·OH by enzymatic hydrolysis polypeptide of small yellow croaker scraps
2.5.2 还原力测定结果 还原力说明酶解多肽具有供给电子的能力[26],能作为初级和次级抗氧化剂减少脂质过氧化反应,具有抗氧化作用。由图10可知,随着小黄鱼边角料酶解液多肽浓度的增加,其还原力增强。当小黄鱼边角料酶解液多肽浓度为9 mg·mL-1时,其还原力与GSH 浓度为0.06 mg·mL-1的还原力一致。表明小黄鱼边角料酶解液多肽的还原力远弱于GSH。

图9 小黄鱼边角料酶解多肽对DPPH 自由基的清除率Fig.9 Scavenging rate of DPPH by enzymatic hydrolysis polypeptide of small yellow croaker scraps
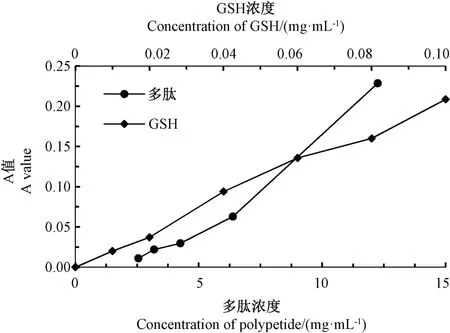
图10 小黄鱼边角料酶解多肽的还原力Fig.10 Reductive power of enzymatic hydrolysis polypeptide from small yellow croaker scraps
2.6 酶解液多肽的抑菌性试验结果
2.6.1 不同组分多肽对4 种细菌的抑制率比较 一般来说,细菌浓度与吸光度值A 呈正相关性。由图11可知,组分Ⅰ、Ⅱ、Ⅳ对4 种细菌基本无抑制效果反而促进了细菌增长(除组分Ⅱ对大肠杆菌有微弱抑菌效果),多肽组分Ⅲ对4 种细菌的抑菌效果均极显著高于空白组(P<0.01)。这可能是由于组分Ⅰ、Ⅱ分子量较大,是未完全水解蛋白,组分Ⅳ主要是分子量较小的氨基酸,是水解度过高的组分,可为细菌提供营养物质氮,促进细菌的生长[25]。组分Ⅲ多肽的分子量低于3.3 kDa,有文献报道分子量在1~3 kDa 的多肽抑菌性强、普适性广,具有良好的抑菌效果[27]。
2.6.2 组分Ⅲ多肽对细菌生长曲线的影响 由图12可知,经组分Ⅲ多肽处理过的4 种菌液中各菌的生长速度均比空白组缓慢,表明组分Ⅲ中的多肽具有抑菌作用。有文献认为分子量为3.3 kDa 左右的多肽类物质具有裂膜抑菌机制,使得细菌生长受到抑制或死亡[27]。
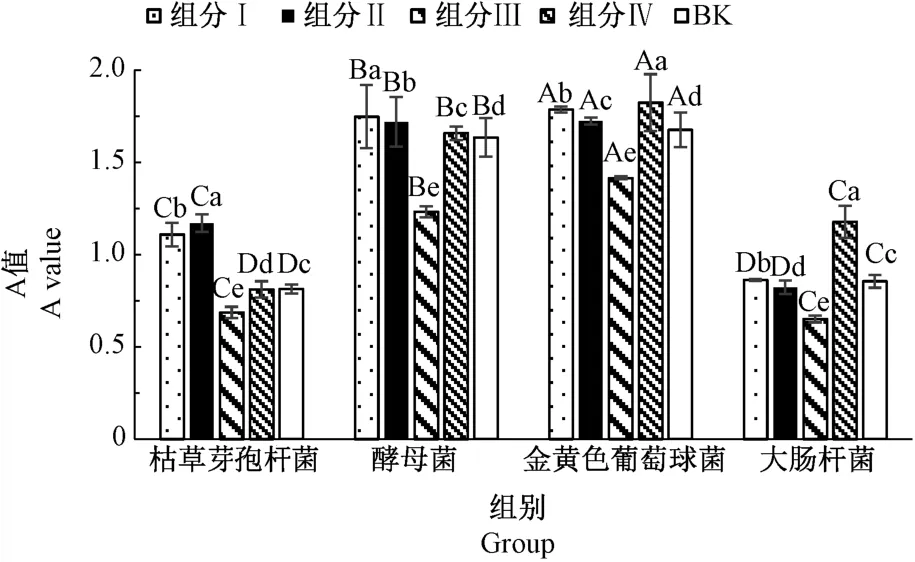
图11 4 组多肽对不同细菌的抑制效果Fig.11 Inhibitory effects of four polypeptide components on different bacteria
3 讨论
小黄鱼边角料经酶解后产生的氨基酸和多肽可赋予产品更好的营养价值,更有利于人体消化吸收利用,丰富的氨基酸可提高产品的鲜味[28],L-氨基酸和多肽在酶解温度下与还原糖发生美拉德反应还能改善产品风味[29]。
本研究发现木瓜蛋白酶和碱性蛋白酶酶解液的氨基酸态氮含量显著高于酸性蛋白酶和未酶解组。木瓜蛋白酶属巯基蛋白酶,可水解蛋白质中精氨酸和赖氨酸的羧基端,并优先水解肽键或蛋白N 端具有2 个羧基的氨基酸或芳香L-氨基酸的肽键[30]。碱性蛋白酶为非特异性内切酶,作用位点多、酶解效率高、还兼具脱腥和改善产品风味的效果,作用于色氨酸、丙氨酸、苯丙氨酸、亮氨酸和异亮氨酸参与形成的多种肽键,碱性蛋白酶酶切位点较多,能较彻底水解底物蛋白,得到的酶解液中多肽分子量较小,且其制备的鱼汤营养成分更容易被吸收。赵琪等[31]比较了5 种蛋白酶对河蚬蛋白的水解效果,发现碱性蛋白酶酶解效果良好;Su等[32]用碱性蛋白酶对黄花鱼内脏进行酶解,发现碱性蛋白酶在酶解水产蛋白方面表现出较强的优势。比较本试验木瓜蛋白酶和碱性蛋白酶对小黄鱼边角料的酶解效果、产品风味以及蛋白酶的性价比,选择碱性蛋白酶作为小黄鱼的酶制剂。
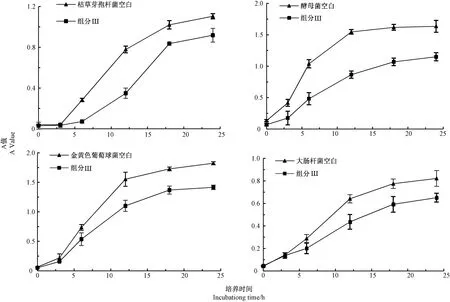
图12 多肽组分Ⅲ对枯草芽孢杆菌、酵母菌、金黄色葡萄球菌、大肠杆菌生长曲线的影响Fig.12 Effect of polypeptide fraction Ⅲon growth curve of Bacillus subtilis,Saccharomyce,Staphylococcus aureus,Escherichia coli
本研究发现当酶解液的固液比(m∶v)为1∶2、按底物蛋白加酶量322 U·g-1、酶解液pH 值11、酶解温度55℃、酶解时间2 h 时,得到的酶解液中氨基酸态氮含量为0.545 2 g·100 g-1。加酶量、酶解时间和酶解液pH 值对小黄鱼边角料的酶解效果均有较大影响,在本试验选择的水平范围内,这些酶解因素之间的交互作用不显著。张群飞等[12]用碱性蛋白酶酶解虾籽也发现酶解温度(45 ~55℃)与时间(3 ~5 h)、酶解温度与pH 值(7 ~8)之间的交互作用不明显;而Cai等[33]用4 种酶对牛骨蛋白进行酶解,发现酶解温度(胃蛋白酶30 ~40℃,碱性蛋白酶40 ~60℃,胰蛋白酶40~60 ℃,中性蛋白酶35 ~55℃)和pH 值(胃蛋白酶1.5~3.5,碱性蛋白酶7.7 ~11.7,胰蛋白6.3 ~10.3,中性蛋白酶5.3~9.3)之间具有显著的交互作用。说明酶解因素之间是否有交互作用可能与各因子的水平选择范围有关。从制备浓缩鱼汤角度综合评价,本研究得到的酶解工艺参数具有水解度高、有效避免苦味肽的产生以及酶解液色泽较浅的优势。
多肽的抗氧化活性与肽段的氨基酸组成序列、相对分子质量和空间构造有关,这些因素又受蛋白及酶种类的影响[34]。本试验结果表明,小黄鱼边角料酶解多肽对·OH 和DPPH 自由基均具有清除作用,且清除率随着酶解液中多肽浓度的增加而增强。酶解液中多肽片段增加,多肽中含有的-COOH、-OH 和-NH2等基团可与Fe2+络合阻断·OH 的生成,也可作为质子给予体与DPPH 自由基结合成稳定的物质达到清除DPPH自由基的作用。
本试验分离得到的4 组多肽,分子量较大(14.4 ~20.1 kDa、5.8 ~7.8 kDa)和分子量较小的多肽对微生物没有抑菌作用,反而有促进微生物生长的作用;但分子量小于3.3 kDa 的多肽组分Ⅲ对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和酵母菌均有抑制作用。陈彤等[35]采用中性蛋白酶对高温变性花生饼粕进行酶解,所得1 ~5 kDa 多肽对大肠杆菌有良好的抑菌效果。说明只有特定分子量的多肽有抑菌性,这是由于特定分子量的肽分子可以插入细胞外膜结构中,使细胞内外联通,细胞内容物泄漏,导致微生物生长受到抑制或死亡。
4 结论
本试验采用酶解工艺处理小黄鱼边角料,结果表明,酶解的最优条件为:采用碱性蛋白酶,固液比(m∶v)1∶2、酶解温度55℃、按底物蛋白酶添加量322 U·g-1、酶解液pH 值11、酶解时间2 h,在此条件下得到的酶解液中氨基酸态氮含量为0.545 2 g·100 g-1。该酶解液对·OH 和DPPH 自由基表现出良好的抗氧化性,且随着酶解液浓度的增加其抗氧化性增强。酶解液经分离纯化得到的4 组多肽,组分Ⅲ多肽对枯草芽孢杆菌、酵母菌、金黄色葡萄球菌、大肠杆菌表现出不同程度的抑菌性能。本研究结果为小黄鱼边角料酶解液开发浓缩鱼汤,实现低值原料的高值化利用提供了数据支持。
