药用植物金银花Dof基因家族的筛选及表达分析
2020-10-09乔永刚王勇飞崔芬芬曹亚萍贺嘉欣贾孟君
乔永刚 陈 亮 王勇飞 崔芬芬 曹亚萍 贺嘉欣 贾孟君 宋 芸
(山西农业大学生命科学学院,山西 太谷 030801)
转录因子(transcription factor),是一类具有特殊结构,能够与真核基因顺式作用元件特异性互作,调控基因表达的蛋白质分子,又称反式作用因子[1-2]。典型的转录因子都具有核定位信号区、DNA 结合结构域、寡聚化位点和转录调控区等[3-4]。DNA 单锌指结合蛋白(DNA-binding one zinc finger,Dof),是一类植物所特有的转录因子,一般含有200 ~400 个氨基酸残基,其N-末端有一个具有52 个碱基、高度保守的C2-C2单锌指结构域,该结构域中高度保守的4 个Cys 残基能够与1 个Zn 共价结合,从而保证Dof 蛋白的活性;其C-末端的转录调控区的氨基酸具有高度的多样性,能够通过与多种蛋白质相互结合,从而激活或抑制下游基因的表达,因此,Dof 蛋白的功能会因C-端氨基酸的差异而表现不同的功能[5-7]。
1993年,Yanagisawa[8]从玉米中鉴定出第一个Dof转录因子命名为ZmDof1 蛋白,ZmDof1 蛋白能够与C4植物的磷酸烯醇式丙酮酸羧化酶基因(PEPC)的启动子区结合,调控植物的光合作用。此外,Yang 等[9]发现ZmDof1 蛋白还可以负调控花粉特异性表达基因Zm401 的表达来控制花粉的发育;Kurai 等[10]将ZmDof1 基因转化至拟南芥中,发现PEPC和PPDK基因被激活表达,且植株的氮含量增多;Qi 等[11]研究表明,ZmDof3 基因在玉米胚乳发育过程中可以调控淀粉和糊粉粒的形成,从而影响玉米的淀粉含量。拟南芥中的Dof 转录因子(OBP1)具有调控细胞分裂过程的作用,它可以缩短拟南芥植物的细胞周期[12]。OBP1还可以与AtDof2.3 共同作用调控CYCD3 蛋白基因的表达,当该基因过量表达时,可以缩短细胞周期,减少细胞的个数,从而引起植株矮化。在拟南芥中过表达GmDof4 和GmDof11 基因时,拟南芥种子中的脂质含量升高,而种子的贮藏蛋白基因CRA1 下调表达[13]。同时,在大豆中过表达GmDof11 基因,提高了大豆种子的含油量,降低了蛋白质的含量,然而对脂肪酸的组成几乎没有影响[14]。Shaw 等[15]研究表明31 个小麦Dof基因中有17 个基因能够响应干旱胁迫,但只有TaDof14 和TaDof15 两个基因上调表达,表明大部分的Dof基因可能负调控植物对干旱胁迫的适应性;TaDof5、TaDof17 和TaDof19 在热胁迫中随着处理时间的延长而下调表达;盐胁迫下,只有TaDof1 在茎中上调表达,其余基本没有明显的变化,TaDof1 可能与抗盐适应性有关。李辉等[16]研究发现,CsDof1 和CsDof2参与了茶树的低温响应;Jung 等[17]和Ma[18]等发现白菜在受到低温和高温环境胁迫时,BraDof基因的表达量会迅速升高。此外,关于Dof基因参与各种生理过程的研究也有很多报道,例如植物的渗透调节[19]、植物生物与非生物胁迫响应[20]、叶片极性的调控[21]以及种质遗传多样性研究[22]等。
金银花(Lonicera japonicaThunb.)属忍冬科植物,其干燥花蕾是重要的传统中药材,具有清热解毒的功效。Dof基因在植物的生长发育及逆境胁迫响应过程中起着重要的作用,但是目前鲜见关于金银花Dof基因家族相关研究的报道。本研究从金银花转录组测序数据中分离得到Dof基因,并对其理化性质、亚细胞定位、同源比对、Motif、系统进化和表达模式进行了深入分析,以期为进一步研究金银花Dof 转录因子在低温胁迫响应过程中的功能提供参考依据。
1 材料与方法
1.1 金银花Dof 基因家族的筛选及序列分析
金银花的数据来源于山西农业大学生科院药用植物遗传育种实验室的转录组测序数据。测序数据来源于4℃低温胁迫下0、3、12 和48 h 叶片转录组测序结果。拟南芥和水稻的Dof 转录因子蛋白序列来源于PlantTFDB 转录因子数据库。利用BioEdit 在金银花转录组测序数据库中搜索金银花中潜在的Dof基因,筛选的E 值为e-5。利用SMART 和Pfam验证Dof基因的保守结构域,CDD 筛选并剔除不完整的金银花Dof基因。利用在线Expasy 生物信息学工具对其进行理化性质分析。
1.2 金银花Dof 家族蛋白亚细胞定位预测
对筛选出的Dof 家族蛋白序列,利用CELLO v.2.5(http:/ /cello.life.nctu.edu.tw/)进行亚细胞定位预测分析。
1.3 金银花Dof 家族蛋白同源比对及保守结构域(Motif)分析
利用DNAMAN 8.0 对金银花、拟南芥和水稻的Dof 蛋白序列金银同源比对,并用MEME(http:/ /meme-suite.org/tools/meme)在线工具对Dof 家族蛋白进行Motif 预测,TBtools 对Dof 蛋白潜在的保守结构进行绘制。
1.4 金银花Dof 家族蛋白的系统进化分析
利用MEGA7 软件中的Muscle 对筛选出的完整的Dof 家族蛋白序列进行多序列比对,基于邻近法(Neighbor-Joining,NJ)构建系统发育树,每个计算点计算1 000 次,将得到的系统发育树通过iTOL 进行美化处理得到矢量图。
1.5 金银花Dof 基因在低温下的表达特征分析
以筛选的ACT2/7 和c49672.graph_c0 为内参基因进行实时荧光定量PCR(PCR 程序及引物信息见表1和表2)。采用2-△△ct法计算基因的表达量,利用R 语言绘制基因表达热图。

表1 RT-qPCR 反应程序Table1 RT-qPCR protocol
2 结果与分析
2.1 金银花Dof 基因家族蛋白理化性质分析
以拟南芥和水稻Dof 蛋白为探针序列,通过本地BLAST 共筛选出25 个Dof基因,经SMART、Pfam 及CDD 验证和鉴定后共得到11 条具有完整Dof基因结构的序列。利用Expasy 对筛选出11 个具有完整C2-C2锌指结构的转录因子进行理化性质进行分析。由表3可知,11 条具有完整Dof基因编码的蛋白大小有所差异,氨基酸个数为157~492;理论等电点为5.45~9.48,表明不同的Dof 蛋白在不同的微环境中发挥不同的生物学功能;脂肪系数为42.36~68.29,不稳定指数均高于40,平均亲疏水性(grand average of hydropathy,GRAVY)均小于0,表明所有的Dof 蛋白均属于不稳定亲水性蛋白。

表2 候选内参基因引物信息Table2 Information of candidate reference gene

表3 金银花Dof 基因家族Table3 Dof gene family of Lonicera japonica Thunb.
2.2 金银花Dof 蛋白家族基因亚细胞定位预测
利用CELLO v.2.5 对金银花Dof 蛋白家族基因进行亚细胞定位预测。由表4可知,所有的Dof 蛋白都定位在细胞核,说明其作为转录因子能够调控下游基因的表达[23]。而LjDof2 蛋白在细胞质中有定位到,LjDof7 蛋白在细胞膜外也有定位,说明不同金银花Dof家族成员在低温环境下,不同细胞器发挥的功能有所差异。

表4 金银花Dof 蛋白亚细胞定位Table4 Protein subcellular localization of Lonicera japonia Thunb. Dof protein
2.3 金银花Dof 蛋白保守结构域分析
通过DNAMAN 对筛选的金银花Dof 蛋白进行序列比对,提取其保守结构域进行分析,由图1可知,Dof蛋白结构域非常保守,都具有C2-C2锌指结构,说明Dof基因在进化过程中具有一定的保守性。
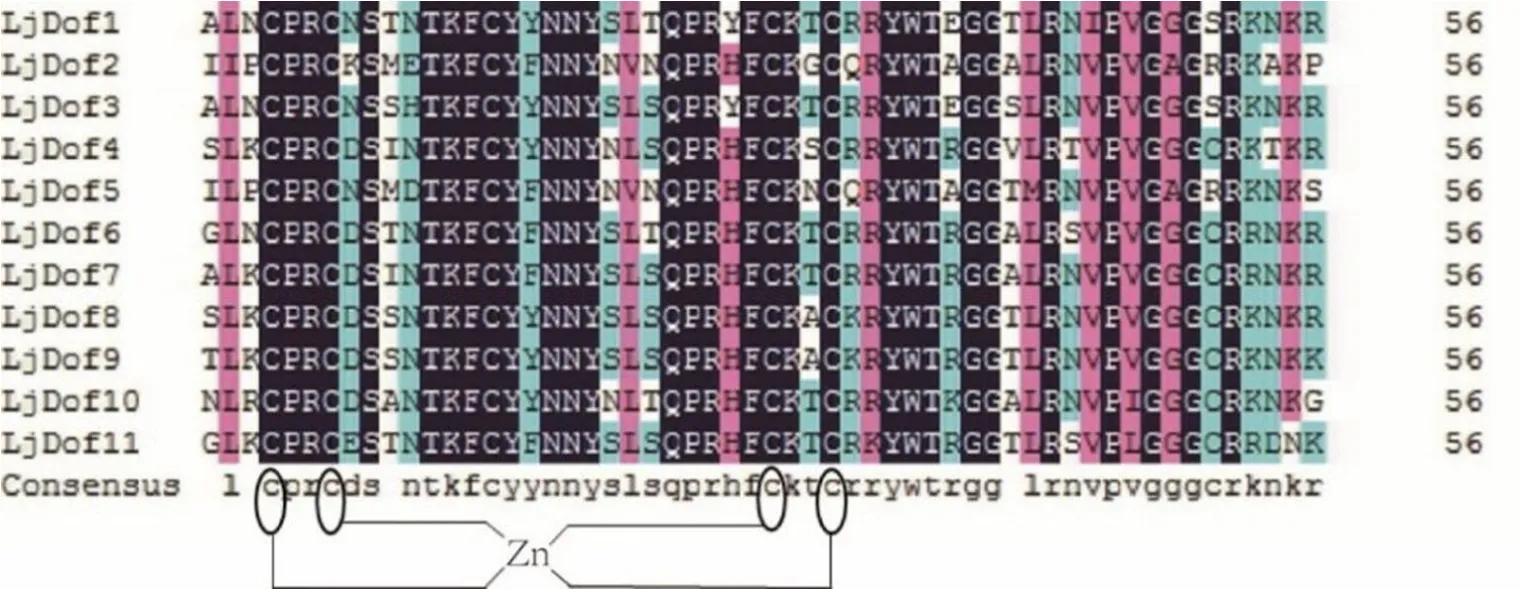
图1 金银花Dof 蛋白保守结构域分析Fig.1 Conservative domain analysis of Lonicera japonia Thunb. Dof protein
2.4 金银花Dof 蛋白Motif 分析
通过MEME 对拟南芥、水稻和金银花的Dof 蛋白进行Motif 分析,选用了8 个Motif,结果见图2和图3。所有的Dof 蛋白都具有Motif1,即Motif1 为所有Dof 蛋白的核心序列。此外,不同的Dof 蛋白具有不同数目和类型的Motif,可能不同的Dof 蛋白在生物体内发挥的功能也有所不同。
2.5 Dof 家族蛋白的系统进化分析
运用MEGA7 软件对筛选的金银花11 个Dof 转录因子和拟南芥、水稻的Dof 转录因子进行序列同源比对,并参照Moreno-Risuerno 等[23]的方法构建系统进化树(图4)。结果表明,金银花中没有A 和B 类的Dof 转录因子,LjDof1 和LjDof3 属于C 类,LjDof8 和LjDof9 属于D 类,LjDof6、LjDof7 和LjDof11 属于E 类,且这7 个Dof 转录因子与拟南芥的同源性较高;LjDof4和LjDof10 属于F 类,LjDof2 和LjDof5 属于G 类,它们与水稻的同源性较高。
2.6 金银花Dof 基因家族在低温胁迫下的表达分析

图3 Dof 蛋白中的保守基序Fig.3 Conserved motif in Dof protein
利用金银花低温胁迫不同时间下的RNA-Seq 转录组测序数据,找到候选的11 个Dof基因在不同时期的基因表达量的FPKM值,对其取对数值进行均一化处理并利用R 语言绘制相应的热图(图5)。结果显示,11 个Dof基因在低温下的表达模式分为三类:第一类LjDof2 和LjDof7 在整个低温过程中先下调后上调表达;第二类为LjDof1、LjDof5、LjDof4 和LjDof11 呈现先持续上调后下调表达;LjDof3、LjDof6、LjDof8、LjDof9 和LjDof10 与第二类表达模式相同,但在后期其表达量低于0 h。
基于转录组测序结果得到的Dof基因的表达模式,第一类Dof 转录因子在低温12 h 后表达量急剧升高;第二类Dof 转录因子在低温胁迫3 h 和12 h 高量表达,低温胁迫12 h 后表达下调,但是其在低温胁迫48 h 的表达量仍高于0 h;而第三类Dof 转录因子与第二类表达模式相似,但是其在低温胁迫48 h 的表达量低于0 h,利用RT-qPCR 对其进行验证,结果见图6。定量结果几乎与转录组结果相对应,从而验证了转录组数据的可靠性。但是也存在差异,LjDof7 的表达模式与转录组结果呈现相反的表达情况,说明转录组测序结果与实际的基因表达情况也可能存在差异。通过RT-qPCR 验证结合其表达模式,推测LjDof2、LjDof4、LjDof5、LjDof7 和LjDof11 可能参与了金银花对低温的响应。

图4 Dof 蛋白家族系统进化分析Fig.4 Phylogenetic analysis of Dof protein family
3 讨论
研究表明,Dof基因参与植物的光合作用、渗透调节、叶片的极性以及胁迫响应等[24]。近年来,随着测序技术的发展,越来越多物种的全基因组测序已经完成,Dof 转录因子在许多模式植物中得到了鉴定和分离,不同物种的Dof基因数目差异较大,大豆[25]、大白菜[17]、玉米[26]、拟南芥[27]、水稻[27]和火炬松[23]分别鉴定得到Dof基因78、76、54、36、30 和8 个,但是,关于金银花Dof 转录因子家族的功能研究鲜见报道,基于二代测序技术,研究金银花Dof 转录因子家族成为一种可能。
本研究基于金银花转录组测序,共筛选了11 个Dof候选基因,对其结构域和Motif 分析发现,其均包含完整的C2-C2单锌指结构,这与蔡晓锋等[28]和张雪等[24]的研究结果一致,说明Dof 转录因子家族在物种进化过程中较为保守。系统及进化发育分析结果显示,金银花中的Dof 转录因子家族拟南芥和水稻有所差异,没有A 和B 类的Dof 转录因子。对筛选的11 个LjDof基因在低温胁迫不同时期下的表达模式进行分析,发现11 个LjDof基因在低温下的表达模式分为三类:第一类Dof 转录因子可能在金银花对低温的适应过程中起着重要的调控作用,这类Dof基因的表达模式 与GmDof2、GmDof4、GmDof5、GmDof6、GmDof16、GmDof18 和GmDof19 在高温胁迫下的表达情况一致[29];第二类Dof 转录因子可能在低温初期植物应对外界环境的信号转导过程中起关键作用,这类转录因子与GmDof1、GmDof2、GmDof3 和GmDof10 在应对低温的表达情况一致[29];而第三类Dof 转录因子与第二类表达模式相似,但是其在低温胁迫后期对低温的响应减弱,可能在后期表达受到抑制。而RT-qPCR 结果显示,这些基因在植物中的表达模式与转录组的表达模式基本一致。综合转录组和定量结果,推测LjDof2、LjDof4、LjDof5、LjDof7 和LjDof11 基因可能在植物对低温的持续适应过程中起着关键调控作用。
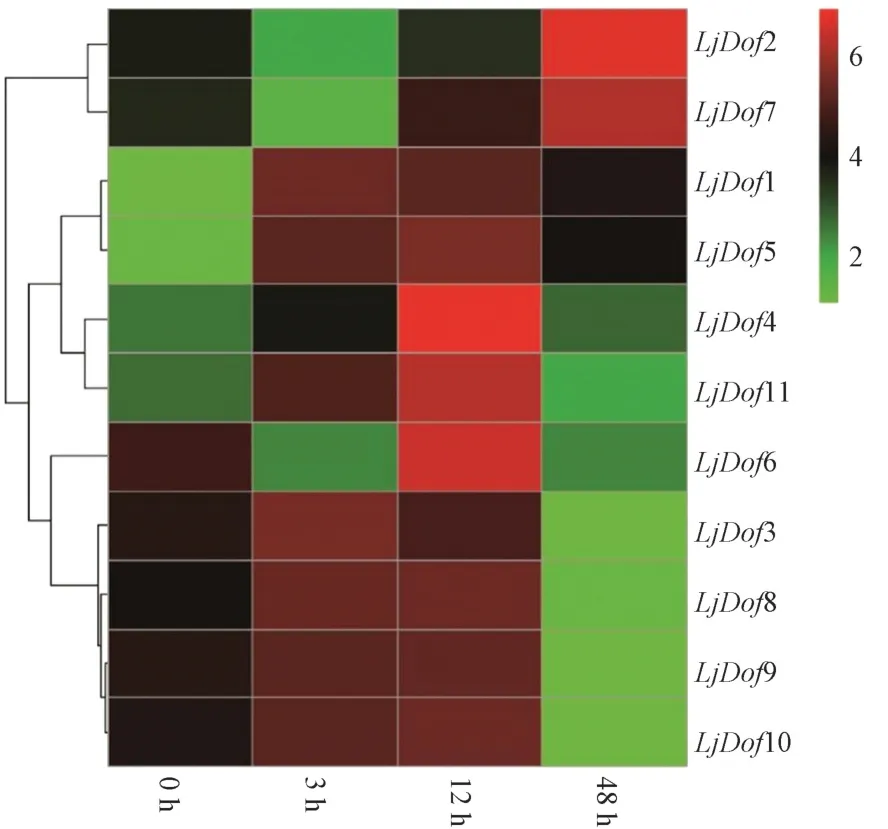
图5 低温胁迫下金银花Dof 基因的表达模式Fig.5 Expression model of Dof gene in Lonicera japonica Thunb. under low temperature stress
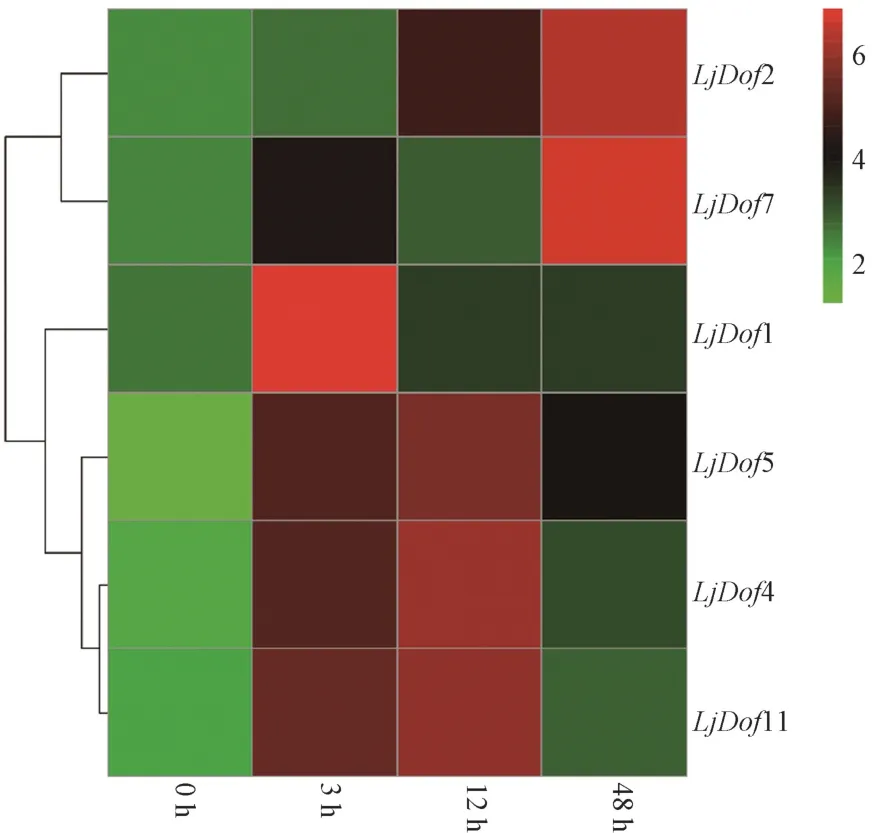
图6 低温胁迫下金银花Dof 基因的表达水平Fig.6 Expression level of Dof gene in Lonicera japonica Thunb. under low temperature stress
4 结论
本研究基于转录组测序共筛选了11 个具有完整C2-C2单锌指结构的Dof基因序列。系统进化发育分析结果显示,金银花中的Dof基因分为5 类,但是未包含拟南芥所有类型的Dof基因,表明金银花Dof 转录因子在进化过程中存在基因的缺失现象。对筛选的11 个Dof基因在低温胁迫不同时期下的表达模式及实时荧光定量PCR 分析,发现LjDof2、LjDof4、LjDof5、LjDof7 和LjDof11 可能在金银花对低温的适应过程中发挥关键作用。本研究为进一步研究金银花Dof 转录因子的功能提供了理论基础,后续可以通过分子生物学和转基因等相关试验进一步验证该基因对植物在低温胁迫下的调控,辅助探究金银花对低温的适应机制。
