杂交兰尿卟啉原脱羧酶基因的克隆及其表达分析
2020-10-09林榕燕吴建设叶秀仙钟淮钦黄敏玲
林榕燕 吴建设 林 兵 叶秀仙 钟淮钦 黄敏玲
(福建省农业科学院作物研究所/福建省农业科学院花卉研究中心/福建省特色花卉工程技术研究中心,福建 福州 350013)
杂交兰 (Cymbidiumhybrid) 属于兰科(Orchidaceae)兰属(Cymbidium Sw.),其花色艳丽、株系整齐、花香淡雅,具有较高的观赏价值,是兰花市场中极具发展潜力的兰花种类[1-2]。在兰花长期栽培驯化过程中产生芽变,其叶片在不同位置变异成不同色斑,如条纹叶、透明叶、黄叶或斑点叶等,称之为线艺或叶艺;叶艺品种观叶胜观花,观赏和经济价值成倍增长,兰花叶艺新品种的选育越来越受到人们的重视[3-5]。当前,叶艺兰品种的选育主要通过组培过程中的芽变、体细胞无性繁殖的自然突变和人工诱变等途径获得,但这些方法具有不确定性,且工作量大、耗时长,导致叶艺兰的育种效率低[6]。因此,通过揭示杂交兰叶色变异(叶艺形成)的机理,并结合现代分子育种等手段进行定向选育,将对其产业的可持续发展具有重要的理论和实践意义。
对一些模式植物(如水稻和拟南芥)叶色突变体的研究表明,叶色变异主要是源于调控叶绿素生物合成与分解代谢、血红素代谢以及叶绿体发育与形成等相关基因的突变,参与这些代谢过程的基因有很多,其中任意一个基因发生突变都可能导致植物的叶色发生变 异[7-11]。尿卟啉原脱羧酶(uroporphyrinogen decarboxylase,UROD) 在植物中催化尿卟啉原Ⅲ(Urogen Ⅲ)脱羧产生粪卟啉原Ⅲ(Coprogen Ⅲ),是叶绿素、光敏色素和血红素分支合成中的关键酶[12],其活性改变可能会使尿卟啉大量富集,甚至导致细胞死亡[13]。研究发现烟草中只有1 种UROD,由核基因编码,含有叶绿体导肽,反义抑制UROD 会导致叶绿素合成减少[14];而玉米、拟南芥和水稻中存在2 个UROD 编码基因,且二者的表达受到光、昼夜节律以及植物氮代谢调节,其在合成叶绿素方面起重要作用[15-16]。有关UROD基因在兰科植物中的研究报道较少,石闪闪[13]通过DNA 直接测序法在墨兰达摩中得到UROD基因,并推测该基因在墨兰中主要参与叶绿素的合成。杂交兰UROD基因的研究更是鲜见报道。
鉴于UROD基因在植物叶绿素合成中的重要性,揭示该基因在杂交兰叶色调控中的分子机制,将对杂交兰叶艺品系的选育具有重要意义。本研究以自主选育的杂交兰叶艺品系爪艺紫妍氏K21-1 及其亲本紫妍氏K21 的叶片为材料,在转录组分析发现UROD基因在供试材料中存在差异表达的前期研究基础上,克隆UROD基因,初步分析该基因及编码蛋白质的序列特征,检测不同材料不同组织中基因的表达情况,并对叶绿素含量、叶绿素前体物质含量及关键酶浓度等生理指标进行测定,旨在为后续杂交兰UROD基因的功能验证及杂交兰的叶艺形成机制研究奠定基础。
1 材料与方法
1.1 试验材料
以杂交兰紫妍氏(K21,叶片绿色)和爪艺紫妍氏(K21-1,叶片绿色浅黄边)的叶片为材料进行UROD基因的克隆,以及叶绿素含量、Urogen Ⅲ含量、Coprogen Ⅲ含量和关键酶浓度的测定;以K21 的根、茎、叶为材料,进行UROD基因的表达分析。
1.2 试验方法
1.2.1 杂交兰总RNA 提取及cDNA 第一链合成 取K21 的根、茎、叶及K21-1 的绿叶区和黄叶区叶片各0.1 g,研磨后,参照林榕燕等[17]的方法,使用通用植物总RNA 提取试剂盒(北京百泰克生物技术有限公司),按说明书提取总RNA;检测合格后的RNA 用于cDNA 第一链的合成,具体步骤参照PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit 试剂盒[宝生物工程(大连)有限公司]说明书。
1.2.2 杂交兰UROD基因序列克隆 在转录组测序的基础上,根据预测UROD序列,设计一对引物UROD-F:5′-ATGGGGAGCATTTCTTACAACG-3′和UROD-R:5′-TCAAGAAGATAAATTGCGGTACCTG-3′用于PCR 扩增。扩增体系为50 μL,包含2×PCR buffer for KOD FX Neo 25 μL,1 U·μL-1KOD FX Neo 1 μL,2 mmol·L-1dNTP 10 μL,上、下游引物各1.5 μL,模板cDNA 1 μL,ddH2O 10 μL。PCR 扩增程序:94℃预变性2 min;98℃变性10 s,50℃退火30 s,68℃延伸90 s,30 个循环;68℃终延伸7 min。将回收的目的片段连接载体,经转化、菌液PCR 检测后,挑选阳性克隆送至铂尚生物技术(上海)有限公司进行测序。
1.2.3 生物信息学分析 参照林榕燕等[18]的报道,利用在线生物信息学分析软件 ExPASy、WoLF PSORT、SOPMA,对UROD 蛋白质的理化性质、亚细胞定位、二级结构等进行分析;并通过DNAMAN 软件和MEGA5.0 软件进行序列多重比对分析及系统进化树构建。
1.2.4UROD基因的表达分析 以K21 的根、茎、叶及K21-1 的绿叶区和黄叶区叶片cDNA 为模板,Actin(引物序列分别为Actin-F:5′-GGGTGCTTATGTTGGTG ATG-3′和Actin-R:5′-TTCAGAGGGGCTTCAGTAAGG-3′)为内参基因,利用引物ChUROD-RT-F:5′-TGGAGC TCAAGCTGTTCAGA-3′和ChUROD-RT-R:5′-TGCGTC TTCTTTACGGAGGT-3′,按照SYBR Premix Ex TaqTM试剂盒[宝生物工程(大连)有限公司]操作说明,在7500 Real-Time PCR System 仪(美国ABI 公司)上进行PCR 扩增,检测ChUROD基因在各个模板中的表达水平。每个试验设置3 个生物学重复,相对定量分析采用比较Ct 法,目的基因的相对表达量为2-△△Ct。
1.2.5 杂交兰叶绿素含量、Urogen Ⅲ含量、CoprogenⅢ含量及关键酶浓度测定 参照谢泰祥等[19]的方法,并做适当修改,对K21 叶片和K21-1 叶片中黄叶区和绿叶区叶片的叶绿素a 和叶绿素b 含量进行测定。参照毛晶晶等[20]的方法,略作修改,对供试材料的Urogen Ⅲ含量和Coprogen Ⅲ含量进行测定。UROD浓度的测定采用双抗体夹心法,操作步骤参照植物UROD 酶联免疫分析试剂盒(上海晶抗生物工程有限公司)说明书。
2 结果与分析
2.1 杂交兰UROD 基因的克隆
以杂交兰K21 叶片及K21-1 黄叶区和绿叶区叶片的cDNA 为模板进行PCR 扩增,得到3 条约1 200 bp 的条带(图1),将测序结果进行比对后,获得一段完全一致的UROD基因序列,该基因开放阅读框(open reading frame,ORF)序列长1 191 bp,命名为ChUROD,GenBank 登录号为MN640068。
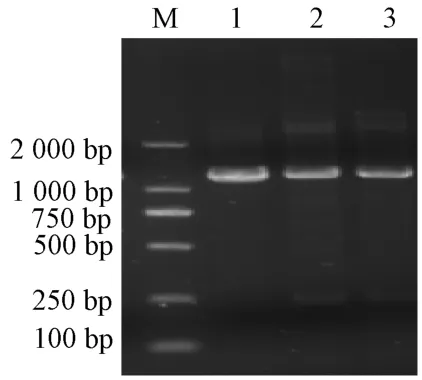
图1 杂交兰UROD 基因的克隆Fig.1 Cloning of UROD gene in Cymbidium hybrid
2.2 ChUROD 基因序列的生物信息学分析
经软件分析,ChUROD编码氨基酸的个数为396 个,其编码蛋白质的理论分子量为43. 78 kD,等电点为6. 42,蛋白质不稳定系数为43. 38,平均亲疏水性(grand average of hydropathy,GRAVY)为负值,说明ChUROD 为不稳定亲水性蛋白质。该蛋白质含有一个典型的尿卟啉原脱羧酶结构域(53 ~394 aa),属于URO-D_CIMS_like家族。此外,ChUROD 蛋白质不具有跨膜结构,定位于叶绿体的可能性最大。其二级结构中,α-螺旋、无规则卷曲、延伸链和β-转角所占比例依次为45. 71%、32. 32%、15. 66%和6. 31%。
2.3 ChUROD 蛋白序列比对与进化分析
根据NCBI 在线BLAST 比对结果显示,ChUROD蛋白序列与其他植物的相似性均较高,与墨兰(Cymbidium sinense,AUY61989.1)的相似性最高,为98.61%,其他依次为:与桃红蝴蝶兰(Phalaenopsis equestris,XP_020595834.1)的相似性为88.61%,与葡萄(Vitis vinifera,XP_002274385.2) 的相似性为85.75%、与苹果(Malus domestica,QDF44777.1)的相似性为85.55%、与白梨(Pyrus x bretschneideri,XP_009369263.1)的相似性为85.08%,与海枣(Phoenix dactylifera,XP_008782632.1)的相似性为84.37%,与菠萝(Ananas comosus,OAY79965.1) 的相似性为83.87%。将ChUROD 蛋白序列与其他9 种植物UROD 进行序列比对分析,发现这些植物的UROD 之间具有较高的一致性,达86.37%(图2)。
对ChUROD 系统进化分析表明(图3),所选蛋白可分为两大组,一组为单子叶植物蛋白,一组为双子叶植物蛋白。其中,杂交兰ChUROD 蛋白位于单子叶植物蛋白组,与墨兰亲缘关系最近;与同属兰科的桃红蝴蝶兰和铁皮石斛(Dendrobium catenatum)的进化距离也较近;与双子叶植物蛋白组的枣(Ziziphus jujuba)、栓皮栎(Quercus suber)亲缘关系较远。
2.4 杂交兰ChUROD 基因相对定量表达分析
为了研究ChUROD基因在杂交兰不同组织中的差异,以K21 根、茎、叶的cDNA 为模板,以杂交兰Action基因为内参,通过实时荧光定量 PCR(quantitative real-time PCR,qRT-PCR)分析ChUROD基因的表达情况(图4)。结果表明,ChUROD基因在不同组织中均有表达,叶中的基因相对表达量显著高于根和茎,叶中的相对表达量是根中的21 倍,是茎中的13 倍。
此外,比较了ChUROD基因在K21 叶片及K21-1黄叶区和绿叶区叶片中的表达量。由图5可知,ChUROD基因的相对表达量在K21 绿色叶片中最高,显著高于K21-1 叶片中该基因的相对表达量;且在K21-1 叶片中,黄叶区中ChUROD基因的相对表达量高于绿叶区,但无显著性差异。
2.5 杂交兰UROD酶浓度、Urogen Ⅲ含量、CoprogenⅢ含量及叶绿素含量比较
由图6可知,UROD 酶浓度在K21 绿色叶片和K21-1 黄叶区叶片中显著高于K21-1 绿叶区叶片,总体表现为K21 绿色叶片>K21-1 黄叶区色叶片>K21-1 绿叶区色叶片。
由图7可知,UrogenⅢ相对含量在K21 绿色叶片、K21-1 黄叶区和绿叶区叶片中呈显著性差异,表现为K21-1 黄叶区叶片>K21-1 绿叶区叶片>K21 绿色叶片。而CoprogenⅢ含量在K21 绿色叶片中显著高于K21-1 绿叶区和K21-1 黄叶区叶片,表现为K21 绿叶片>K21-1 绿叶区叶片>K21-1 黄叶区叶片。
由图8可知,在供试材料中,叶绿素a 和叶绿素b 含量均呈现显著性差异,且具有相同的分布趋势,均表现为K21 绿色叶片> K21-1 绿叶区叶片> K21-1 黄叶区叶片。进一步比较了不同叶片中叶绿素a(chla)/叶绿素b(chlb)值,发现K21-1 黄叶区叶片中chla/b 值显著低于K21 绿色叶片和K21-1 绿叶区叶片。
3 讨论
UROD基因作为卟啉类化合物分支合成酶的第一个基因,在代谢调节中起重要作用,对于动植物的生长发育都是必需的[21-23]。目前,在包括人类、大麦、烟草、拟南芥等许多动植物中均已克隆到了UROD基因,烟草UROD基因编码一个约43 kD 的含叶绿体导肽的蛋白前体,UROD 需转运到叶绿体中发挥作用,它的表达受光诱导,UROD基因突变会导致植物叶片受损[14];小麦和黄瓜的UROD基因表达受光和热的影响,在热应激条件下,该基因在植物的绿化过程中起到重要的作用[24]。本研究在杂交兰紫妍氏K21 及其叶艺品系爪艺紫妍氏K21-1 叶片中克隆获得了UROD基因,该基因序列与其他植物UROD基因序列相似较高;系统进化树分析发现,杂交兰与同属兰科的墨兰亲缘关系最近,但与双子叶植物白梨、苹果等的UROD亲缘关系较远,说明UROD 分布具有种属特异性。保守结构域分析发现,杂交兰ChUROD 蛋白质属于URO-D- CIMS - like 家族。qRT-PCR 结果表明,ChUROD基因在叶片中的相对表达量最高是根和茎的21 倍和13 倍,与在墨兰[13]中的表达情况一致;本试验还检测了ChUROD基因在不同品种叶片中的表达情况,发现ChUROD基因在K21 中的表达量显著高于K21-1;推测该基因在杂交兰中主要参与叶绿素的合成。
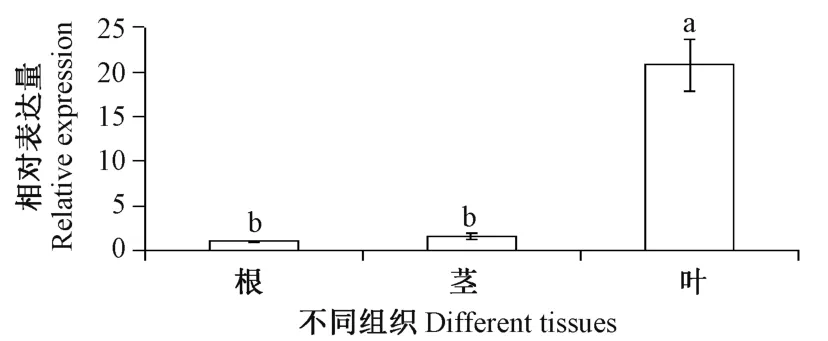
图4 杂交兰不同组织中ChUROD 基因的相对表达量Fig.4 Relative expression levels of ChUROD in different tissues of Cymbidium hybrid
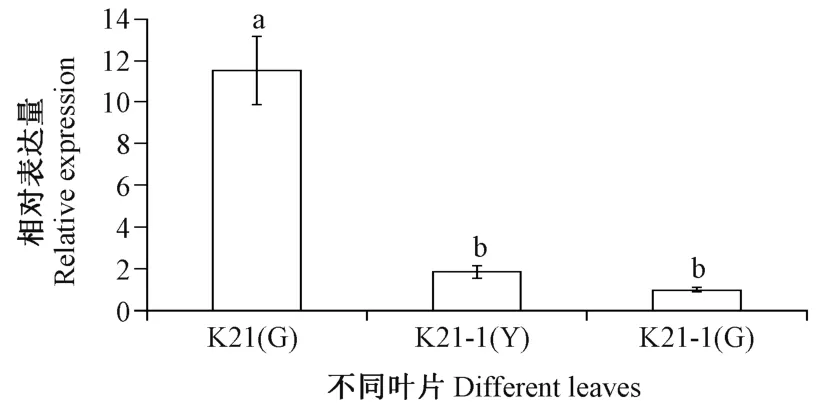
图5 杂交兰不同叶片中ChUROD 基因的相对表达量Fig.5 Relative expression levels of ChUROD in different leaves of Cymbidium hybrid
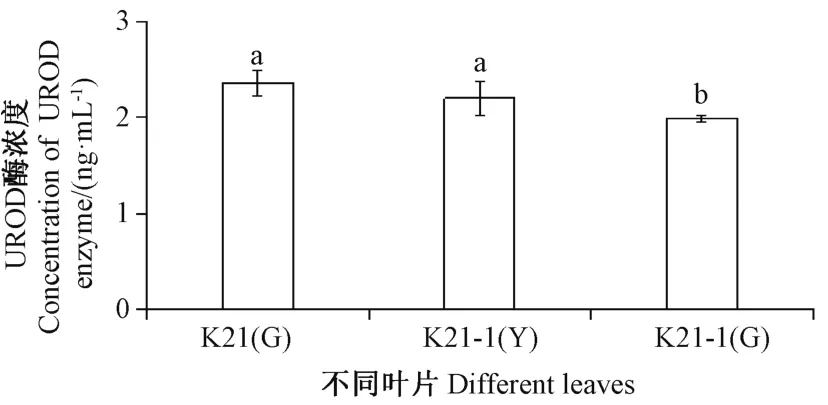
图6 杂交兰不同叶片中UROD 酶浓度Fig.6 Concentration of UROD enzyme in different leaves of in Cymbidium hybrid
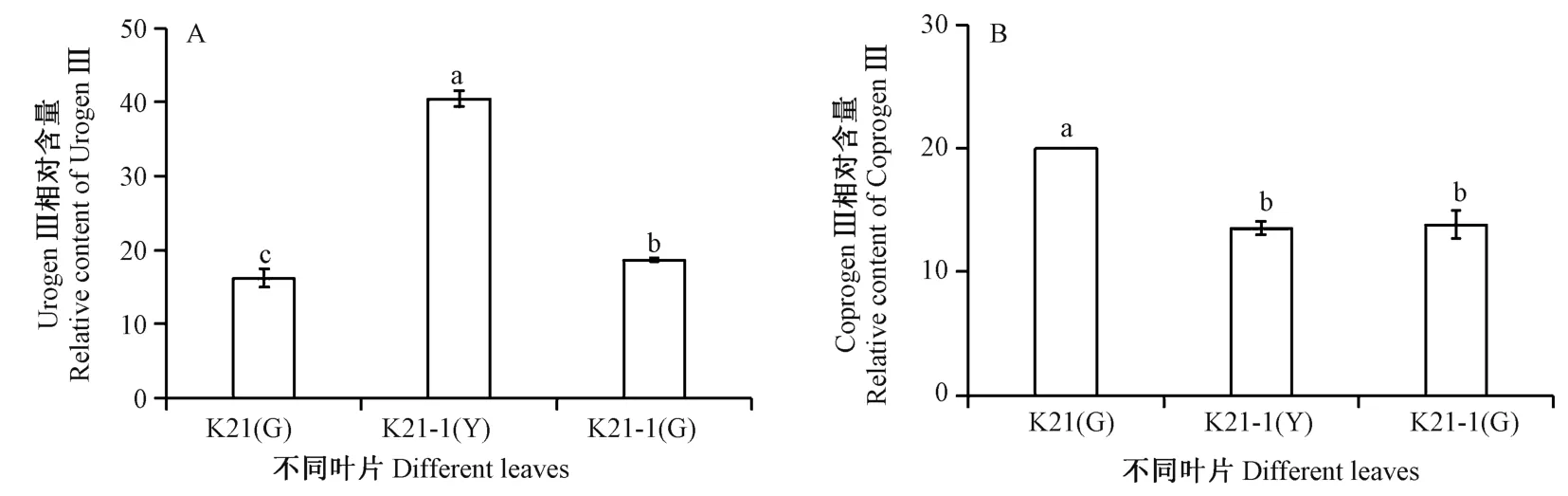
图7 杂交兰不同叶片中UrogenⅢ(A)和CoprogenⅢ(B)含量Fig.7 Contents of UrogenⅢ(A) and CoprogenⅢ(B) in different leaves of Cymbidium hybrid
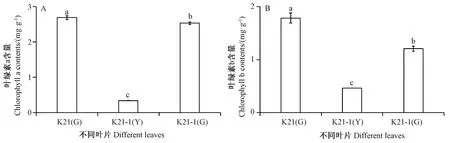
图8 杂交兰不同叶片中叶绿素a(A)和叶绿素b(B)含量Fig.8 Contents of chlorophyll a (A) and chlorophyll b (B) in different leaves of Cymbidium hybrid
在玉米黄化突变体[25]、黄瓜黄绿叶突变体C777[26]及墨兰达摩叶艺品系[27]叶片中光合色素含量均低于其相应的野生型,但类胡萝卜素/总叶绿素显著高于野生型,由此推测这类突变体为总叶绿素缺乏型突变[25];相较于野生型,孕穗期的水稻白条纹叶突变体wsl1 叶片中叶绿素b 含量极显著下降,叶绿素a 和类胡萝卜素含量则无明显差异[28],说明不同物种叶色突变体中,光合色素含量、比例等变化趋势不同。花叶矢竹叶色变异机理研究报道中,推测白叶和条纹白叶中原卟啉Ⅸ(ProtoⅨ)至叶绿素a 过程发生障碍[6];甜瓜叶色黄化突变体在胆色素原(porphobilinogen,PBG)与UrogenⅢ的反应步骤受阻[29];文心兰黄绿条纹突变体Y4 在ProtoⅨ到镁原卟啉Ⅸ(Mg-ProtoⅨ)的位点受阻;完全黄化突变体(Y7 ~Y10)和黄绿条纹突变体(Y2、Y3、Y5 和Y6)在CoprogenⅢ到ProtoⅨ的位点受阻[30];说明不同植物叶色突变体叶绿素合成代谢受限步骤存在差异。因此,本研究进一步对UROD 酶浓度、UrogenⅢ含量、CoprogenⅢ含量、叶绿素a 和叶绿素b 含量进行测定,结果发现UROD 酶浓度在品种间的分布趋势与ChUROD基因的表达量相似,在K21 绿色叶片中表现为高水平,在K21-1 叶片中的含量相对较低;在K21 叶片中,UROD 酶催化UrogenⅢ脱羧产生CoprogenⅢ,但在K21-1 叶片中,UrogenⅢ脱羧产生CoprogenⅢ的过程受阻,特别是导致黄叶区中UrogenⅢ大量积累。在K21-1 黄叶区叶片叶绿素a 和叶绿素b 的含量明显低于K21 绿色叶片和K21-1 绿叶区叶片,说明在黄叶区叶片中叶绿素的合成同样受阻;同时,在K21-1 黄叶区叶片中Chla/b 显著低于绿叶区叶片,与文心兰黄绿条纹突变体Y4[30]的研究结果一致,推测叶艺品种K21-1 属于叶绿素a 缺乏型突变。该叶艺品种叶艺形成的原因主要是叶绿素合成受阻,受阻位点可能在由UrogenⅢ脱羧产生Coprogen Ⅲ及之后的步骤,说明ChUROD基因可能和其他基因协调作用,在杂交兰叶艺形成中起重要作用。
目前有关叶色变异的研究多集中于模式植物拟南芥和水稻,而兰科植物叶艺形成机制的研究还较滞后。本研究获得了杂交兰ChUROD基因序列,对其编码蛋白的结构特征、基因表达模式、相关生理指标进行分析,为今后ChUROD的功能验证提供了基因资源,也为进一步研究杂交兰叶艺形成机制提供了重要线索。
4 结论
本研究在杂交兰紫妍氏K21 及其叶艺品系爪艺紫研氏K21-1 叶片中克隆获得了ChUROD基因,ChUROD基因ORF 序列长1 191 bp,编码396 个氨基酸。ChUROD基因在叶中表达量最高,且在K21 叶片中的表达量高于K21-1。此外,K21-1 黄叶区叶片的UROD 酶浓度、CoprogenⅢ含量及叶绿素含量均低于K21 叶片,但UrogenⅢ含量却显著高于K21 叶片,推测叶艺品系K21-1 的叶绿素合成在由UrogenⅢ脱羧产生CoprogenⅢ及之后的步骤中受阻,ChUROD基因可能与其他基因协调作用,在叶艺形成过程中发挥重要作用。本研究为进一步探讨ChUROD基因在杂交兰中的作用机制奠定了基础。
