塞内卡病毒A间接ELISA检测方法的建立及应用
2020-09-29王彩霞范燕茹冯春燕吴绍强林祥梅
王彩霞,张 舟,范燕茹,冯春燕,吴绍强,林祥梅
(1.中国检验检疫科学研究院动物检疫研究所,北京 大兴 100176;2.河南城建学院生命科学与工程学院,河南 平顶山 467036)
2002年,研究人员发现了一种名为塞内卡谷病毒(Seneca valley virus,SVV)的新病毒,将其归类为一个新的病毒属,其唯一的代表株是塞内卡病毒A(Senecavirus A,SVA)[1]。SVA感染后可引起猪鼻镜及蹄冠等处出现水疱、溃烂创面,偶见发烧及腹泻,可导致新生仔猪发生急性死亡,给养猪业带来巨大经济损失[2]。截止到目前为止,美国、加拿大、中国、巴西、哥伦比亚、泰国等多个国家已经报道了多起SVA感染猪的病例[3-7],这引起了国内外众多研究者的重视。目前,国内外已经建立了多种针对SVA的检测方法,例如RT-PCR检测方法[8]、荧光定量PCR方法[9]、原位杂交检测方法[10]、反转录重组聚合酶常温扩增技术(RT-RPA)快速检测方法[11]、ELISA检测方法[12]等。其中ELISA方法因其原理简单,操作简便,灵敏,快速,适用性广泛,成为血清学诊断技术中的常用技术手段,但筛选一个理想的检测抗原是ELISA方法研究中的重中之重。本研究将VP2和VP3全长基因克隆到表达载体上,诱导表达为一个组合重组蛋白,暂记为VP2/3,通过优化反应条件建立了针对VP2/3蛋白的间接ELISA方法,并进一步利用该ELISA方法检测人工感染SVA后不同时间采集的猪血清样品,绘制了猪体感染SVA后VP2/3蛋白抗体的消长规律,以便为后续相关疫苗免疫程序的制定提供理论依据。
1 材料与方法
1.1 材料 SVA分离株GD01/2017(GenBank登录号:MH316114)由扬州大学兽医学院江苏省动物预防医学重点实验室惠赠。猪口蹄疫、猪繁殖与呼吸综合征、猪圆环病毒2型、猪伪狂犬病等阳性血清本实验室保存。载体pET30a(+)、感受态DH5α和BL21 (DE3),由中国检验检疫科学研究院动物检疫研究所实验室保存。
1.2 主要试剂 DL-2 000 DNA Marker、pMD 18-T载体、低分子蛋白Marker、T4 DNA 连接酶、限制性内切酶、PrimeScriptTMOne Step RT-PCR试剂盒,均购自宝生物工程(大连)有限公司;质粒DNA提取试剂盒、胶回收试剂盒,均购自天根生化科技(北京)有限公司;Ni-NTA琼脂糖树脂和病毒RNA提取试剂盒,均购自Qiagen公司;其他试剂均为分析纯。
1.3 实验动物及血清 20日龄SPF猪,购自北京市SPF猪育种管理中心,攻毒剂量为109TCID50/头猪,攻毒前采样记为第0天,攻毒后的第1~14天每天采样,样品标记为D1、D2……D14,攻毒后第6天进行二次攻毒,在二次攻毒后的第11、14、18天采样,样品标记为D16、D19、D23。同时设立SPF猪血清对照组,并在同样时间采集血清样品。SVA阳性对照血清和SPF猪阴性对照血清,由中国检验检疫科学研究院动物检疫研究所实验室保存。
1.4 序列分析、合成及引物设计 根据SVAGD01/2017分离株(GenBank登录号:MH316114)VP2、VP3基因序列设计1对引物,并在基因两端加入EcoRⅠ、XhoI酶切位点。引物序列为:VP23F:5′-CGCGAATTCGATCACAATACCGAAGA-3′(下划线处为EcoR I识别位点);VP23L:5′-ATACTCGAGGTGGAACACGTAGGAAGG-3′(下划线处为XhoI识别位点),预期扩增片段大小为1 569 bp。引物由北京六合华大基因科技股份有限公司合成。
1.5 原核表达载体的构建 利用病毒RNA提取试剂盒提取SVA GD01-2017分离株RNA,以该RNA为模板,用引物VP23F和VP23L通过RT-PCR扩增目的基因序列,琼脂糖凝胶电泳检测后,胶回收目的片段。将回收的目的片段和pET-30a (+) 载体分别进行EcoRⅠ和XhoI双酶切,电泳回收VP2/3和载体片段,将二者用T4 DNA连接酶16 ℃连接过夜,转化BL21 (DE3) 感受态,筛选表达菌。经测序鉴定正确的阳性重组质粒命名为pET-30Ba-VP2/3。
1.6 VP2/3的原核表达 分别取阳性菌液100 μL,接种2管卡那霉素抗性的液体LB中,每管10 mL培养基,培养至OD600值在0.4~0.6时,分别取菌液1 mL为诱导前对照,然后加入IPTG至终浓度为1 mmol/L,1管菌液20 ℃诱导过夜,1管37 ℃诱导过夜,同时设pET-30a (+) 诱导菌为空白对照。
1.7 重组蛋白的SDS-PAGE分析 取诱导后的pET-30a-VP2/3菌液离心后弃上清,用 PBS 重悬后超声裂解分离上清和沉淀,分别取不同诱导条件下表达的适量上清和沉淀制备SDS-PAGE样品,同时以pET-30a (+) 作为对照,进行SDS-PAGE电泳。
1.8 VP2/3蛋白的大量表达及纯化 将pET-30a-VP2/3菌液接种200 mL培养液中,37 ℃大量诱导表达目的蛋白。离心收集菌体沉淀后,超声裂解,离心洗涤包涵体,去除杂蛋白,收集VP2/3包涵体蛋白,参照文献[13]中的方法对包涵体蛋白进行处理,并以Ni+柱亲和层析纯化VP2/3蛋白,采用BCA法测定蛋白浓度,并取2 μL纯化蛋白制样进行SDS-PAGE检测,其余蛋白分装后-80 ℃保存备用。
1.9 以VP2/3蛋白作为包被抗原建立间接ELISA方法
1.9.1 最佳抗原包被浓度和血清稀释度的确定 将VP2/3蛋白用包被液稀释成0.000 1 μg/μL,0.000 5 μg/μL,0.001 μg/μL,0.002 μg/μL,0.004 μg/μL,0.006 μg/μL,0.008 μg/μL,0.01 μg/μL,然后每孔100 μL包被酶标板,4 ℃包被过夜。SPF猪血清和SVA阳性血清按1∶10,1∶20,1∶40,1∶80,1∶160倍稀释。采用棋盘滴定法计算每个反应条件下的P/N值,P/N值最大的反应组合作为间接ELISA的最佳反应条件。
1.9.2 间接ELISA工作条件的优化 在37 ℃条件下分别采用1%BSA,2%BSA,5%BSA,4%羊血清,2%马血清封闭1 h确定最佳封闭液;酶标二抗分别按1∶500,1∶1 000,1∶1 500,1∶2 000,1∶2 500,1∶3 000,1∶4 000稀释,确定最佳二抗稀释浓度。TMB室温显色15 min,2 mol/L H2SO4终止显色。
1.9.3 间接ELISA方法的特异性检测 采用所建立的ELISA方法对猪口蹄疫、猪繁殖与呼吸综合征、猪圆环病毒2型、猪伪狂犬病等阳性血清进行检测,同时设SVA阳性血清和SPF猪血清作为对照,以检测该方法的特异性。
1.10 人工感染SVA后猪体VP2/3抗体的消长规律研究 采用本研究所建立的ELISA方法检测人工感染SVA后不同时间采集的猪血清样品,根据检测结果绘制抗体消长规律图。
2 结果
2.1 重组表达质粒的构建及表达 以提取的SVA全RNA为模板扩增出VP2/3目的基因,经EcoR I和XhoI双酶切后与pET30a(+)片段连接构建重组表达质粒。经测序正确的阳性质粒用于后续原核表达。对不同诱导条件下的菌体上清和沉淀进行SDS-PAGE检测(图1),结果表明,蛋白无论是低温诱导还是高温诱导均以包涵体形式表达,高温诱导时蛋白的表达量较高,蛋白大小为66 kD,与预期大小一致。
2.2 包涵体蛋白VP2/3的纯化 大量诱导表达后收集菌体沉淀,按照文献中的方法对包涵体蛋白进行洗涤并纯化,测定蛋白浓度为5.3 mg/mL,取2 μL纯化蛋白制样进行SDS-PAGE检测,结果见图2,纯化后的VP2/3蛋白比较纯,可以用于后续试验。
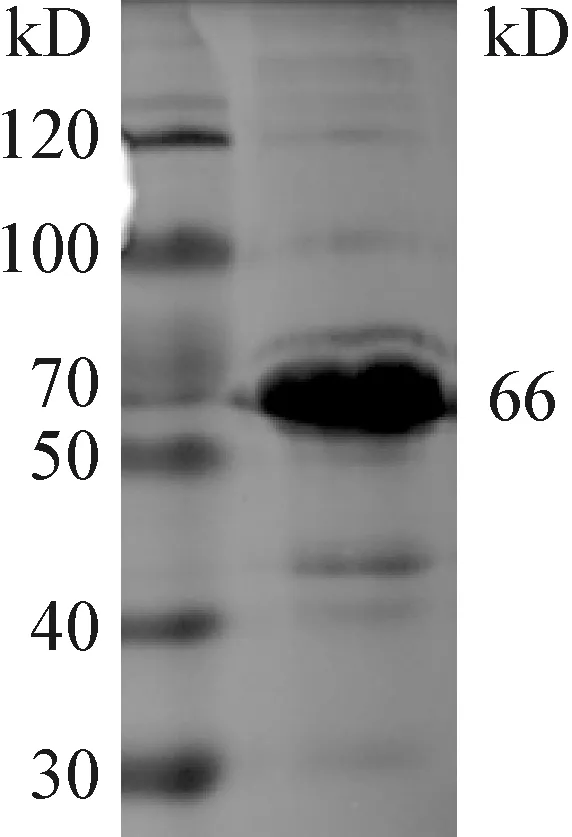
图2 纯化的包涵体蛋白的SDS-PAGE检测结果Fig.2 The detected result of purified inclusion body by SDS-PAGE
2.3 ELISA方法的建立
2.3.1 最佳抗原包被浓度和最佳血清稀释度的确定 通过棋盘滴定法确定了最佳抗原包被浓度和血清最佳稀释倍数,检测数据见中插彩版图3,当VP2/3抗原包被浓度为0.2 μg/孔,一抗血清稀释度为1∶80时,P/N值最大,因此将其确定为该ELISA检测方法的最佳抗原包被浓度和最佳血清稀释倍数。
2.3.2 最佳封闭液的确定 封闭液的优化结果见图4,从图中我们可以看出,在其他条件相同的情况下,当以1%BSA封闭时,P/N值最大,因此,选择1%BSA作为该ELISA方法的最佳封闭液。
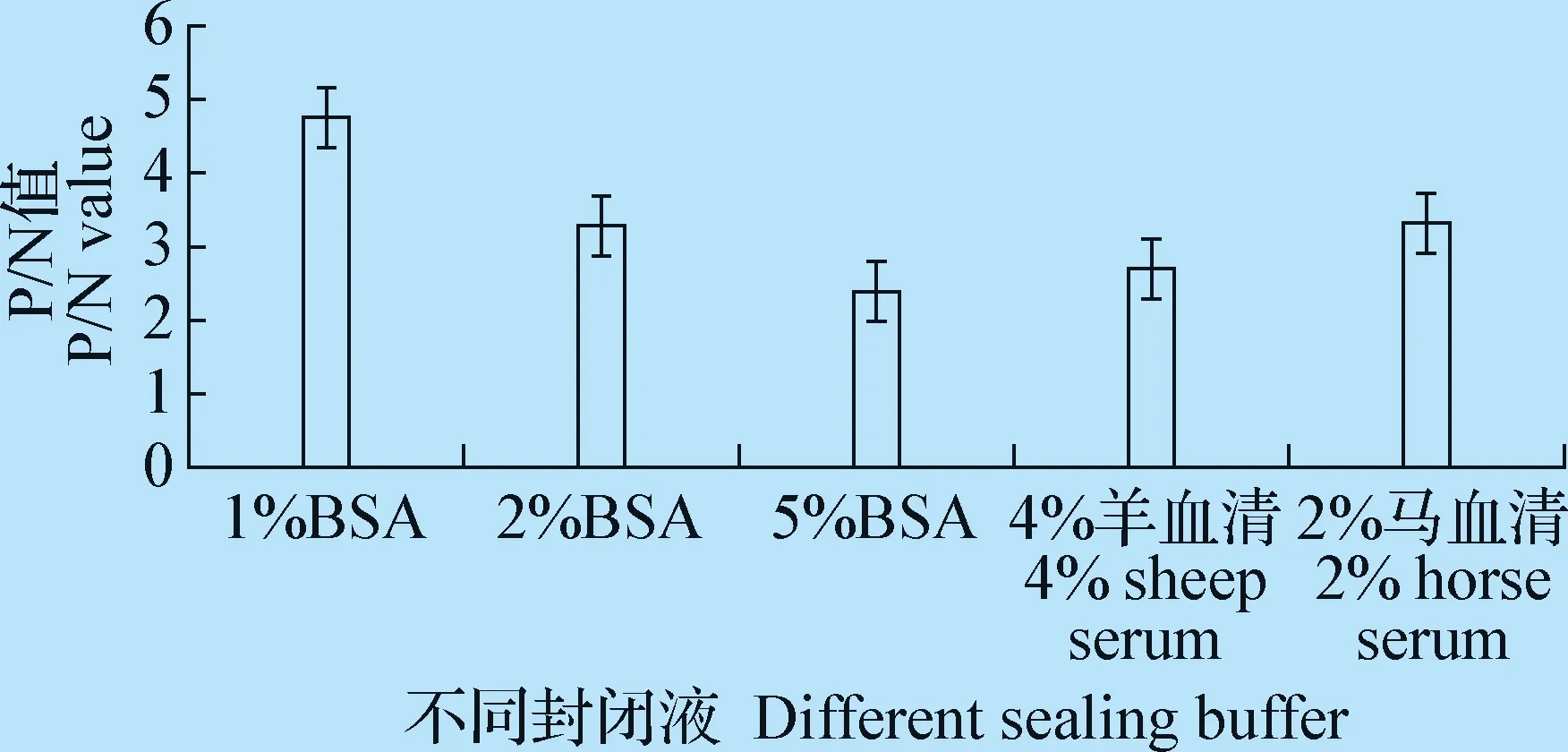
图4 最佳封闭液的确定Fig.4 Determination of the sealing buffer
2.3.3 最佳酶标抗体稀释度的确定 HRP标记的兔抗猪抗体分别按照1∶500、1∶1 000、1∶1 500、1∶2 000、1∶2 500、1∶3 000、1∶4 000的稀释度稀释后进行ELISA检测,检测结果见图5,可见当酶标抗体为1∶2 000时P/N值最大,由此确定该ELISA方法的最佳酶标二抗稀释度为1∶2 000。
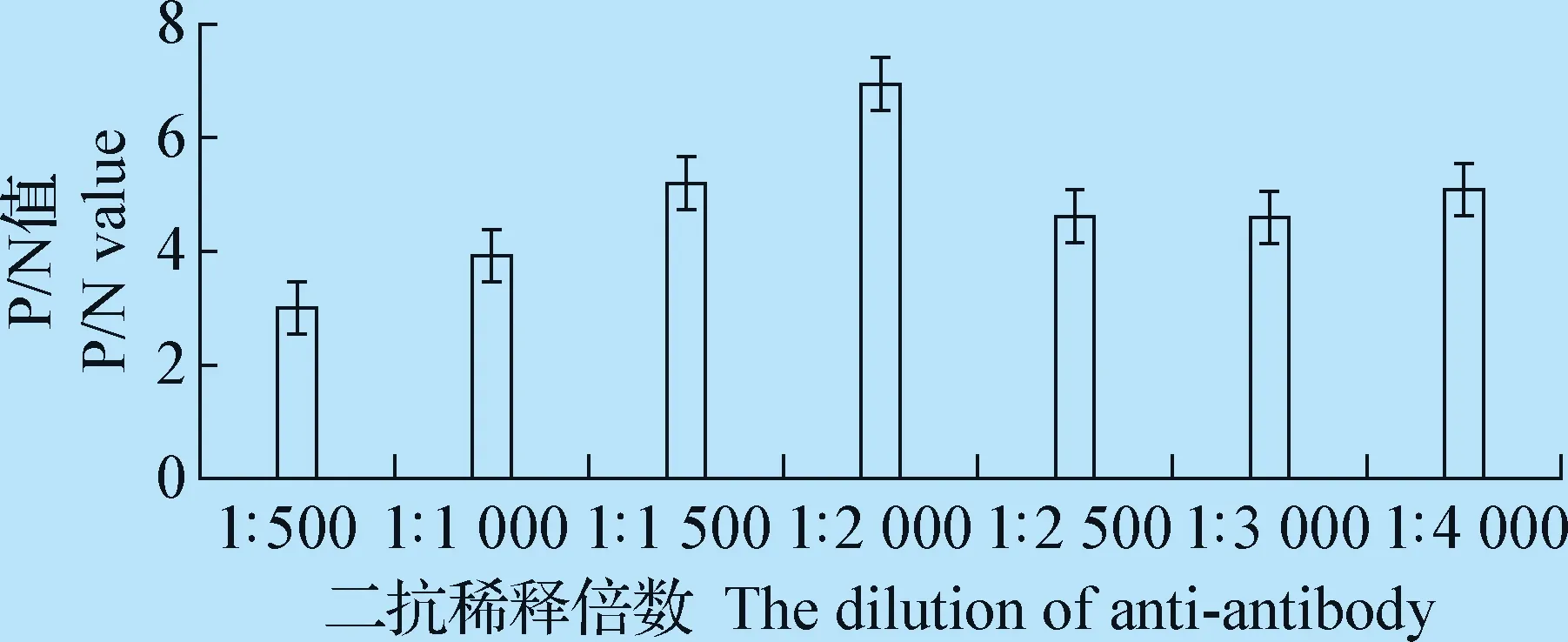
图5 最佳兔抗猪HRP酶标二抗稀释度的确定Fig.5 Determination of the anti-antibody
2.3.4 ELISA方法的特异性检测 以本研究所建立的ELISA方法对猪口蹄疫病毒(FMDV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)、猪伪狂犬病病毒(PRV)等阳性血清进行检测,同时设置阴阳性对照,检测结果见表1,其他相关病毒检测结果均为阴性,这表明该方法具有良好的特异性,与其他猪相关病毒无交叉反应。

表1 ELISA方法的特异性检测结果Table 1 The specificity result of ELISA method
2.4 感染SVA后猪体VP2/3蛋白抗体的消长规律研究 利用本研究所建立的ELISA方法检测人工感染SVA后不同时间采集的猪血清样本,根据ELISA检测结果绘制VP2/3蛋白抗体消长规律曲线图(图6)。从图中可以看出,在病毒感染后,第6天左右抗体滴度显著升高,第8~9天达到最高,并且在6~9 d时抗体滴度呈现线性上升,第9天以后抗体滴度逐步下降,直至第1次攻毒后的第23天,抗体降至SPF猪正常水平。

图6 人工感染SVA后猪体的VP2/3抗体消长规律图Fig.6 Law of growth and decline on VP2/3 antibody caused by artificial infection
3 讨论
SVA基因组为单股正链RNA,只有1个ORF,在病毒编码蛋白酶的作用下,可裂解成先导蛋白(L)和P1,P2,P3三个蛋白中间体,P1可进一步裂解成VP1、VP2、VP3、VP4四种结构蛋白,P2可裂解成2A、2B、2C三种非结构蛋白,P3可裂解成3A、3B、3C、3D四种非结构蛋白[14-16]。其中VP1、VP2、VP3、VP4四种结构蛋白组成SVA的衣壳蛋白,具有较强的抗原性,可以刺激动物机体产生特异性免疫反应,是塞内卡病毒主要的诊断靶抗原[12,17-18]。目前,A型塞内卡病毒的蛋白成熟机制并不十分清楚,P1前体是否与其他小RNA病毒一样剪切成VP1、VP2、VP3、VP4或者以其他形式发挥功能,仍然有待于进一步的研究证实。Dvorak C M等的研究结果表明,SVA早期感染即出现临床症状后0~4 d,ELISA方法比IFA方法更敏感[12],而且VP2蛋白比VP1蛋白更加保守,更适合用于血清学检测[19-20],本研究室前期已经进行了结构蛋白VP2的克隆表达并验证了其抗原性[18]。本研究将VP2和VP3全长基因进行了扩增,重组表达了塞内卡病毒A组合蛋白VP2/3,建立了针对VP2/3的间接ELISA检测方法,为今后SVA检测抗原的筛选提供了理论依据,并且为SVA 的快速诊断以及流行病学调查提供了技术手段。通过试验最终确定,本研究所建立的SVA VP2/3 间接ELISA检测方法的最佳检测条件为:以VP2/3蛋白0.2 μg/孔,4 ℃包被过夜,PBST洗3次,每次5 min;1%BSA 37 ℃封闭1 h,PBST洗3次,每次5 min;一抗阳性血清稀释度1∶80,37 ℃孵育1 h,PBST洗5次,每次5 min;兔抗猪HRP标记二抗稀释度为1∶2 000,37 ℃孵育1 h,PBST洗5次,每次5 min;TMB显色15 min,终止后OD450nm值读数,分析数据。
有研究表明,VP2和VP3可能具有SVA早期感染中和抗体的识别位点[21],研究其抗体消长规律对疫苗免疫程序的制定具有重要的指导意义。因此本研究应用所建立的VP2/3 ELISA检测方法,进一步研究了SVA攻毒后不同时间采集的猪血清样品中VP2/3抗体的消长规律。从研究结果可以看出,在病毒感染后,第4天感染猪出现临床症状,第6天左右抗体滴度显著升高,第8~9天达到最高,表明病毒感染后8~9 d抗体滴度最高。同时从结果也可以看出,6~9 d抗体滴度呈现线性上升,从侧面进一步验证了VP2/3间接ELISA方法可用于SVA抗体的检测。第9天以后,抗体滴度逐步下降,持续监测显示,第14天左右抗体出现小波动,滴度再次出现轻微上升,推测与第6天二次攻毒相关。第1次攻毒的第23天后,抗体降至SPF猪正常水平。
综上,本研究建立了基于结构蛋白VP2/3的SVA间接ELISA的检测方法,为SVA检测抗原的筛选提供了依据;并进一步利用该方法检测了攻毒样品,结果显示攻毒后的第8~9天,VP2/3的抗体滴度达到最高,为后续疫苗免疫程序的制定提供了一定的理论依据。
