双金属硫化物CuCo2S4的合成及其在锂硫电池中的应用
2020-09-29白哲李睿健侯文烁李海军王振华
白哲,李睿健,侯文烁,李海军,王振华
(1 北京理工大学化学电源与绿色催化北京市重点实验室,北京100081; 2 珠海银隆新能源有限公司,广东珠海519040)
引 言
随着科学技术的发展,人们在谋求高效便利能源利用的同时,也对环境、成本、来源等方面提出了更高的要求[1]。自20 世纪90 年代索尼公司实现锂离子电池的商业化应用,锂离子电池质量能量密度也从初代80 W·h·kg−1提高到了300 W·h·kg−1[2]。电动车的发展能量密度需求约为400 W·h·kg−1[3],这使得锂离子电池受到限制。锂硫电池因其高比容量(1675 mA·h·(g 硫)−1)、高能量密度(2600 W·h·(kg硫)−1)[4−5]、硫成本低(硫的成本为150 美元/吨,钴酸锂成本为10000美元/吨)[6]、储量丰富[7]等特点而备受研究者关注,有望成为下一代储能设备的候选。然而锂硫电池的实际应用面临着以下难题:(1)严重的穿梭效应,充放电中间产物Li2Sx(3≤x≤8)易溶于醚类电解液中,在浓度梯度作用下扩散至Li 金属负极,发生不可逆的活性物质损失和容量衰减[8−9];(2)充放电过程正极带来约80%的体积膨胀容易导致正极材料坍塌[10];(3)单质S(5×10−30S·cm−1,25℃)和放电产物Li2S 的绝缘性增大了电子扩散能垒,使得反应动力学过程缓慢[11]。
为了解决这些问题,研究者提出了多孔碳材料[12−16]、合 金[17]、有 机 聚 合 物[18]、氧 化 物(VO2[19−21]、Co3O4[22]、TiO2[23]、NiFe2O4[24]、Ba0.5Sr0.5Co0.8Fe0.2O3−δ[25])、硫化 物(CoS2[26]、Co9S8[27−28]、MoS2[29−31]、TiS2[32]、NiCo2S4[33−35])等策略抑制穿梭效应并提高多硫化物转化,取得了优异的电化学性能。彭娜等[36]提出MnO2纳米片改性隔膜用于锂硫电池,MnO2纳米片通过均匀覆盖隔膜,提供了有效地多硫化物阻隔和催化作用。相比于过渡金属氧化物,过渡金属硫化物具有电导率高,催化活性好的特点[33],可显著加快电子传导速率,降低电极反应过程的过电势[37]。姚琳等[30]设计了层层自组装MoS2多晶片作为S载体,通过S−Mo−S活性边缘使电化学过程中硫单质保持在纳米尺寸(5~10 nm),同时也促进了多硫化物的催化转化。双金属硫化物中金属离子的混合价态和电子协同作用增加了其反应活性,可与电负性的多硫离子通过Lewis 酸碱作用结合[38],近年来也成为研究的热点。Li 等[33]设计并合成了NiCo2S4中空纳米管,XPS 表征显示中间产物Li2S6的电子从多硫化物中的S 向Ni和Co转移,表明双金属硫化物对多硫化物具有有效的化学吸附,展现出巨大的潜力。
本文提出了普鲁士蓝类似物衍生的中空多孔双金属硫化物CuCo2S4用于锂硫电池正极。其中,中空多孔结构可有效容纳活性物质硫,对多硫化物提供物理限域作用,同时有效地缓解充放电过程带来的体积膨胀;极性CuCo2S4可有效吸附多硫化物,较好地抑制了穿梭效应。得益于此结构设计,CuCo2S4−S 复合材料电极在0.2C 电流密度下初始比容量为959 mA·h·g−1,100 次循环后容量保持在591 mA·h·g−1;同时在0.5C 下初始比容量为748 mA·h·g−1,300 次循环后比容量为392 mA·h·g−1,每个循环容量衰减率为0.16%。该研究表明双金属硫化物CuCo2S4可为锂硫电池正极材料的进一步发展提供方法借鉴。
1 实验材料和方法
1.1 材料
六水合氯化钴、九水合硫化钠、聚乙烯吡咯烷酮(PVP) 、分析纯,北京通广精细化工公司;五水合硫酸铜、柠檬酸钠、升华硫,分析纯,上海阿拉丁生化科技股份有限公司;钴氰化钾,分析纯,上海麦克林生化科技有限公司;盐酸、硝酸,分析纯,新光化工试剂厂;高纯锂片(直径14 mm 厚度1.1 mm),99.8%,新疆有色金属所;N-甲基吡咯烷酮(NMP),分析纯,阿法埃莎(中国)化学有限公司;PVDF、乙炔黑,分析纯,聚丙烯隔膜(厚度25 μm,Celgard 2400),美国MTI公司;锂硫电解液,上海松静能源科技有限公司;电池壳(CR−2025)、铝箔(20 μm),深圳科晶智达科技有限公司;泡沫镍(0.88 mm),加拿大Inco 有限公司;实验用水为双重去离子水。
1.2 CuCo2S4-S及AC-S复合材料的制备
Cu5/3Co4/3[Co(CN)6]2前体的制备:本次实验通过简单的离子交换法合成Cu5/3Co4/3[Co(CN)6]2多面体。将CuSO4·5H2O (0.25 mmol)和CoCl2·6H2O (0.2 mmol)溶解在200 ml 乙醇中,随后加入柠檬酸钠(2.25 mmol)制备溶液A。而后,将K3[Co(CN)6](0.3 mmol)溶解在100 ml乙醇中制备溶液B。在磁力搅拌下将溶液B滴入溶液A 中。在磁力搅拌下使两种溶液充分混合。在室温下,静置24 h,离心,乙醇洗涤3~4 次,得到沉淀物,在60℃下干燥12 h。
中空Cu5/3Co4/3[Co(CN)6]2前体的制备:将得到的沉淀Cu5/3Co4/3[Co(CN)6]2前体(20 mg)与聚乙烯吡咯烷酮(PVP−K30) (100 mg)加入在Teflon 容器中的10%盐酸溶液(20 ml)中。搅拌2 h,将容器转移到不锈钢高压釜中,然后在电炉中在150℃下加热3 h。静止24 h后,离心,用乙醇洗3~4次,在60℃下干燥12 h。
中空CuCo2S4材料的制备:将中空Cu5/3Co4/3[Co(CN)6]2前体置于H2S/Ar 混合气体(含5%浓度的H2S)中,在350℃的温度下(升温速率为2℃·min−1),煅烧3 h,以2℃·min−1的速率冷却至室温。
中空CuCo2S4−S 复合材料的制备:将25 mg CuCo2S4分散于100 ml 去离子水中得到悬液A,而后将100 mg S8单质溶解在含1.25 g Na2S 的10 ml 去离子水中得到溶液B。在磁力搅拌下将溶液B 加入悬液A 中。磁力搅拌3 h,然后加入浓度为10%的HNO3溶液,直至pH 约为7。在室温下搅拌8 h 后,离心后用乙醇洗涤3~4 次,然后在60℃下干燥12 h,收集沉淀物。
AC−S 复合材料的制备:将25 mg 乙炔黑分散于100 ml 去离子水中得到悬液A,而后将100 mg S8单质溶解在含1.25 g Na2S 的10 ml 去离子水中得到溶液B。在磁力搅拌下将溶液B 加入悬液A 中。磁力搅拌3 h,然后加入浓度为10%的HNO3溶液,直至pH 约为7。在室温下搅拌8 h 后,离心后用乙醇洗涤3~4 次,然后在60℃下干燥12 h,收集沉淀物,记作AC−S。
1.3 可视化吸附实验
首先将Li2S 与硫粉以摩尔比1∶5 加入在体积比1∶1 的DOL/DME 中,磁力搅拌至其完全溶解,制得2.5 mmol·L−1的Li2S6溶液。随后将乙炔黑(AC)与上述制备的CuCo2S4以相同的质量(25 mg)分别加入30 ml 2.5 mmol·L−1Li2S6溶液中。上述所有操作均在Ar气氛的手套箱中进行。
1.4 正极极片的制备
将上述制备的CuCo2S4−S、乙炔黑与聚偏二氟乙烯(PVDF)按照8∶1∶1 的比例溶解在N−甲基−2−吡咯烷酮(NMP)液体中。将上述制备的浆料均匀地涂刮在Al 箔上,而后置于50 ℃的真空干燥箱内,烘干24 h 后取出。将取出后的Al 箔在18 MPa 的压力下辊压。随后,冲压成直径为12 mm的电极片,面载量为1.2 mg·cm−2。对照组的制备同理,将CuCo2S4−S换成相同质量的AC−S,其他步骤均相同。
1.5 锂硫电池的组装
以直径为14 mm,厚度为1.1 mm 的锂片作为电池的负极,上一步制备的电极片作为正极,Celgard 2400(厚度25 μm)作隔膜,在充满Ar 的手套箱内组装活性物质载量为1.2 mg·cm−2的CR−2025 型号的纽扣电池。电解质是采用乙二醇二乙醚(DME)和1,3−二氧戊环(DOL) (体积比1∶1)/1.0 mol·L−1双(三氟甲磺酰基)酰亚胺锂(LiTFSI)和0.2 mol·L−1LiNO3的混合溶剂制备而成,其中电解液/硫(E/S)为110 μl·mg−1,并静置12 h。
1.6 测试仪器及方法
1.6.1 原料结构和形貌表征 X 射线衍射分析(XRD,日本Rigaku 公司,40 kV,使用CuKα辐射,扫描速率为5(°)/min,扫描范围10°~80°)用于测定样品的晶体结构。扫描电子显微镜(SEM,美国FEI 公司,Quanta FEG 250,加速电压25 kV)表面形态。透射电子显微镜(TEM,日本JEOL 公司,JEM−2100,加速电压200 kV)用于观察样品内部及精细结构。材料的比表面积和孔径分布通过Brunauer−Emmett−Teller(BET)方法和Barrett−Joyner−Halenda(BJH)方法在77 K 下进行N2吸附/脱附测试(美国Quantachrome公司,Autosorb−iQ)。X 射线光电子能谱(XPS,英国KRATOS 公司,AXIS Ultra)用于测量材料的化学和电子状态,XPS 数据已使用C 1s 结合能(284.8 eV)进行校正。热重仪器(TGA,德国NETZSCH 公司,TG209)用于测定样品的组分比例,N2气氛,升温范围为25~500℃,升温速率为5℃/min。
1.6.2 电化学性能测试 在室温下用NEWARE 电池测试仪(深圳新威尔电子有限公司)在1.6~2.8 V 的电压范围内进行恒电流充电/放电测试。用CHI650B 电化学工作站(上海辰华仪器有限公司)进行循环伏安法(CV)和电化学阻抗谱(EIS)测试,CV 测试电压的扫描范围为1.7~2.8 V,扫描速率为0.1 mV·s−1,EIS 测 试 中 交 流 频 率 的 扫 描 范 围 是10−2~105Hz,振幅为±5 mV。
2 实验结果与讨论
2.1 CuCo2S4材料的XRD表征
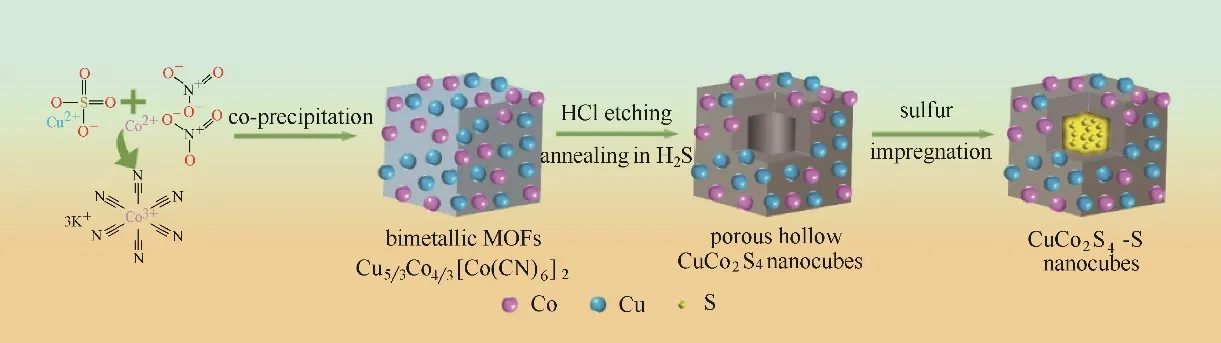
图1 Cu5/3Co4/3[Co(CN)6]2前体及CuCo2S4−S材料制备过程示意图Fig.1 Schematic illustration of preparation of Cu5/3Co4/3[Co(CN)6]2 precursor and CuCo2S4−S

图2 Cu5/3Co4/3[Co(CN)6]2前体(a)和CuCo2S4(b)材料的XRD谱图Fig.2 XRD patterns of Cu5/3Co4/3[Co(CN)6]2 precursor(a)and CuCo2S4(b)

图3 Cu5/3Co4/3[Co(CN)6]2SEM(a)和TEM(b)图;CuCo2S4的SEM(c)和HRTEM(d)图Fig.3 SEM(a)and TEM(b)images of Cu5/3Co4/3[Co(CN)6]2;SEM(c)and HRTEM(d)images of CuCo2S4

图4 CuCo2S4和CuCo2S4−S的N2吸附−脱附下的等温线图(a)和孔径分布图(b)Fig.4 N2adsorption−desorption isotherm curves(a)and pore size distributions(b)of CuCo2S4 and CuCo2S4−S
本文采用离子交换法制备以Cu5/3Co4/3[Co(CN)6]2为前体的普鲁士蓝类似物,经过H2S 气氛煅烧转化为尖晶石结构的双金属硫化物CuCo2S4,其制备过程示意图如图1所示。XRD表征用于鉴定材料物相组成,Cu5/3Co4/3[Co(CN)6]2及CuCo2S4的XRD 谱图分别如图2(a)和(b)所示,可知结果与标准卡片相吻合,且特征峰尖锐,表明制备所得材料结晶度高[22]。其中峰位置较标准卡片右移,可能归因于Cu5/3Co4/3[Co(CN)6]2及CuCo2S4的晶格间距减小。经过硫化,可观察到CuCo2S4位于26.8°、31.3°、38.1°、50.4°、55.2°的主要特征峰,分别对应其(022)、(113)、(004)、(115)和(044)晶面。
2.2 CuCo2S4材料的微观形貌表征
通过扫描电子显微镜(SEM)和透射电子显微镜(TEM) 来表征合成的Cu5/3Co4/3[CoCN6]2和中空Cu5/3Co4/3[Co(CN)6]2前体的形貌特征。如图3(a)、(b)所示,可以看出前体Cu5/3Co4/3[Co(CN)6]2尺寸分布较均匀,平均尺寸约为500 nm。Cu5/3Co4/3[Co(CN)6]2前体经过盐酸的刻蚀得到壁厚约为50 nm 的中空结构,进一步H2S 气氛煅烧硫化得到中空多孔的CuCo2S4。图3(c)中,通过破碎的CuCo2S4立方体可以明显看出,HCl刻蚀得到了较好的中空结构,同时在350℃煅烧后,双金属硫化物的尺寸和外形保持良好,但颗粒表面的粗糙度增加,立方体表面变得疏松多孔,这将有利于增加硫基底材料的比表面积,以提供更多对多硫化物物理吸附位点。图3(d)中,通过HRTEM 图可观察到,CuCo2S4呈现出清晰的晶格条纹,表明该材料的高结晶度,测定晶格间距为0.28 nm,与CuCo2S4的(113)晶面相对应,进一步验证了尖晶石结构CuCo2S4的生成。
为了研究材料的比表面积和孔体积,对CuCo2S4和CuCo2S4−S 材料进行BET 测试。图4(a)、(b)分别给出了N2吸附−脱附等温线和孔径分布图,计算得CuCo2S4具有较大的孔体积,为0.124 cm3·g−1,此外还具有多层次的孔径分布,平均孔径为3.4 nm。在浸渍S 之后,CuCo2S4−S 的孔体积和孔径有明显的减小,表明此过程中单质S 有效地进入了材料的孔隙结构内,实现了S 的均匀负载。进一步采用热重分析对CuCo2S4−S 复合材料中活性物质含量进行测定。由图5 可知,在200℃时,CuCo2S4−S 复合材料开始失重,温度升高至280℃时,失重完成,测得复合材料CuCo2S4−S 复合材料的硫含量为68.9%,表明CuCo2S4−S复合材料实现了有效的硫负载。
2.3 CuCo2S4材料的XPS表征及Li2S6吸附实验
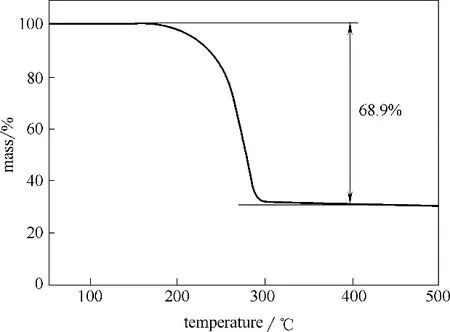
图5 CuCo2S4−S复合材料的热重分析曲线Fig.5 TGA curves of CuCo2S4−S composite
X 射线光电子能谱(XPS)被用来证明CuCo2S4材料的成键情况和化学组成。测试表明CuCo2S4表面主要有C、Cu、Co、S 四种元素。如图6(a)所示,在结合能为284.8 和286.4 eV 处可分别检测到强度较低的C 1s和C—N键[39],产生于PBA高温煅烧的碳化过程。图6(b)中Cu 2p 谱图进行反卷积分峰后可观察到两个自旋轨道Cu 2p1/2和Cu 2p3/2,对应于952.3 和932.4 eV 处的峰。此外,在934.6 eV 处仍然存在一个强度较弱的峰,可能是暴露在空气中被氧化形成的Cu−O 结合能峰。在图6(c)中,可清晰地观察到结合能位于778.9 和794.0 eV 代表Co 2p3/2和Co 2p1/2,同时位于782.0 和798.7 eV 的结合能分别归因于Co3+和Co2+的存在。S 2p 区域如图6(d),除了存在于162.6和161.4 eV 的重叠双峰(S 2p1/2和S 2p3/2)自旋轨道之外,在163.8 eV处还存在M−S的结合能峰,属于典型的金属−硫键(Co−S 或Cu−S)[40],同时169.2 eV 存在强度较高的峰,可能是材料表面部分氧化形成的S—O键[41]。双金属硫化物中存在的S离子以及混合价态的Co 离子可分别与多硫化物中的Li 和S 产生Lewis 酸碱作用[38],使得来自多硫化物S 中的电子向Co 转移[33],由此产生类似化学键的S−Li、Co−S 键合作用[26],可大大增强化学吸附能力,进一步抑制穿梭现象的产生。可视化吸附实验直接地证明了CuCo2S4对多硫化物的吸附效果,分别将相同质量(25 mg)的CuCo2S4与AC 添加到2.5 mmol·L−1的Li2S6溶液中。如图6(e)所示,静止1 h 后CuCo2S4−Li2S6呈现亮黄色,而AC−Li2S6为暗黄色,表明CuCo2S4与Li2S6之间强化学吸附。以上结果表明CuCo2S4具备极性和丰富的离子价态,将对多硫化物的吸附和转化产生重要作用。

图6 CuCo2S4的XPS图谱及可视化吸附实验Fig.6 XPS spectra and visual adsorption experiments of CuCo2S4
2.4 CuCo2S4材料的电化学性能分析
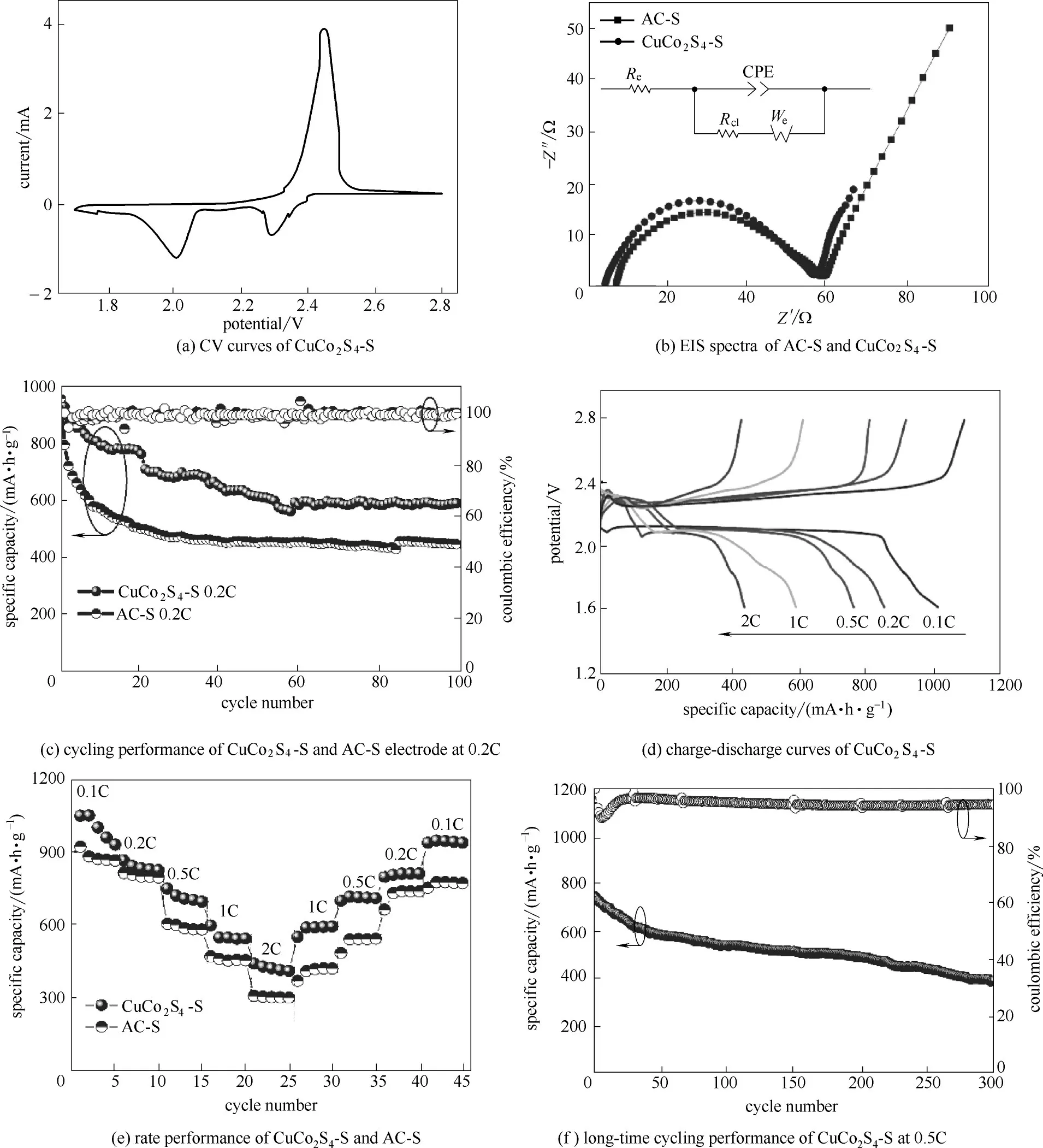
图7 CuCo2S4−S的电化学性能Fig.7 Electrochemical performance of CuCo2S4−S
为了对CuCo2S4−S 电极的电化学性能进行评估,本文分别组装了以CuCo2S4−S 和AC−S 为正极的纽扣电池。其中CuCo2S4−S 复合材料中的硫质量含量为68.9%,硫的负载质量为1.2 mg·cm−2。图7(a)为CuCo2S4−S 复合材料扫描速度为0.1 mV·s−1时的CV 曲线图。其中,在首次循环中,在2.29 V 处的还原峰对应于S8环状分子降解为长链多硫化物(Li2Sx,4≤x≤8),而2.02 V 时的还原峰归属于长链多硫化物Li2Sx转化为Li2S2/Li2S。在2.42 V 处较尖锐的氧化峰归因于Li2S2/Li2S 向S8转化的逆反应。以CuCo2S4−S和AC−S 为正极,新组装的电池EIS谱图和相应的等效电路如图7(b)所示。在高频区与实轴相交的点为电池的欧姆电阻(Re),高频区出现一个近似半圆的圆弧,代表电化学反应过程中的电荷转移电阻(Rct),而低频区的斜线代表溶液中多硫化物扩散的Warburg阻抗(We)。由EIS谱图可知,相比于AC−S,CuCo2S4−S有着较小的欧姆电阻,电荷转移电阻略小于AC−S,同时低频区的扩散过程斜率更大,该结果表明CuCo2S4同时改善了多硫化物反应中的电子传导与离子传导性能,有利于减小极化,促进多硫化物的氧化还原转化。
CuCo2S4−S 材料对多硫化物的穿梭有很好的抑制作用,这有利于提高放电容量,保持放电的稳定性。同时,在0.2 C 倍率放电时,CuCo2S4−S 和AC−S正极的循环性能和相应的库仑效率如图7(c)所示。CuCo2S4−S 复合材料做正极显示出959 mA·h·g−1的较高初始放电容量,经过100 个循环后仍保持在591 mA·h·g−1,衰减率为每个循环0.38%。 相比之下,AC−S 正极的初始放电容量与CuCo2S4相近,为960 mA·h·g−1,但在100 次循环后逐渐降至仅446 mA·h·g−1,其 容 量 保 持 率 低 于CuCo2S4−S,这 表 明CuCo2S4−S 复合材料限制多硫化物穿梭效应的结构与性能优势。此外,CuCo2S4−S电极的库仑效率保持在95%以上,显示出显著的循环稳定性。图7(d)显示了在0.1C 和2C 不同倍率下的充电/放电曲线,可以清楚地看到,尽管在2C 的高倍率下,由于材料良好的电子电导率和对多硫化物的催化性能,在放电曲线中仍然存在两个放电平台。
CuCo2S4−S和AC−S的不同倍率下放电性能的比较如图7(e)所示。由于CuCo2S4具有良好的导电性和电化学活性,因此CuCo2S4−S 复合材料以0.1C、0.2C、0.5C、1C和2C的倍率分别提供1072、962、746、612和470 mA·h·g−1的初始比容量。此外,当放电倍率从2C 切换到0.1C 时,放电比容量仍能接近原始水平。与AC−S 相比,CuCo2S4−S 复合材料具有更高的放电比容量和更好的放电稳定性。图7(f)展示的是CuCo2S4−S 正极在0.5C 倍率下进行的长期放电循环测试图。其初始放电比容量为748 mA·h·g−1,平均容量衰减率低至每个循环0.16%。表1 列出了CuCo2S4−S 与其他已报道的碳材料、氧化物、单金属硫化物正极材料循环性能的比较结果,可以看出CuCo2S4−S 正极在活性物质载量接近的情况下仍表现出可观的稳定容量和容量保持率,证明了其优异的循环性能。这些结果表明,双金属硫化物不仅可以有效地提供对多硫化物较强的物理吸附和化学吸附,并且还可以为锂离子和电子的传输建立一个快速的通道,抑制多硫化物的穿梭效应,提高活性物质的利用率。
3 结 论
本文以普鲁士蓝类似物为前体,制备了尖晶石型双金属硫化物CuCo2S4材料并将其用于锂硫电池正极。由于CuCo2S4的中空多孔结构以及良好的电子传导性,可为电子和离子提供快速的传输路径,减小极化和过电势。其不仅可以对硫单质和多硫化物进行有效的物理限制,疏松多孔的结构可对充放电过程中带来的体积膨胀起到缓冲作用。同时极性CuCo2S4可对多硫化物提供丰富的化学吸附活性位点,对于抑制多硫化物的穿梭起到重要作用,减少了活性物质的不可逆损失。当其应用在锂硫电池正极材料中,表现出增强的电化学性能。在0.2C电流密度下,CuCo2S4−S正极初始放电比容量为959 mA·h·g−1,100 次循环后保持在591 mA·h·g−1;在长期放电循环测试时,当电流密度增加到0.5C时,呈现出748 mA·h·g−1的初始比容量,300 次循环后容量衰减仅为0.16%。该研究表明CuCo2S4−S 可成为有潜力的正极材料,同时该材料合成制备方法简单,易于大规模生产,可为锂硫电池的正极发展提供一定的借鉴。

表1 本文工作与已报道正极材料性能比较Table 1 Comparison of previous reported cathode and this work
