醇脱氢酶在聚乙烯膜表面的固定化研究
2020-09-29郭梦雅季书馨谷凤娟孟子晖刘文芳王燕子
郭梦雅,季书馨,谷凤娟,孟子晖,刘文芳,王燕子
(1 北京理工大学化学与化工学院,北京102488; 2 深圳大学化学与环境工程学院,广东深圳518060)
引 言
醇脱氢酶(ADH)是一种重要的氧化还原酶,可以催化醇与醛、酮之间的可逆反应[1]。ADH 固定于电极材料可制成多种用途的生物传感器,例如,ADH乙醇生物传感器可用于分析乙醇浓度,ADH甘油生物传感器可利用ADH 催化甘油氧化为甘油酸,从而测量人尿中甘油浓度[2]。以ADH 为催化剂,可以生产重要化工原料和中间反应物,例如,通过产ADH 的菌株进行乙醇生产,相对于其他方法,具有操作简便、产物更易获得等优点[3]。ADH 作为人和动物重要的生理指标,还可用于医学研究,例如,检测血清中的ADH活性可以诊断肝脏疾患[4]。
由于游离ADH 易受环境的影响而变性失活,且不易从反应体系中分离和回收,使其工业应用受到限制[5]。酶的固定化可有效提高酶的分离、回收效率以及重复利用性,且能提高酶的稳定性[6]。ADH固定化使用的载体可以划分为无机和有机材料两大类。无机材料常用的有二氧化硅,其次还有金属有机骨架、二氧化钛、氧化石墨烯、多孔玻璃珠、Al2O3等[7−8]。这些材料的比表面积较高,因此可带来较高的负载率和固定化效率,能显著提高生物催化效率[9−10]。但颗粒材料不易分离,在使用过程中容易流失,与磁性材料复合后可改善其回收性[11−13],但材料制备的烦琐程度增加。有机材料种类繁多,无论是载体形状还是表面性质都具有很大的调控空间。常见的有聚合物颗粒、纤维以及聚合物膜。Alsafadi等[14]将来自嗜盐古菌的ADH 共价固定到用金属Co、Ni、Zn 和Ca 衍生后的环氧化聚甲基丙烯酸微球上,与游离酶相比,固定化酶的稳定性、耐热性和有机溶剂耐受性都有所提高。Shinde 等[15]用氯丙酰氯对聚乙烯醇(PVA)纤维载体表面的羟基进行功能化,再用乙二胺胺化,最后用戊二醛(GA)将ADH 共价结合到PVA纤维表面,固定化后的ADH热稳定性改善,在重复使用8次后,保留其初始活性的60%。
聚合物膜作为酶固定化载体,有以下优点:①组成易于调节、表面积大、有较高的孔隙率以及明确的孔径和结构,酶分子不仅可以固定在载体表面,也可以固定在孔隙中,固定化效率得到提高[16];②穿过膜的反应混合物相对更容易进入酶的活性位点,可减少扩散限制,提高反应效率[17];③有利于反应混合物的分离和纯化,可以在催化反应的同时分离产物[17−18]。Luo 等[19]通过过滤将ADH 和谷氨酸脱氢酶截留在由聚丙烯(PP)支撑层和聚砜(PSF)表层构成的反向不对称膜上,制成固定化酶膜反应器,与游离酶膜反应器相比,提高了底物的转化率和酶的重复利用率。Marpani等[20]先制备ADH、藻酸盐和氯化钙的混合物,然后在PSF 超滤膜表面通过凝胶诱导固定化酶,ADH 的固定化效率最高可达71.4%,甲醛转化率为40%。Ismail 等[21]采用反向过滤法将ADH 固定在聚偏氟乙烯(PVDF)和聚醚砜(PES)膜上,ADH 的固定化效率分别为87.7%和70.9%,酶的相对活性能保持至少七个连续周期,PVDF 膜上甲醛的转化率高达90%。Hoffmann 等[22]将ADH固定在聚1−乙烯基咪唑接枝的PSF膜上,与原始膜相比,酶负载量增加,酶活和稳定性均得到提高,催化甲醛还原为甲醇,辅酶的转化率大于94%。
聚乙烯(PE)中空纤维膜具有良好的化学稳定性、耐微生物侵蚀和耐氧化性能,而且机械强度大、长期使用性能稳定、不易降解[23−25],在水处理、生物医学、制药、化工和食品等行业应用广泛[25−27]。载体表面经紫外活化后可以用羧基聚合物进行功能化,丙烯酸(AA)单体具有非常快的聚合速率[17],接枝的聚丙烯酸(PAA)链上的羧基能够与生物分子的化学官能团相互作用,改变材料的表面特征[28−29]。聚乙烯亚胺(PEI)是一种含有伯、仲、叔氨基的聚合物,在广泛的条件下具有很强的阴离子交换能力,并且能够在酶或载体上与不同的部分发生化学反应[30],用PEI改性载体可以为酶的固定化提供大量的结合位点,为提高酶的负载率提供了可能性。
本文将以PE 中空纤维膜为载体,用PAA 羧基化改性后,采用两种固定化ADH 的路线,分别考察固定化酶的工艺条件、催化反应条件以及固定化酶的重复利用性。
1 实验材料和方法
1.1 材料
PE 中空纤维膜(膜厚0.2~0.4 mm,内径1 mm,孔径0.3 μm),由中国科学院化学所赠送,使用之前先用三氯乙烯浸泡12 h,然后用乙醇/丙酮溶液(体积比为1∶1)清洗24 h,最后用去离子水清洗后烘干;来源于酿酒酵母的醇脱氢酶(ADH)(冻干粉末,EC 1.1.1.1,288 U/mg 固体)和还原型辅酶I 二钠盐NADH(纯度>98%)购于Sigma 公司;枝化聚乙烯亚胺(分子量600,99%),购于上海阿拉丁生化科技股份有限公司;质量分数为37%~40%的甲醛水溶液;二苯甲酮(BP),化学纯,购于天津市博迪化工有限公司;丙烯酸(AA)、戊二醛,分析纯,购于天津市福晨化学制剂厂;酸性橙7,分析纯,购于国药集团化学试剂有限公司;N,N−二甲基甲酰胺、三氯乙烯、丙酮、乙醇、盐酸、氢氧化钠、磷酸氢二钠、磷酸二氢钠,分析纯,均购于北京化工厂;1−(3−二甲氨基丙基)−3−乙基碳二亚胺盐酸盐(EDC∙HCl)、N−羟基琥珀酰亚胺(NHS),分析纯,购于上海共价化学有限公司。考马斯亮蓝G−250,分析纯,购于Sigma 公司。二苯甲酮(BP),化学纯,购于天津市博迪化工有限公司。
1.2 分析测试仪器
UV−6100 紫外−可见分光光度计(上海美谱达仪器有限公司);Nicolet IS10 傅里叶变换红外光谱仪(赛默飞世尔科技公司);JSM−7500F 扫描电子显微镜(日本JEOL公司)。
1.3 PE膜表面改性
1.3.1 紫光接枝法改性PE 膜 将膜丝剪成1 cm 的小段,称重后置于盛有0.24 mol/L BP 的丙酮溶液的石英瓶中,紫外光照7 min,室温下磁力搅拌5 min。重复上述步骤两次。活化之后将反应残液倒出,加入配制好的浓度为1.89 mol/L 的AA 的水/乙醇混合溶液,通氮气,40℃水浴下磁力搅拌10 min,紫外光照射7 min,再在40℃下反应45 min。然后将膜丝依次用丙酮、N,N−二甲基甲酰胺、丙酮、去离子水清洗,烘干。接枝后的膜记为PAA−PE,用称重法计算接枝率,接枝率为9.7%~14.3%。
1.3.2 PAA−PE 膜表面氨基化 将烘干后的膜丝加入100 ml 浓度为1%(质量)的PEI 水溶液,40℃水浴中搅拌1 h,用去离子水清洗后烘干,记为PEI/PAA−PE,制备路线如图1(a)所示。用酸性橙7法[31]测定膜表面氨基密度,为4.3×10−7~6.5×10−7mol/cm2。
1.4 ADH的固定化及表征
1.4.1 PEI/PAA−PE 膜固定化ADH 采用GA 分别与酶和PEI/PAA−PE 膜表面的氨基结合生成缩氨,实现酶的固定化。用2 ml 0.05 mol/L 的磷酸盐缓冲溶液(PB)(pH 6.5)配制1mg/ml的ADH新鲜酶液,向其中加入GA 使其浓度为0.01%(质量),再向反应液中加入表面氨基总量为(1.3~1.4)×10−5mol 的PEI/PAA−PE 膜,然后放入摇床(30℃,140 r/min)反应24 h。固定化结束后,将膜取出,用相同条件的PB 清洗,得到的固定化酶记为ADH−PEI/PAA−PE。固定化路线见图1(a),简称为路线1。
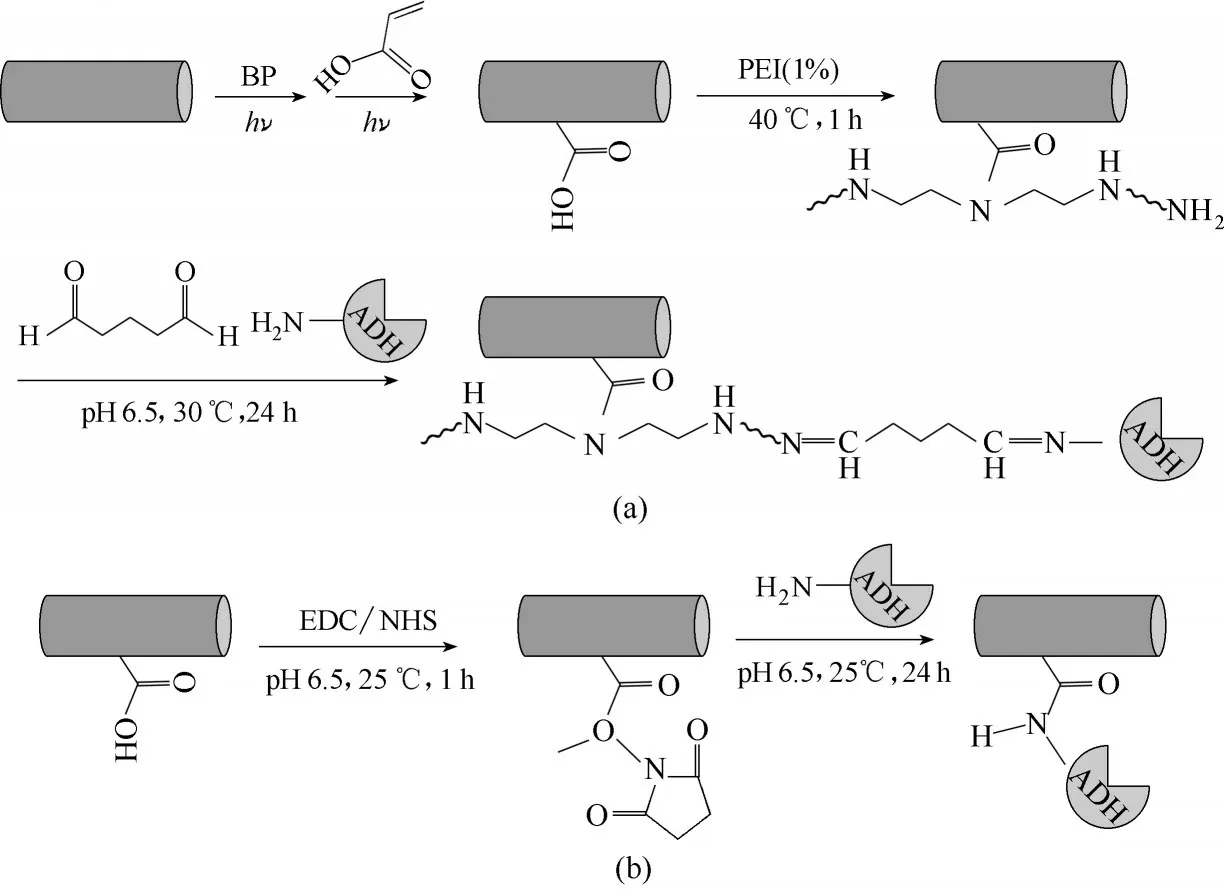
图1 PEI/PAA−PE膜的制备及固定化ADH路线(a)与PAA−PE固定化ADH路线(b)Fig.1 Preparation of PEI/PAA−PE membrane and immobilization route of ADH on it(a)and immobilization route of ADH on PAA−PE(b)
1.4.2 PAA−PE 膜固定化ADH 在2 ml 的PB(0.05 mol/L,pH6.5)中加入10 根1 cm 的PAA−PE 膜丝,0.15 mmol/L 的EDC 和0.075 mmol/L 的NHS,在摇床(25℃,140 r/min)振荡1 h,然后加入ADH 使其最终浓度为1 mg/ml,继续振荡24 h,然后将膜取出,清洗后得到ADH−PAA−PE。固定化路线见图1(b),简称为路线2。
1.4.3 固定化ADH 活力测定 反应式见式(1)。用相同条件的PB 配制6 ml 包含38 mmol/L HCHO 和0.2 mmol/L NADH 的反应液,加入一定量载有ADH的膜,在摇床(30℃,140 r/min)反应2 min 后,取1.5 ml 反应液,用紫外−可见分光光度计测定溶液中的NADH 在340 nm 处吸光度值的变化,计算反应速率,单位μmol/(L·min),同时做三组平行实验,取平均值。对路线1,以固定化酶每分钟转化的NADH的物质的量作为酶活(μmol/min,U),然后再除以固定化过程中酶的初始投入质量,计算固定化酶的比活(U/mg)。
1.4.4 固定化效率测定 对路线2,用考马斯亮蓝法测固定化效率[32]。在50 μl 待测液中加入2 ml 考马斯亮蓝溶液,摇晃30 s 后遮光静置5 min,使用紫外−可见分光光度计在波长595 nm 下测量吸光度值。根据固定化前后溶液吸光度值的变化计算固定化效率。
1.4.5 固定化酶的重复利用性测定 取新鲜的固定化ADH,反应2 min 后测酶促反应速率,以此作为100%。反应后将膜取出,用PB 清洗后再次测定反应速率,与初次使用时的反应速率相比得到相对活性。
2 实验结果与讨论
2.1 PE膜表面改性前后的表征
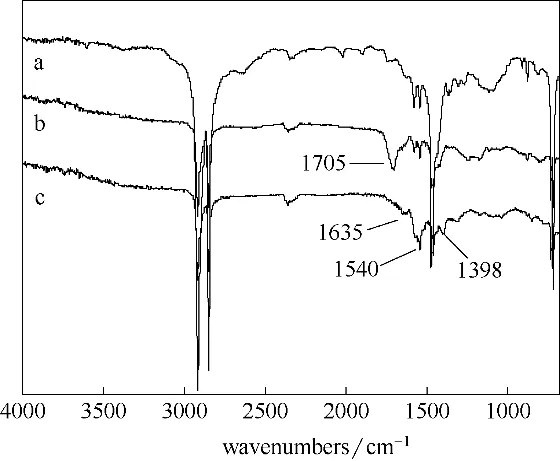
图2 PE(a)、PAA−PE(b)和PEI/PAA−PE(c)膜的红外谱图Fig.2 FTIR spectra of PE(a),PAA−PE(b)and PEI/PAA−PE(c)membrane
对改性前后的PE 膜进行FTIR 表征。由图2 可知,对改性前的PE 膜[图2(a)],在3000~2750 cm−1处的峰为—CH2的伸缩振动峰,在1460 cm−1处的峰为C—H 键的弯曲振动峰。改性后PAA−PE 膜[图2(b)],在1705 cm−1处出现了羧基中羰基(C O)的伸缩振动的特征峰,证明PAA 成功接枝到了PE 膜表面。对于PAA/PEI−PE[图2(c)],在1398 cm−1处出现了C—N 的弯曲振动峰,在1540 cm−1处出现了N—H的弯曲振动峰,在1635 cm−1处出现了酰胺中羰基(C O)的伸缩振动峰,证明PEI 成功地接枝到了PAA−PE 膜表面。但在3300~3500 cm−1处没有观察到N—H 的伸缩振动峰,可能是由于接枝到膜表面的氨基主要以叔胺和仲胺的形式存在,而伯胺较少的缘故[33]。
图3为PE中空纤维膜外表面的SEM 图,从图中可以看出,PE 原膜外表面分布着一些膜孔[图3(a)];接枝PAA 后,膜孔变小并有少许凸起,证明表面聚合物层的引入[图3(b)];进一步用PEI 改性后,表面变化不明显[图3(c)]。
2.2 PEI/PAA-PE固定化ADH条件的优化

图3 PE中空纤维膜外表面的SEM照片Fig.3 SEM micrographs of PE,PAA−PE and PEI/PAA−PE
首先,在GA 浓度为0.02%(质量)条件下,考察了固定化过程中缓冲液pH 对固定化酶催化性能的影响。由图4(a)可知,当缓冲液pH 从5.0 增加到7.0时,催化反应的速率先增大后减小;pH 为6.0 时,反应速率达到最大值,为7.87 μmol/(L·min)。这可能是由于在固定化过程中PEI/PAA−PE 表面的氨基会引起缓冲液局部pH升高,导致适宜pH向酸性偏移。但酶分子中的氨基与GA 形成的席夫碱在酸性条件下不稳定[34],导致固定化效率降低,所以,pH 也不能过低。
其次,在5~45℃范围内,考察了固定化过程中摇床温度对固定化ADH 催化性能的影响。由图4(b)可以看出,当温度从5℃升高到15℃时,反应速率变化不大;当温度继续升高,反应速率几乎呈线性降低;至35 和45℃时,反应速率下降到15℃时的72.1%和63.6%。由此可见,采用GA 固定化ADH时,固定化温度最好不要超过15℃,否则酶容易失活。
接着,考察了固定化过程中酶浓度对固定化酶催化性能的影响。由图4(c)可知,当酶浓度从0.2 mg/ml 增加到1.0 mg/ml 时,反应速率从2.92 μmol/(L·min)增加到8.63 μmol/(L·min),原因可能是酶负载量随酶浓度增加而相应增加。然而,随着酶浓度增加,酶比活先减小,然后基本不变。说明随着酶浓度增加,酶的利用率下降;当酶浓度为0.6~1.0 mg/ml 时,酶浓度增加的比例刚好等于反应速率增加的比例,所以比活变化不大。
最后,考察了固定化过程中GA 浓度对固定化酶催化性能的影响。由图4(d)可知,当不加GA 时,酶也可以负载上去,因此显示出一定的催化活性。当GA 浓度从0 增加到0.01%(质量)时,反应速率从7.4 μmol/(L·min)增加到9.6 μmol/(L·min);然而,当GA 浓度进一步增加到0.15%(质量),反应速率几乎呈线性下降;再继续增加至0.2%(质量),反应速率基本不变。说明低浓度GA 的加入有利于酶分子结合到膜表面,但随着GA 浓度的增加,酶分子内部及分子之间通过GA形成交联聚集体的可能性增加[35],广泛的交联可能导致酶结构变形,使得底物的可接近性和适应性降低,因此酶活降低[36]。
2.3 PAA-PE固定化ADH条件的优化
首先,保持PAA−PE 膜用量不变,在EDC 和膜表面羧基的摩尔比为4∶1 的条件下,通过改变NHS的量,考察了EDC 和NHS 的摩尔比(EDC∶NHS)对酶固定化效率和催化性能的影响。由图5(a)可知,随着EDC∶NHS 增大(即NHS 浓度的降低),固定化效率逐渐降低;当体系中不添加NHS(1∶0)时,ADH的固定化效率仅为20.1%。固定化过程中,EDC 和膜表面的羧基反应生成O−酰基脲中间体,进而和酶分子的氨基反应生成稳定的酰胺键[37],但是O−酰基脲中间体不稳定极易水解,导致酰胺键生成效率低,NHS的加入可以将不稳定的O−酰基脲中间体转化为较稳定的琥珀酰亚胺酯,提高偶联效率[31,38]。从图5(a)还可以看到,不添加NHS时,反应速率仅为5.1 μmol/(L·min);随着EDC∶NHS 增大,固定化酶催化反应的速率先增加后降低;当EDC∶NHS 为1∶0.5时,反应速率最大,为8.5 μmol/(L·min)。这是因为,随着NHS 浓度增加,酶的固定化效率逐渐增加,酶促反应速率随之增加,但当NHS 浓度过高时(EDC∶NHS<1∶0.5),化学反应可能破坏了酶分子的一部分活性位点,导致固定化酶活力降低。
接着,保持其他条件不变,考察了固定化时间对酶固定化效率和催化性能的影响。由图5(b)可知,当固定化时间从12 h 延长到36 h 时,固定化效率由28.2%增加到50.2%;此后,固定化效率不再随时间延长而增加,可能是因为此时反应已达到饱和;当固定化时间继续延长至60 h,固定化效率反而有轻微下降,可能是因为EDC 水解成相应的脲衍生物而失去其活化羧基的能力[39]。从图5(b)还可以看出,随着固定化时间的延长,固定化酶催化反应的速率先增加后降低,在24 h 时达到最大。原因可能是,在24 h 之前,固定化酶的活性主要由固定化效率决定,固定到膜上的酶越多,酶促反应速率越大;24 h 以后,随着时间延长,尽管负载的酶量不断增加,但由于在25℃下长时间振荡,酶活性逐渐降低,导致酶促反应速率下降。
最后,在pH 5.5~7.5范围内,考察了固定化过程中缓冲液pH 对酶固定化效率和催化性能的影响。由图5(c)可知,随着pH 增大,固定化效率先逐渐降低,然后保持不变;pH 5.5 时,固定化效率最高,为95.3%。这说明弱酸性条件有利于酶固定。前已述及,固定化过程中会生成琥珀酰亚胺酯,而该酯与氨基在弱酸性条件下反应[40]。不同的是,随固定化pH 的增加,酶促反应速率先增大后减小;当pH 为6.5 时,所得固定化酶的催化反应速率最大。这说明,当pH<6.5 时,尽管酶固定化效率较高,但ADH可能失活;当pH>6.5 时,尽管此时固定化效率已不再降低,酶活却有所下降。可能是由于pH 6.5 最有利于酶活的保持,高于或者低于该值,ADH 活性都会下降。

图4 固定化pH(a)、温度(b)、酶浓度(c)和GA浓度(d)对ADH−PEI/PAA−PE 催化性能的影响Fig.4 Effects of pH(a),temperature(b),enzyme(c)and GA concentration(d)in the process of immobilization on the catalytic performance of ADH−PEI/PAA−PE
2.4 固定化酶催化反应的最适条件
首先,考察了反应pH 对固定化ADH 催化性能的影响。由图6(a)可知,对于ADH−PEI/PAA−PE,当pH 从6.0 增加到6.5 时,反应速率从7.2 μmol/(L·min)增加到8.6 μmol/(L·min);当pH 进一步增加,反应速率几乎呈线性下降。对于ADH−PAA−PE,当反应pH 从5.5 增加到6.0 和6.5 时,反应速率从6.2 μmol/(L·min)增加到10.2 μmol/(L·min)和10.7 μmol/(L·min);当pH 进一步增加,反应速率线性下降。两种固定化ADH 的最适反应pH 均为6.5,这和游离酶是一致的。过酸或过碱的环境可能会影响ADH 的构象,使其变性失活,或者影响不同氨基酸残基携带的电荷,从而导致蛋白质解折叠和催化活性丧失[1,41]。
相同pH 下,ADH−PAA−PE 的催化反应速率均高于ADH−PEI/PAA−PE。在最优pH(6.5)条件下,前者是后者的1.2 倍,原因可能是EDC/NHS 法反应条件相对温和[42]。但固定化ADH 的活性较游离酶均有较大程度的下降,反应速率分别为游离酶体系的12.4%和10.0%,这可能是由于共价反应破坏了酶分子部分活性位点,从而导致固定化酶活性降低。
然后,在15~40℃范围内,考察了反应温度对固定化ADH 和游离酶催化性能的影响。由图6(b)可知,游离酶在15℃时反应最快,随着温度提高,反应速率逐渐下降。ADH−PEI/PAA−PE 在15~30℃较宽的温度范围内都有较高的酶活,反应速率均保持在7.5 μmol/(L·min)左右。当反应温度继续升高到35℃和40℃时,反应速率有轻微下降。对于ADH−PAA−PE,当温度从15℃升高到25℃时,反应速率从4.87 μmol/(L·min)迅 速 增 加 到15.6 μmol/(L·min),30℃和37℃时,反应速率有轻微下降;40℃时,反应速率明显下降,仅为25℃时的48.6%。尽管固定化后酶活有较大程度的降低,但与游离酶相比,ADH−PAA−PE 的最适反应温度提高,并且在较宽的温度范围内(20~37℃)均能保持较高的活性,高于部分文献报道(25℃)[12,43]。这说明固定化在一定程度上提高了酶在更高温度下的耐受性,特别是在室温变化范围内,酶活对反应温度的依赖性降低。这是因为酶和载体之间形成的共价键会减少酶分子构象的灵活性和热运动,从而减少酶蛋白的变性失活[44]。
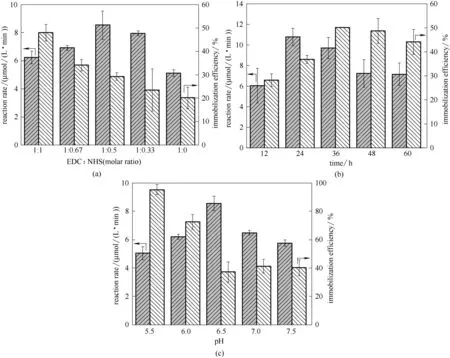
图5 EDC/NHS摩尔比(a)、固定化时间(b)和pH(c)对固定化效率和ADH−PAA−PE催化性能的影响Fig.5 Effects of the molar ratio of EDC and NHS(a),immobilized time(b)and pH(c)on immobilization efficiency and the catalytic performance of ADH−PAA−PE

图6 反应pH(a)、温度(b)对固定化和游离ADH催化性能的影响Fig.6 Effects of pH(a)and temperature(b)in the reaction on the catalytic performance of immobilized and free ADH
2.5 固定化酶的重复利用性
固定化酶的重复利用性对其工业化应用至关重要。以ADH−PAA−PE 的初始酶活为100%,分别考察了两种固定化ADH 的重复利用性。由图7 可知,ADH−PEI/PAA−PE 经过10 次循环后,酶活保持在47.3%左右,ADH−PAA−PE 在重复使用5 次和10次后,保留活性为75.6%和53.8%,高于大部分使用有机材料作为载体时的重复利用性[15,19,45]。活性的部分损失可能是由于经过多次洗涤和重复利用后,酶分子构象发生变化或者席夫碱分解导致酶从载体上脱落[46]。
3 结 论
(1)FTIR 和SEM 结果表明成功制备了PAA−PE和PEI/PAA−PE膜。
(2)PEI/PAA−PE 固定化ADH 的最优条件为:pH 为6.0,温度为5~15℃,酶浓度为1.0 mg/ml,GA浓度为0.01%(质量)。
(3)PAA−PE 固定化ADH 的最优条件为:EDC和NHS 摩尔比为1∶0.5,固定化时间为24 h,pH为6.5。
(4)两种固定化ADH 的最适反应pH 均为6.5,与游离酶相同;在同样反应条件下,ADH−PAA−PE的催化性能优于ADH−PEI/PAA−PE,原因可能是EDC/NHS 法反应条件更温和。尽管固定化后酶活有较大程度的降低,但与游离酶相比,固定化ADH的最适反应温度提高,并且在较宽的温度范围内均能保持较高的活性。
(5)重复利用10 次后,ADH−PAA−PE 和ADH−PEI/PAA−PE分别保留了53.8%和47.3%的活性。
