环氧化物水解酶交联细胞聚集体催化合成(R)-环氧氯丙烷
2020-09-29邹树平姜镇涛王志才柳志强郑裕国
邹树平,姜镇涛,王志才,柳志强,郑裕国
(浙江工业大学生物工程学院手性生物制造国家地方联合工程研究中心,浙江杭州310014)
引 言
手性环氧氯丙烷是重要的C3合成子,其中(S)−环氧氯丙烷((S)−ECH)是降血脂药物阿托伐他汀、降血压药物卡维地洛等医药的前体[1];(R)−环氧氯丙烷((R)−ECH)是治疗心绞痛药物美托洛尔和减肥药物肉毒碱合成的关键中间体[2−3]。近年来,环氧氯丙烷生产工艺趋于成熟,规模逐年扩大,成本和价格持续走低[4],因此,利用消旋体环氧氯丙烷制备手性环氧氯丙烷具备巨大的经济效益与可行性[5−7]。环氧化物水解酶(epoxide hydrolase, EC 3.3.2.3),广泛存在于自然界中,该酶可以将消旋体环氧化物立体选择性水解生成手性环氧化物及相应的邻二醇[8]。由于反应条件温和、立体选择率高、环境友好等优势,酶法催化合成手性环氧氯丙烷受到广泛关注[9−11](图1)。
生物催化剂在实际应用时,往往存在操作稳定性差、难以重复使用、使用成本高等问题,而这些问题通常可通过细胞或酶的固定化得到解决[12−13]。目前,大部分关于环氧化物水解酶固定化主要通过海藻酸钙[14]、环氧树脂[15]、DEAE−cellulose[16]、磁性纳米颗粒[17]等进行固定化,这些方法实现了环氧化物水解酶热稳定性和操作稳定性一定程度的提高,但仍存在一些缺点,如固定化颗粒机械强度低、传质阻力高、非催化功能的载体占比大等。交联细胞聚集体(CLCAs)是利用絮凝−交联技术将全细胞固定化的一种新方法,具有操作简单、成本低、细胞活力回收率高、比活性高、操作稳定性好等优点[18−19],具有巨大的工业应用潜力。
本实验室在前期将放射形农杆菌环氧化物水解酶基因在大肠杆菌BL21(DE3)中高效表达[20],对环氧化物水解酶进行迭代饱和突变,获得了立体选择性和催化效率大幅度提高的环氧化物水解酶突变体I108L/D131S/T247K[21],并通过建立两相催化体系克服了底物的自发水解。本研究以重组表达环氧化物水解酶突变体的重组大肠杆菌BL21(DE3)为全细胞催化剂,建立了环氧化物水解酶交联细胞聚集体的制备方法,并利用环氧化物水解酶交联细胞聚集体催化合成(R)−ECH,旨在为手性环氧氯丙烷的生物制造新技术开发提供指导。
1 实验材料和方法
1.1 材料
1.1.1 菌种和试剂 本实验所用菌株为实验室已构建的基因工程菌E.coli BL21(DE3)/pET28b−EH I108L/D131S/T247K[21]。50%聚乙烯亚胺(PEI)购自上海晶纯生化科技股份有限公司。海藻酸钠、聚乙烯醇(分子量10000)、卡拉胶、25%戊二醛(GA)、硅藻土等试剂与原材料均为市售。异辛烷为市售分析纯。卡那霉素和异丙基硫代−β−D−半乳糖苷(IPTG)购于Sigma公司,酵母粉、蛋白胨购自OXOID公司,(R,S)−ECH(分析纯)、(S)−ECH(98%)、(R)−ECH(98%)、3−氯−1,2−丙二醇(97%)均购于阿拉丁公司。除特别注明的试剂外,其他实验试剂均为国产分析纯。
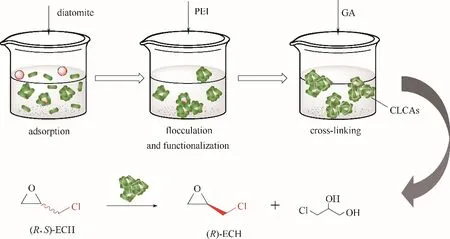
图1 环氧化物水解酶交联细胞聚集体的制备过程及催化合成(R)−ECHFig.1 Preparation process of cross−linked cell aggregates of epoxide hydrolase and its application for the synthesis of (R)−epichlorohydrin
1.1.2 培养基 LB 培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,LB 固体培养基中含1.8%琼脂。高压灭菌条件为121℃,20 min。
1.2 方法
1.2.1 环氧化物水解酶全细胞的制备 将活化后的环氧化物水解酶工程菌按2%(体积)的接种量接入装有100 ml LB 培养基的500 ml 锥形瓶中,置于37℃、200 r/min 摇床振荡培养,当培养液的OD600达到0.6~0.8时,加入终浓度为0.5 mmol/L的IPTG作为诱导剂,28℃诱导10 h,离心收集菌体,−20℃保存。
1.2.2 交联细胞聚集体(CLCAs)的制备 10 g 湿细胞加入100 ml 磷酸盐缓冲液中(pH=7.0, 100 mmol/L)配成菌悬液,将500 g/L PEI 按质量比稀释10 倍,加入6 g/L 硅藻土搅拌30 min,再加入1%(体积)PEI进行絮凝,搅拌30 min 后静置10 min,然后加入1%(体积) GA 进行交联反应,搅拌30 min,最后通过真空抽滤回收,用0.9%生理盐水洗涤三次,抽滤后滤饼保存于4℃冰箱中备用。
1.2.3 活力的测定 环氧化物水解酶全细胞活力测定采用气相色谱进行测定,10 ml反应体系中加入100 mmol/L(R,S)−ECH,适量的游离细胞或固定化细胞以及磷酸盐缓冲液(200 mmol/L,pH 8.0),35℃下180 r/min 振荡器反应5 min,后取样200 μl 于800 μl乙酸乙酯中萃取,取有机相无水硫酸钠干燥后,进行气相检测。活力单位(U)定义:在35℃、pH 8.0 条件下,在1 min 内催化1 μmol ECH 水解所需要的酶量定义为1 U;比活力(U/g)定义为每克干重的细胞具有的总活力单位。固定化细胞的活力回收率计算公式如下:

1.2.4 交联细胞聚集体催化合成(R)−ECH 一定比例异辛烷/磷酸盐缓冲液(pH8.0)两相体系40 ml,加入干重0.72g CLCAs混匀,35℃保温10 min后加入一定浓度(R,S)−ECH,搅拌反应40 min,期间取样200 μl 加入800 μl 乙酸乙酯萃取,取有机相用无水硫酸钠干燥后进行气相检测。
1.2.5 分析方法 手性ECH 分析方法:采用日本岛津气相色谱仪GC−14A 系统,色谱柱类型:BGB−175毛细管柱(30 m×0.25 mm×0.25 μm)。色谱条件:柱温90℃,进样室温度220℃,FID 检测器220℃,保留7 min,载气为He,流量为1.6 ml/min,分流比1∶40,保留时间:(S)−ECH 5.1 min,(R)−ECH 5.3 min。
2 实验结果与讨论
2.1 细胞固定化方法的筛选
为了筛选环氧化物水解酶全细胞最适合的固定化方法,研究了4种不同的细胞固定化方法,涉及包埋法和絮凝−交联法。测定了细胞活力回收率,以及循环5 次后全细胞的残余活力。结果如表1所示。
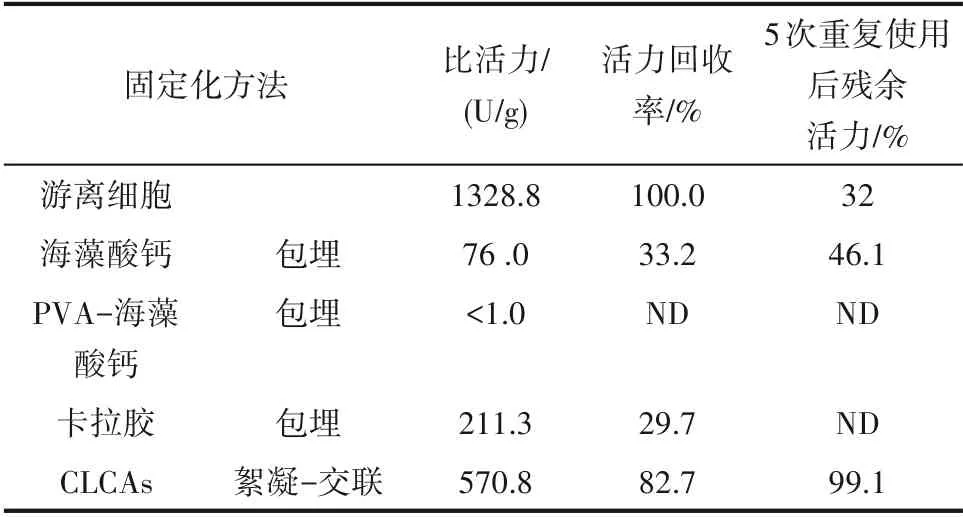
表1 固定化方法的筛选Table 1 Screening of immobilization method
表1结果显示,利用絮凝−交联法制备的CLCAs活力回收率高达82.7%,且固定的细胞结合致密,不易脱落,循环5次后活力几乎不损失,这和其他交联法 固 定 化 细 胞 Bacillus subtilis ZJB−063 和Arthrobacter nitroguajacolicus ZJUTB06−99 研究结果相符[22−23]。然而,采用海藻酸钙、聚乙烯醇−海藻酸钙以及卡拉胶包埋的全细胞活力回收率普遍较低,甚至未表现出明显活力,说明包埋法可能不适合该环氧化物水解酶全细胞的固定化,本实验室前期研究也证明海藻酸钙包埋的效果一般[24]。
2.2 交联细胞聚集体制备条件优化
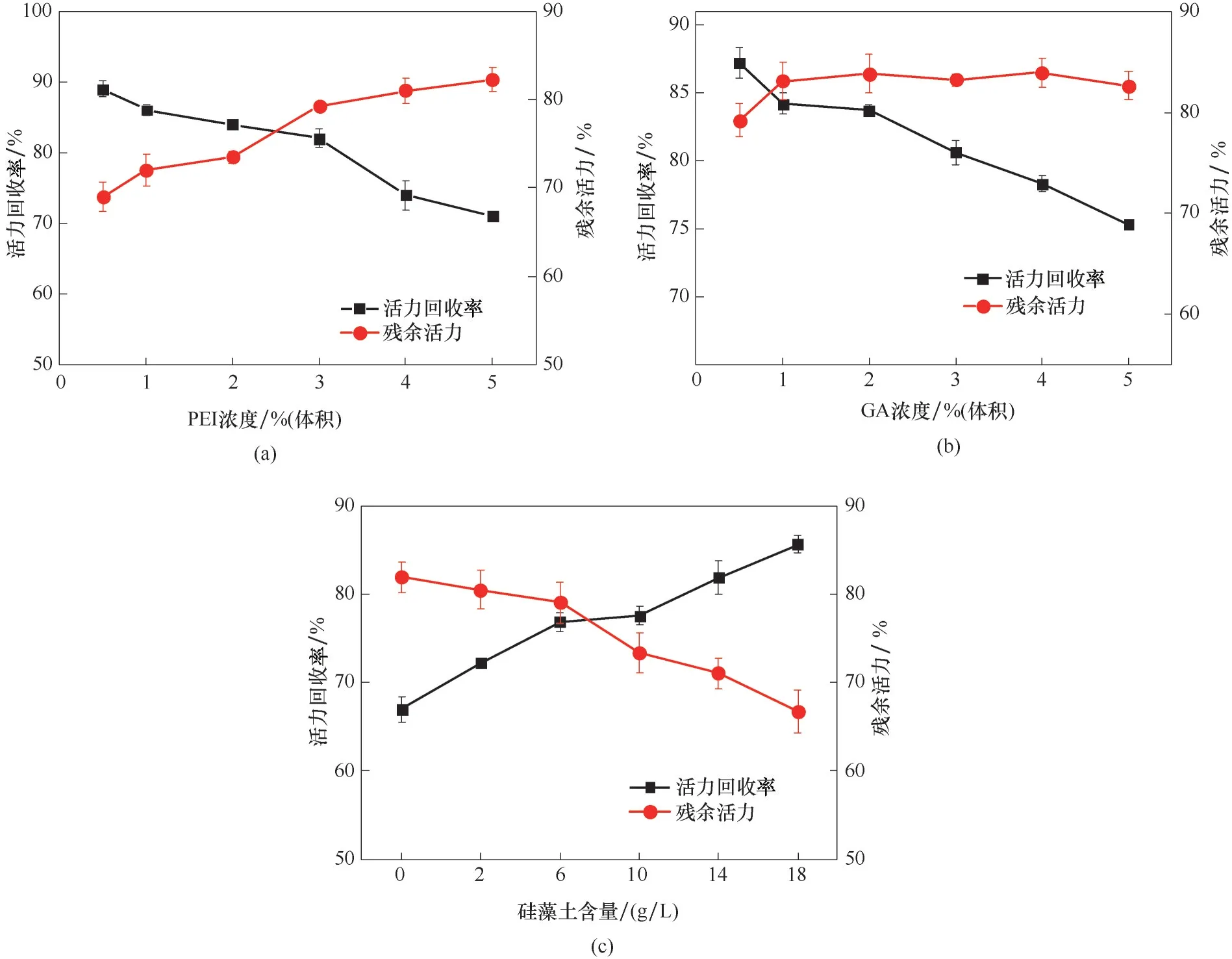
图2 交联法固定化过程中PEI(a)、GA(b)、硅藻土(c)用量的优化Fig.2 Optimization of PEI(a),GA(b)and diatomite(c)concentration in the process of cross−linking immobilization
制备交联细胞聚集体时,对催化能力影响较大的因素一般为絮凝剂、交联剂和载体的用量[22−23],因此,对交联细胞聚集体制备过程中的PEI、GA 和硅藻土用量进行优化。如图2 所示,考察了交联细胞聚集体活力回收率和操作稳定性。随着PEI 和GA浓度增加,细胞活力回收率降低,操作稳定性提高[图2(a)、(b)],由于细胞经过PEI 和GA 的交联后,固定化颗粒表面包裹一层红色的聚合物膜,且该膜致密度以及机械强度随PEI、GA 浓度增加而增大,与此同时会造成传质阻力增大[25−26]。综合考虑,选择3%(体积)PEI,1%(体积)GA 为最佳浓度。硅藻土不仅具有吸附和抗溶胀效果,还具有塑形、助滤和改善固定化颗粒传质特性的作用,并且价格相对较低[27]。当以硅藻土为载体时,随着硅藻土质量分数的增加固定化细胞活力回收率增加,而机械强度下降[图2(c)],综合考虑,选择6 g/L 的硅藻土为最适添加量。在PEI浓度、GA 浓度及硅藻土载体用量分别为3% (体积)和1%(体积)和6 g/L 条件下,交联细胞聚集体活力回收率可达88.4%。
2.3 两相中环氧化物水解酶交联细胞聚集体催化合成(R)-ECH
由于环氧化物对生物催化剂有毒害作用,且化学性质活泼,在单一水相中易发生自发水解反应,导致反应效率不高,而应用有机溶剂/缓冲液两相体系能够克服这一缺点[28−30]。根据实验室前期关于有机溶剂对环氧化物水解酶催化反应的影响研究结果[31],确定了异辛烷/磷酸盐缓冲液为最佳的两相体系。本文中进一步研究了两相体系的异辛烷比例和底物负载量。如图3(a)所示,随着反应体系中异辛烷含量的增加,活力逐步提高并在异辛烷含量为30%时达到最高,后迅速降低。这主要是由于:一方面,异辛烷的添加导致大部分底物分配于有机相中,在水相中保持较低的浓度,减少了底物对水相中菌体的毒害作用。另一方面,高浓度异辛烷会对细胞产生毒性,导致活力降低甚至失活[31]。因此,确定两相体系中异辛烷/磷酸盐缓冲液的最佳比例为3∶7。由于非天然的有机底物(R,S)−ECH 对细胞有一定毒害性[32],有必要考察底物浓度对生物催化反应的影响。如图3(b)所示,当底物浓度小于800 mmol/L 时,(R,S)−ECH 转化完全,(R)−ECH 的ee 值都能达到99%以上,而进一步提高底物浓度,(S)−ECH不能被完全水解,(R)−ECH 的ee值迅速降低,这可能是因为高有机底物浓度对细胞有毒害作用,从而对ECH的水解存在抑制作用[31]。
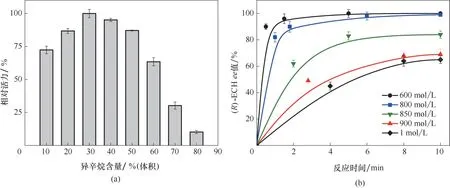
图3 两相体系中反应参数对(R)−ECH合成的影响(a)异辛烷比例对细胞活力的影响;(b)底物浓度对(R)−ECH ee值的影响Fig.3 Effect of reaction parameters on(R)−ECH synthesis in biphase system(a)effect of isooctane ratio on cell activity;(b)effect of substrate concentrations on ee of(R)−ECH
为了进一步提高催化效率、保证产物光学纯度,在反应进程中补加全细胞催化剂已被证明是可行的策略[33]。因此尝试通过补加CLCAs的方式提高底物负载和催化效率。如图4 所示,在800 mmol/L底物浓度下催化反应进程曲线显示(S)−ECH 在2 min 左右被反应完全,此时(R)−ECH 剩余361 mmol/L,收率为45.2%[图4(a)]。进一步提高底物浓度至1 mol/L,(R)−ECH ee 值为70%左右[图4(b)];间歇补加干重0.5g 的CLCAs 后,反应进行到15 min 时(R)−ECH ee 值可达100%,收率为32%左右[图4(c)]。连续流加干重0.5g 的CLCAs 后,反应进行到30 min 时(R)−ECH ee 值可达100%,收率约为31%[图4(d)]。可以看出,底物浓度提高至1mol/L 后通过补加催化剂可使(R)−ECH ee 值达到100%,但收率明显下降。补加的CLCAs 活力仅为初始CLCAs 的35%。进一步分析发现,细胞补加前副产物3−氯−1,2−丙二醇(3−MCP)浓度积累到520 mmol/L(其中(S)−3−MCP约410 mmol/L;(R)−3−MCP 约110 mmol/L)。可能存在的产物抑制导致菌体活力下降,较高浓度(S)−3−MCP 抑制残余的(S)−ECH 水解,而(R)−ECH 所受抑制并不明显,进而缩小了两种构型底物反应速率,最终导致(R)−ECH收率下降。
为了验证是否存在产物抑制,研究了不同3−MCP 浓度对活力的影响和3−MCP 存在时对反应进程的影响。如图5(a)所示,相比于对照组,添加3−MCP的菌体活力显著降低,且随着3−MCP 浓度增加至300 mmol/L,活力大幅下降。图5(b)展示了副产物存在时对催化反应进程的影响。以1 mol/L(R,S)−ECH 反应后的上清液(包含395 mmol/L (R)−ECH,90 mmol/L(S)−ECH 和515 mmol/L 3−MCP)[反应(1)]和人工配制的395 mmol/L (R)−ECH,90 mmol/L (S)−ECH 混合液[反应(2)]为底物,进行反应,可以发现反应(2)中(S)−ECH 被迅速消耗殆尽,(R)−ECH ee 值在1 min 内即达到100%,而在含有产物3−MCP 的反应(1)中,初始反应速率不到反应(2)的1/3,(R)−ECH ee 值在12.5 min 时才达到99%,从而证实催化反应存在不可忽视的产物抑制问题。
综上所述,在两相中环氧化物水解酶交联细胞聚集体催化合成(R)−ECH 的体系中,在异辛烷与缓冲液的体积比3∶7,底物浓度800 mmol/L,CLCAs 加入量18 g/L,缓冲液pH 8.0,温度35℃条件下,(R)−环氧氯丙烷的摩尔产率可达到45.2%,产物光学纯度为99.1%ee。与已报道的生物法合成(R)−ECH 研究[10,24,29,34−35]相比,本研究建立的800 mmol/L 底物浓度和45.2%的(R)−ECH收率均已处于较高水平。
2.4 CLCAs的操作稳定性
在异辛烷/磷酸盐缓冲液两相体系中,(R,S)−ECH浓度800mmol/L,添加干重18 g/L CLCAs进行反应,反应结束后对CLCAs进行抽滤回收,添加新鲜底物与有机溶剂进行下一批反应,如图6所示,CLCAs在9个循环使用后活力几乎不损失,且(R)−ECH的ee值均能达到99%。由于反应过程中机械搅拌且高底物浓度底物易导致游离细胞破损,在8000 r/min条件下离心10 min回收细胞时泄漏的环氧化物水解酶导致活力损失,因此游离细胞循环使用4次后,活力仅为初始的30%。因此,CLCAs显著提高了细胞的机械强度,显示了良好的操作稳定性[12]。
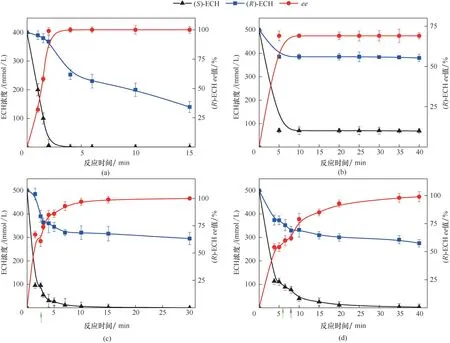
图4 两相体系中交联细胞聚集体催化合成(R)−ECH反应进程曲线(a)800 mmol/L底物浓度;(b)1 mol/L底物浓度;(c)1mol/L底物浓度下间歇补加CLCAs;(d)1 mol/L底物浓度下连续流加CLCAs;绿色箭头为开始补加,紫色箭头为结束补加Fig.4 Reaction process of the synthesis of(R)−ECH catalyzed by CLCAs in biphase system(a)substrate concentration at 800 mmol/L;(b)substrate concentration at 1 mol/L;(c)substrate concentration at 1 mol/L with intermittent CLCAs addition;(d)substrate concentration at 1 mol/L with continuous CLCAs addition;the green arrow is the start of CLCAs addition and the purple arrow is the end of CLCAs addition
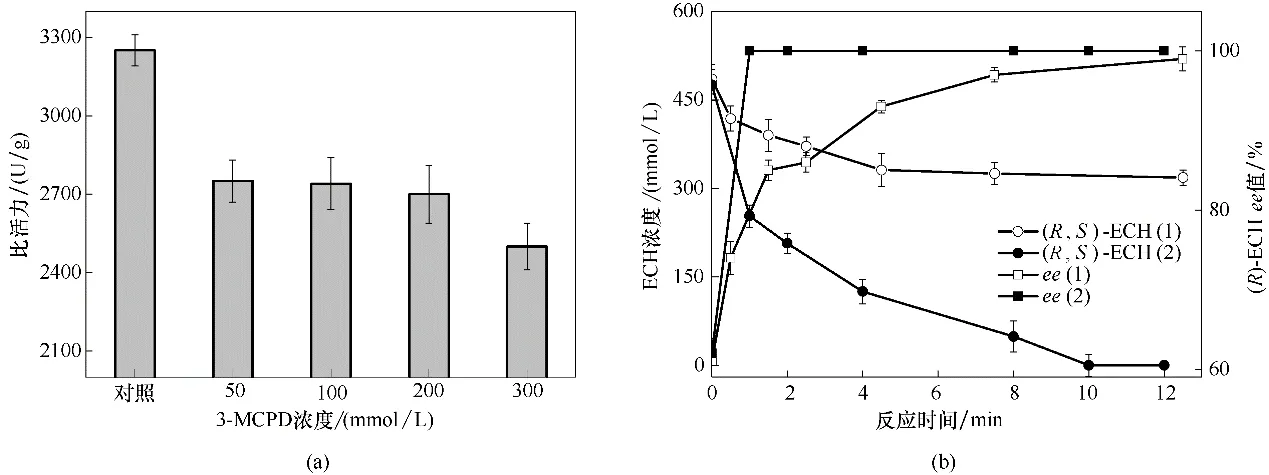
图5 副产物3−氯−1,2−丙二醇对催化反应的影响(a)3−氯−1,2−丙二醇浓度对酶活力的影响;(b)副产物3−氯−1,2−丙二醇存在时对(R)−ECH合成反应进展的影响Fig.5 Effect of 3−chloro−1,2−propanediol on the catalytic reaction(a)effect of 3−chloro−1,2−propanediol concentration on enzyme activity;(b)effect of 3−chloro−1,2−propanediol on the reaction process of the synthesis of(R)−ECH

图6 交联细胞聚集体与游离细胞的反应批次Fig.6 Recycling batch of CLCAs and free cells
3 结 论
本文以重组环氧化物水解酶大肠杆菌工程菌为研究对象,建立了交联细胞聚集体的制备方法,最佳制备条件为PEI 3%(体积)、GA 1%(体积)、硅藻土6 g/L,该条件下细胞表面的交联网络密度合适,兼顾了机械强度和传质速率,活力回收率可达到88.4%。同时开发了异辛烷/磷酸缓冲液两相体系,异辛烷对底物溶解能力强,两相体系缓解了底物ECH 在水相的自发水解,减轻了细胞在水相中受到的底物抑制和毒害,最大底物负载达到800 mmol/L。利用CLCAs 进行催化合成(R)−ECH 反应,(R)−ECH 浓度达到361 mmol/L,产物收率为45.2%,ee 值均>99%,交联细胞聚集体表面聚合物网络有效提高了细胞操作稳定性,重复使用9批次后,活力基本不变。CLCAs 具有优越的催化性能,操作稳定性好,具有良好的工业化应用前景。
