高稳定双金属MOF材料用于低浓度乙烷的高效分离
2020-09-29刘普旭贺朝辉李立博李晋平
刘普旭,贺朝辉,李立博,3,李晋平
(1 太原理工大学化学化工学院,山西太原030024; 2 气体能源高效清洁利用山西省重点实验室,山西太原030024;
3 太原理工大学煤科学与技术重点实验室,山西太原030024)
引 言
乙烯(C2H4)作为一种十分重要的化工产品,其产量是衡量一个国家石油化工发展水平的标志。同时,乙烯是石油化工产业中重要的化工基础原料,广泛用于生产聚乙烯、聚氯乙烯、乙二醇等精细化学品[1]。在巨大的需求下,C2H4产量逐年递增。截至2018 年,我国C2H4产量达到1800 多万吨,但仍有257 万吨依赖进口,增加C2H4产量,势在必行[2]。传统C2H4生产工艺包括蒸汽裂解、催化裂化、煤制烯烃、烷烃脱氢等方式[3−5],众多生产工艺得到的产品气中多混有乙烷(C2H6)气体,为了达到聚乙烯产品的纯度要求,常需要对生产所得到的C2H6与C2H4混合气进行分离。然而,由于C2H6与C2H4两组分物理性质接近,且具有相似的动力学尺寸(4.44 Å 和4.16 Å,1 Å=0.1 nm)[6],因此使得C2H6和C2H4两组分分离异常困难[7]。
当前,C2H6和C2H4的两组分分离主要依赖于低温精馏,通过利用两组分沸点(196 K 和185 K)之间的差异,在超过120级塔板、−50℃、0.7~2.8 MPa的操作条件下进行精馏分离[8],存在设备投资成本高、能耗大等问题。基于多孔吸附材料的吸附分离技术因其具有投资小、操作简便等优点被广泛研究,并取得了显著进展[9]。金属有机骨架材料(MOFs)相比沸石分子筛、活性炭等传统吸附剂具有结构多样、比表面积大等特点,在显著提高气体吸附容量的同时,还显示出高度的结构可调节性。通过改变配体的结构从而改变孔道的大小,或植入不饱和金属空位点(OMS),均可增强骨架对于目标气体分子的吸附作用,因此在气体吸附分离领域显示出巨大潜力[10−22]。就C2H6和C2H4吸附分离而言,研究报道的多数MOF 材料为C2H4选择性吸附剂,即在两组分混合气下优先选择性吸附C2H4,从而实现两组分的吸附分离[23−29]。然而,在使用C2H4选择性吸附剂进行两组分吸附分离时,仍会有少量C2H6气体同时发生吸附,需要经过多次吸脱附抽真空再生过程才能够得到满足纯度要求的C2H4气体[30]。针对此过程,优先吸附C2H6的材料更具优势,低含量杂质气体C2H6经一步吸附分离便可得到满足聚合要求的C2H4气体,不仅提高了C2H6/C2H4的分离效率,而且降低了分离成本[31]。Gu¨cu¨yener 等[32]在2010 年首次报道了选择性吸附C2H6的ZIF−7 材料,该材料利用两组分气体开口压力的不同,能够在室温下选择性吸附C2H6大于C2H4。2015 年Liao 等[30]设计合成了含有丰富氢键供体的MAF−49 超微孔材料,孔道中的N 原子通过多重氢键相互作用实现了C2H6的优先吸附,具有良好的分离效果。随后,Wang 等[33−34]的研究表明Ni(bdc)(ted)0.5与PCN−250 能够通过骨架与C2H6和C2H4气体分子范德华力大小的差异进行选择性吸附C2H6,从而实现了C2H6和C2H4的有效分离。2018年,Lin 等[35]采用Cu(Qc)2作为吸附剂,利用低极性的芳香环所占据的孔道可优先结合C2H6分子,显示出良好的C2H6/C2H4吸附选择性。2018 年,本课题组[36]合成并报道了具有优异C2H6选择性吸附性能的Fe2(O2)(dobdc)材料,该材料通过在OMS 上构筑过氧位形成了C2H6特异性吸附位点,表现出优异的C2H6和C2H4反转吸附分离性能,实现了C2H6和C2H4的高效分离。
对于分离C2H4混合气中低浓度的C2H6,开发具有更高选择性、良好的热稳定性及疏水性的C2H6选择吸附材料成为研究的重点。高价过渡金属与配体之间具有较强的配位键,且能够形成紧密排列的多元金属簇,如MIL−100(Cr)[37]、UiO−66[38−40]等材料,因而表现出优于一般材料的高稳定性。因此,本文制备了一种由高价金属钛配位形成的双金属微孔MOF 材 料 MUV−10(Mn) (MUV:materials of universidad de Valencia),并对所制备的样品进行表征和分析,同时详细研究了该材料对于C2H6/C2H4的吸附分离性能。
1 实验材料和方法
1.1 实验原料
四水合氯化锰(MnCl2·4H2O)、N,N−二甲基甲酰胺(DMF)、无水甲醇(CH3OH),分析纯,国药集团化学试剂有限公司;1,3,5−均苯三甲酸(H3BTC),阿拉丁试剂;钛酸异丙酯(Ti(OiPr)4)、冰乙酸(AcOH),北京伊诺凯科技有限公司;纯度高于99.99%的C2H6、C2H4、N2等,太原市福江特种气体有限公司;实验用水为去离子水;实验所需药品均直接用于样品合成,未做任何纯化处理。
1.2 合成及后处理方法
实验采用原始文献报道方法来进行MUV−10(Mn)的合成[41]。将1,3,5−苯三甲酸(H3BTC,125 mg,595 μmol)和MnCl2·4H2O(23.8 mg,120 μmol)加入到25 ml 玻璃小瓶中,然后依次加入12 ml DMF 和3.5 ml CH3COOH 进行溶解,待完全溶解溶液澄清时,加入36 μl Ti(OiPr)4并不停搅拌,搅拌均匀后,将玻璃瓶拧紧密封并置于120℃烘箱中反应48 h。反应结束后,待小瓶冷却至室温,进行过滤,分别用DMF、H2O、CH3OH 等溶剂冲洗3 次,在室温下空气中进行干燥,得到晶体样品。MUV−10(Mn)样品在吸附测试前需进行预处理,将干燥得到的晶体样品用CH3OH 溶剂通过索氏提取器洗涤8 h,以充分去除材料孔道中残留的DMF 溶剂分子,然后活化,进行单组分吸附测试以及混合气体穿透实验。
1.3 结构表征
对于合成的样品,采用配备CuKα(λ = 1.5418 Å)的Bruker D8 ADVANCE 型X 射线衍射仪测试了样品的晶体结构及结晶度,扫描范围2θ = 5°~40°,步长0.02°;采用NETZSCH STA 449F5 型热重分析仪在空气气氛下以10℃/min的升温速率进行了样品的热失重分析,温度范围30~800℃;使用扫描电镜(Japan Hitachi SU8010)观测并确认了所合成样品的形貌;N2吸附测试前,先将经CH3OH 充分洗涤并干燥的样品在100℃动力学真空下脱气活化12 h,然后在77 K 下采用ASAP 3020 吸附分析仪进行了N2吸附 等 温 线 测 试,并 使 用BET(Brunauer−Emmett−Teller)模型计算了MUV−10(Mn)的比表面积。
1.4 吸附测试及计算
C2H6与C2H4单组分吸附等温线测试使用全自动重量法吸附仪(IGA 001,Hiden,UK)进行。在测试之前,将样品在100℃下加热并在真空条件下活化直至样品无进一步明显失重,然后进行吸附测试。C2H6和C2H4两组分吸附等温线测试分别在298 K 和283 K 下进行,压力范围为0~100 kPa,测试点平衡时间为5 min。298 K下单组分气体循环吸附实验与原吸附测试条件保持一致,室温下抽真空进行吸附剂再生。对于298 K 下测得的吸附等温线数据,使用如式(1)所示的单点Langmuir−Freundlich 等温线模型进行拟合

式中,q表示某气体组分的吸附量,mol/kg;qsat表示位点的饱和吸附量,mol/kg;b 表示某气体组分在吸附位点上的单点Langmuir−Freundlich 常数,kPa;v为单点Langmuir−Freundlich 等温线指数;p 为某气体组分的分压,kPa。此外,基于298 K 下单点Langmuir−Freundlich 等温线模型的拟合参数,使用
式(2)所示的理想溶液吸附理论(IAST)计算MUV−10(Mn)对C2H6和C2H4两组分的选择性

式中,Sads为两组分选择性;q1和q2分别为对应测试条件下C2H6和C2H4的平衡吸附量,mmol/g;y1和y2分别为C2H6和C2H4在混合气中的摩尔分数。本文对于C2H6和C2H4选择性是在y1∶y2=1∶9和y1∶y2=1∶15(VC2H6∶VC2H4=1∶9 和1∶15,体积比)、总压为100 kPa下计算所得。
1.5 混合气穿透实验
进行C2H6和C2H4混合气穿透实验之前,将预处理的MUV−10(Mn)样品在100℃并抽真空条件下脱气活化12 h,待冷却至室温,将827 mg 样品装入内径为4 mm、长度为80 mm 的不锈钢吸附柱,选用高纯He 在20 ml/min 的流速下进行吹扫,去除管路中的残留气体。混合气穿透实验采用实验室自制穿透装置,将装有样品的吸附柱固定在恒温加热套中保持恒温,C2H6和C2H4混合气流速通过吸附柱进口处的压力阀及流量计来调节,吸附柱出口尾气采用气相色谱(GC−2014C SHIMADZU,TCD 检测器)实时监测C2H6和C2H4气体浓度,整个实验均在恒温298 K 下进行,C2H6和C2H4混合气流速为2 ml/min。
2 实验结果与讨论
2.1 材料结构及表征
MUV−10(Mn)为一种双金属微孔MOF 材料。如图1(a)所示,Ti 离子六配位,与Mn 离子经µ3−O 连接形成四元金属簇,两金属离子均与水分子配位,常温条件下难以脱除而暴露出金属空位点。该四元金属簇与H3BTC 配位形成如图1(b)所示具有四边形窗口的八面体笼状次级构筑单元,笼腔尺寸约为1.2 nm。相邻次级构筑单元之间通过金属簇顶点进一步连接成如图1(c)所示具有与Cu−BTC 结构相似的三维MOF材料。

图1 MUV−10(Mn)在[001]方向的结构图Fig.1 The view of MUV−10(Mn)structure along[001]direction
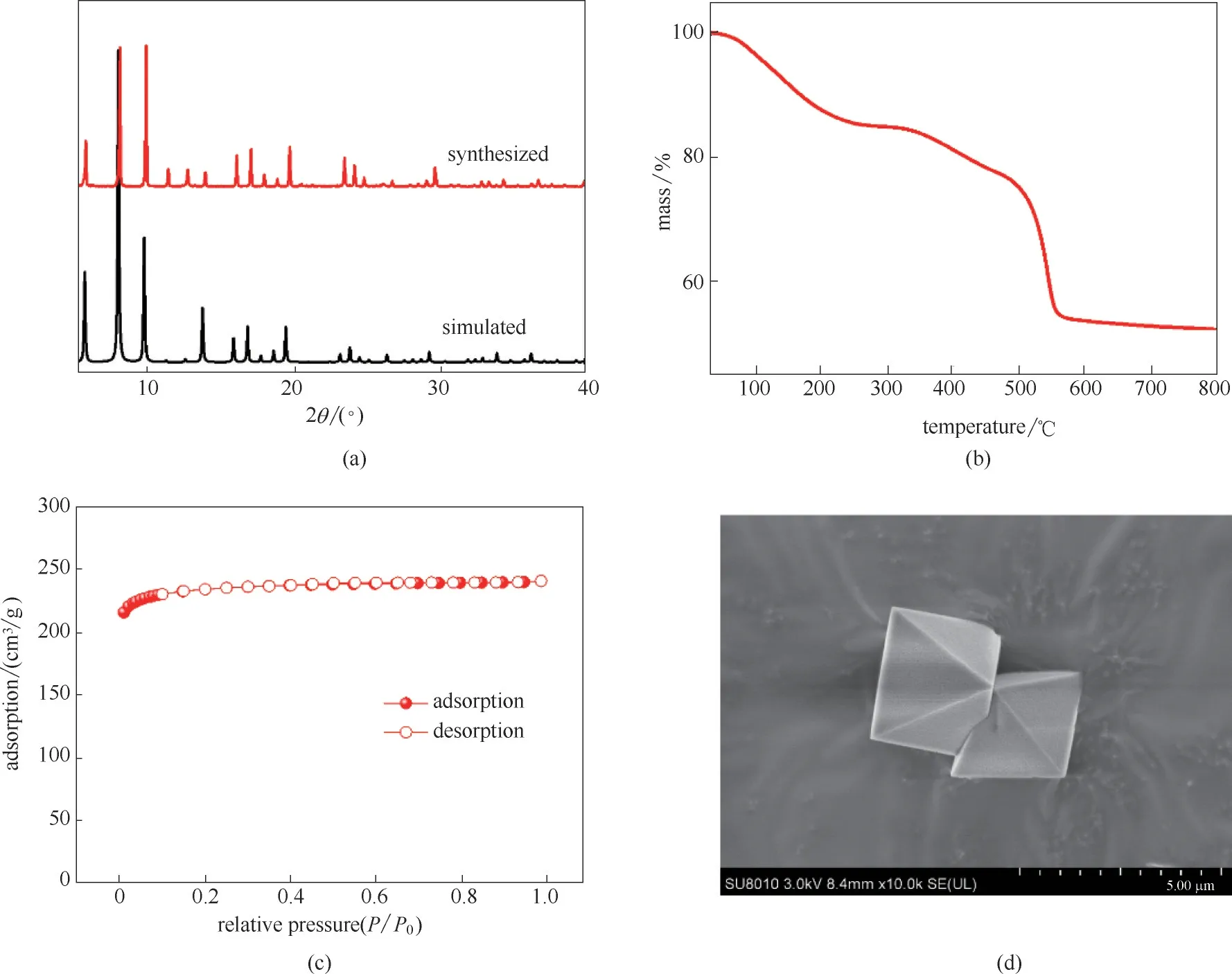
图2 MUV−10(Mn)样品的XRD谱图(a)、TGA曲线(b)、N2吸附等温线(c)和SEM图片(d)Fig.2 XRD pattern(a),TGA curve(b),N2 sorption isotherm(c)and SEM image(d)of MUV−10(Mn)
合成样品为白色晶体粉末,其粉末X 射线衍射图谱如图2(a)所示,从图中可以看出所合成样品的衍射峰与MUV−10(Mn)的模拟衍射峰位置一致,表明成功合成了MUV−10(Mn)材料。图2(b)为MUV−10(Mn)的热重分析曲线,从图中可以看出,样品在加热过程中存在三个失重过程。第一阶段失重在30~200℃发生,是脱除孔道中的CH3OH 溶剂分子所致。随着温度逐渐升高,金属上的配位H2O 分子逐渐逃逸,在350~450℃缓慢发生第二阶段失重。当温度达到500℃时,骨架结构逐渐坍塌,残留固体为TiO2和Mn2O3。在250~300℃之间样品不发生明显失重,表明MUV−10(Mn)具有良好的热稳定性。样品在77 K 下的N2吸附等温线如图2(c)所示,其N2吸附为典型的I 型吸附等温线,说明该材料为微孔材料,计算得到MUV−10(Mn)的BET 表面积为750 m2/g。为了探究MUV−10(Mn)晶体尺寸大小,使用扫描电镜进行了样品的形貌观测,如图2(d)所示,MUV−10(Mn)晶体粒径均匀、形貌规整,均为八面体形貌,大小约为3 μm。
2.2 气体吸附测试
N2吸附等温线表明MUV−10(Mn)为典型的微孔材料且具有较高的比表面积,虽然其孔腔大小比C2H6和C2H4气体分子动力学直径大,但该材料中独特的孔道环境以及关闭的金属空位点为C2H6选择性吸附提供了可能,因此本文测试并研究了MUV−10(Mn)对C2H6和C2H4的气体吸附性能(图3)。如图3(a)所示,MUV−10(Mn)在两测试温度下均表现出选择性吸附C2H6大于C2H4的性能,其C2H6吸附量在283 K、105Pa 下为80 cm3/g,相比其他C2H6选择性吸附剂具有较高的吸附容量,且室温下抽真空脱附曲线与吸附等温线完全重合,说明该材料容易再生。为预测其C2H6/C2H4混合物分离性能,使用单点Langmuir−Freundlich 等温线模型对该材料在298 K下的C2H6和C2H4吸附数据进行了拟合,拟合结果如图3(d)(1 bar=0.1 MPa)所示,可以看出,吸附数据与拟合曲线重合度较高。基于拟合数据,采用理想溶液吸附理论(IAST)及Clausius−Clapeyron 方程分别计算了MUV−10(Mn)对于C2H6和C2H4两组分气体的选择性及吸附热,如图3(b)、(c)所示,MUV−10(Mn)在298 K 和105Pa 下对于C2H6和C2H4混合气的选择性为1.42,具有一定的分离潜力。MUV−10(Mn)对于C2H6和C2H4吸附热分别为39 kJ/mol 和33 kJ/mol,吸附热处于中等水平,易脱附重生进行多次循环吸附。
2.3 穿透实验
为了评估MUV−10(Mn)对C2H6和C2H4混合气的真实分离效果,在298 K和105Pa下进行了体积比为1∶1、1∶9 和1∶15 的C2H6/C2H4混合气动态穿透实验。三种体积比下,测试所用混合气流速均为2 ml/min。如图4 所示,C2H4气体均首先穿出吸附柱而迅速达到平衡,C2H6则被完全吸附而保留在吸附柱中,经过一段时间后,C2H6吸附饱和逐渐穿出,气体体积分数缓慢上升达到平衡。三种体积比下,C2H6和C2H4混合气的有效分离时间分别为2 min(VC2H6∶VC2H4=1∶1)、8 min(VC2H6∶VC2H4=1∶9)和12 min(VC2H6∶VC2H4=1∶15)。在此时间段内,可以高效去除混合气中的C2H6气体,收集得到高纯度的C2H4产品气,表明MUV−10(Mn)实现了C2H6/C2H4混合气的有效分离。
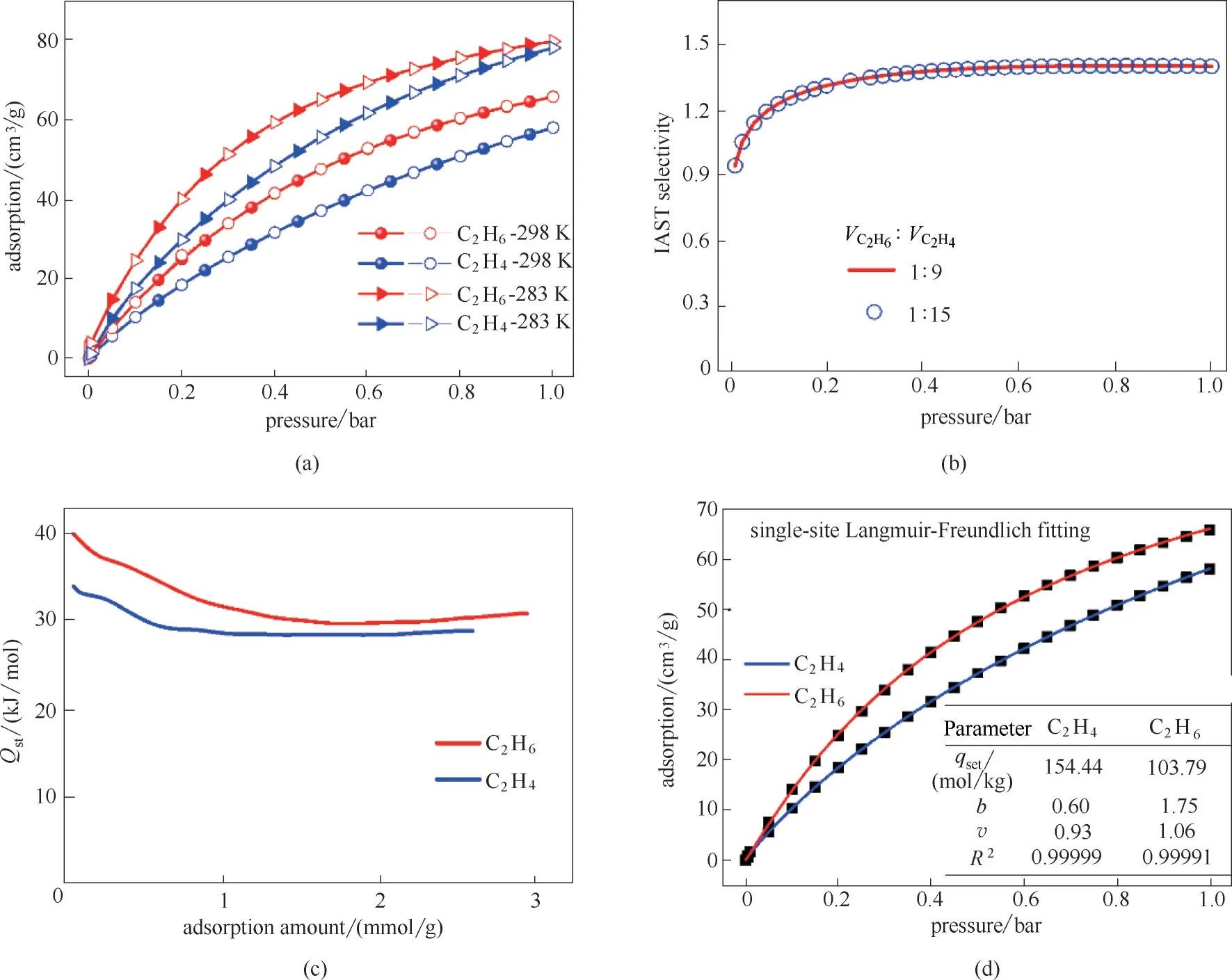
图3 C2H6和C2H4气体吸附等温线(a),IAST选择性(b),C2H6和C2H4吸附热(c),单点Langmuir−Freundlich模型对298 K下C2H6和C2H4气体吸附等温线的拟合(d)Fig.3 Adsorption isotherms of C2H6 and C2H4(a),IAST selectivity(b),adsorption heat of C2H6 and C2H4(c),fitting curves of C2H6 and C2H4 adsorption isotherms at 298 K based on the single−site Langmuir−Freundlich model(d)
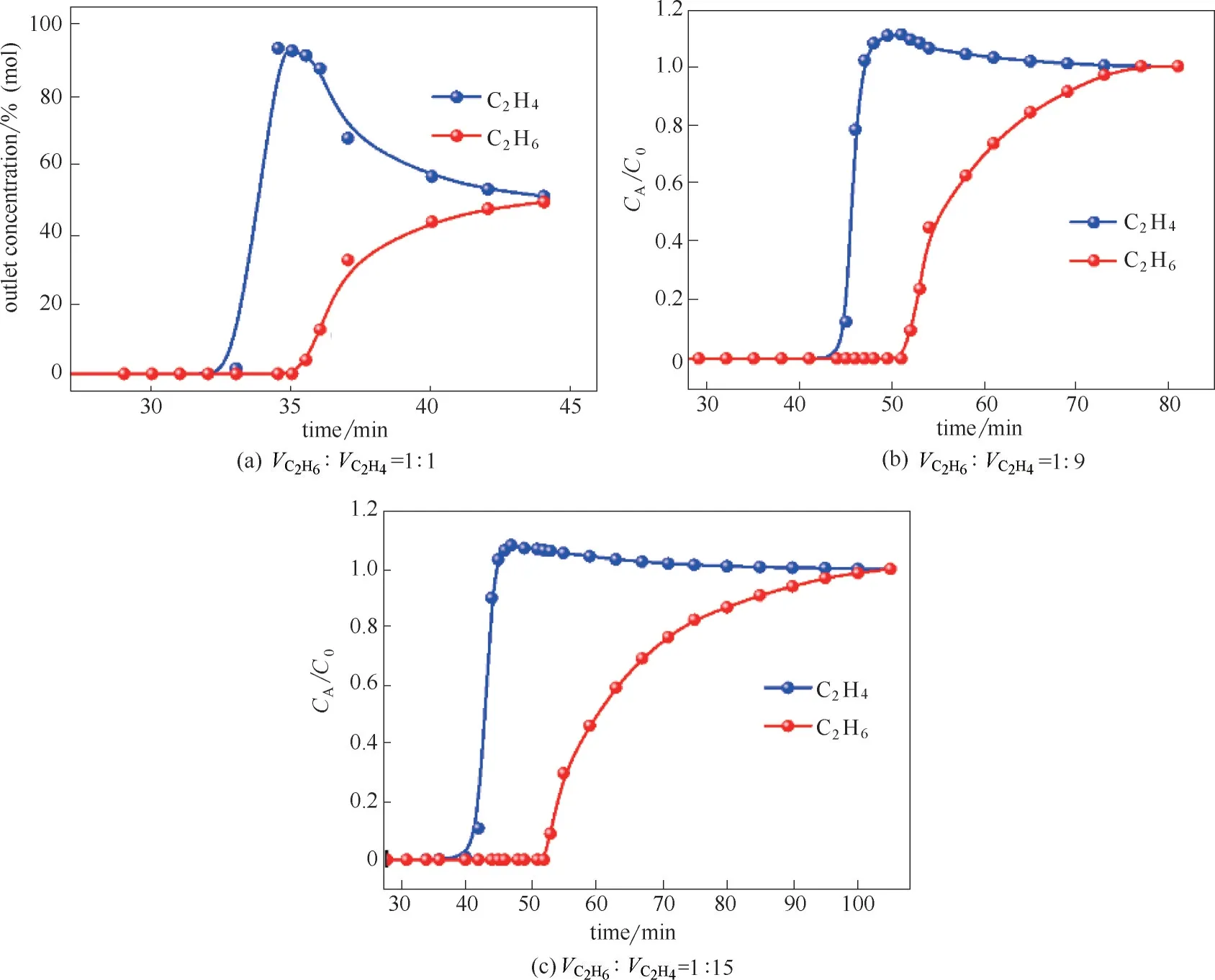
图4 MUV−10(Mn)在298 K和105 Pa下C2H6和C2H4混合气的穿透实验曲线Fig.4 Experimental breakthrough curves of MUV−10(Mn)for C2H6/C2H4 mixture at 298 K and 105 Pa
2.4 稳定性研究
MOF 材料的工业化应用不仅要求材料具有优异的吸附分离性能,材料的稳定性亦尤为重要。对此,进一步研究了MUV−10(Mn)的稳定性。首先,分别对298 K、饱和水蒸气下暴露3 d、不同pH 溶液中浸泡24 h 以及空气中放置5 个月的MUV−10(Mn)样品进行了XRD 表征,从图5(a)、(b)中可以看出,不同实验条件下样品的XRD 衍射峰位置均无明显变化。其次,如图5(c)、(d)所示,在饱和水蒸气下暴露3 d 或空气中放置5 个月及pH=1 和pH=12 处理后的MUV−10(Mn)样品仍能保持初始样品的C2H6和C2H4吸附性能,说明MUV−10(Mn)材料在空气及水蒸气条件下结构与性能完全保持,揭示了该材料优异的酸碱稳定性及水稳定性。此外,在C2H6单组分气体吸附实验中,使用室温下抽真空脱附的方式进行了材料的再生,并测试了该材料的循环吸附性能。结果如图5(e)所示,在298 K 和105Pa 下,MUV−10(Mn)经5次吸脱附循环,吸附等温线无明显差异,说明其再生过程简单,经多次吸附循环而不发生性能损失,有利于工业上循环使用。
3 结 论
(1)使用H3BTC、MnCl2·4H2O 等原料,采用溶剂热法合成了一种具有类似Cu−BTC 结构的双金属微孔MOF 材料MUV−10(Mn),通过XRD、SEM、BET、TGA等表征手段确认了所合成样品的结构与形貌。
(2)在283 K和105Pa下,MUV−10(Mn)的C2H6吸附量为80 cm3/g,相比其他C2H6选择性吸附材料,具有较高的吸附容量,且C2H6吸附热适中,有利于材料再生进行循坏吸附。混合气穿透实验表明,MUV−10(Mn)能 够 高 效 去 除C2H6和C2H4混 合 气(VC2H6∶VC2H4=1∶9 和VC2H6∶VC2H4=1∶15)中的低浓度杂质气体C2H6,一步分离得到高纯C2H4气体。此外,循环吸附及酸碱、水等测试表明该MOF 材料具有优异的结构稳定性,具有工业化应用潜力。
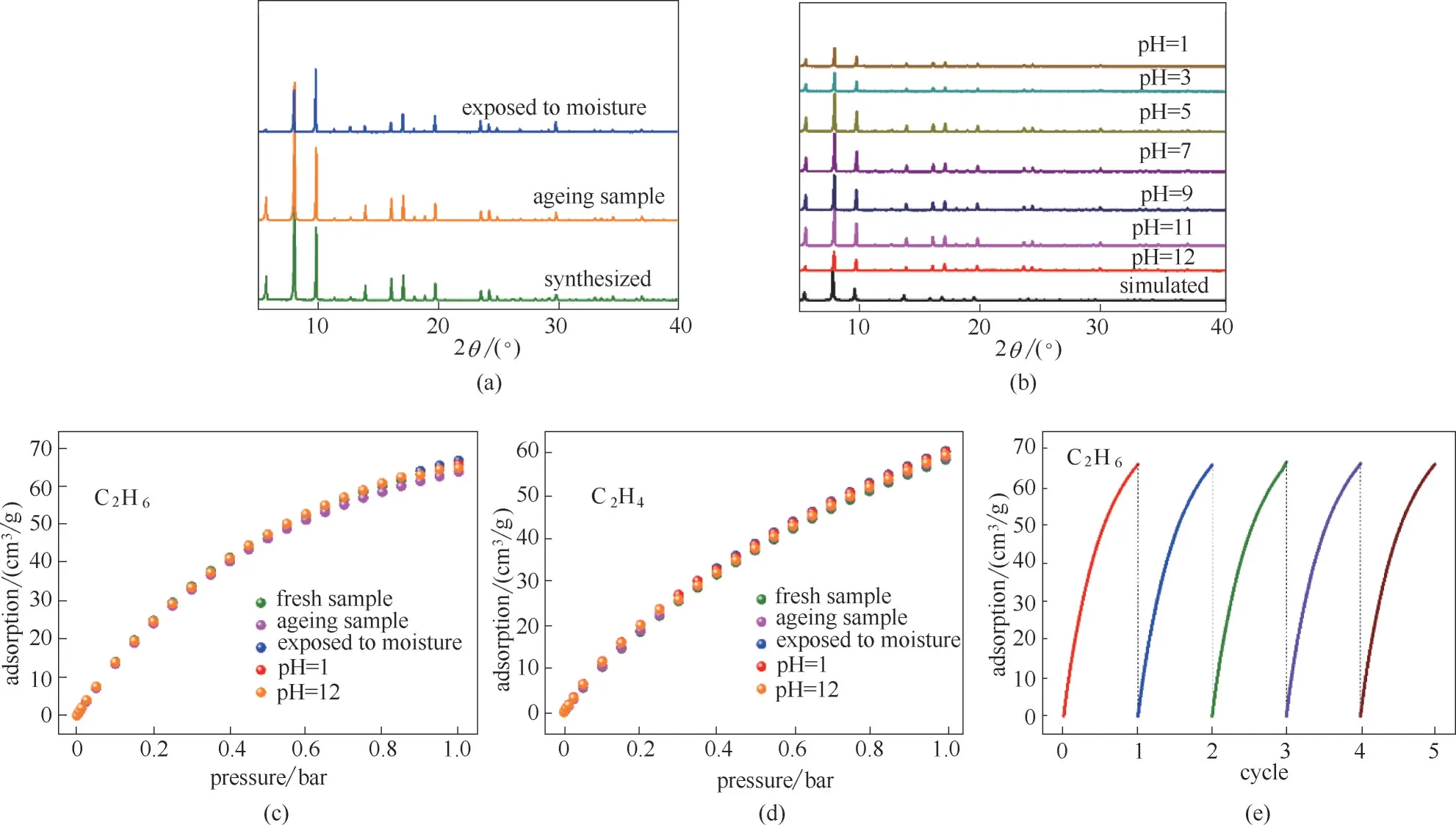
图5 MUV−10(Mn)在不同实验条件下的XRD图[(a)、(b)]及对应样品在298 K和105 Pa下的C2H6和C2H4循环吸附等温线[(c)~(e)]Fig.5 XRD patterns[(a),(b)]and corresponding adsorption isotherms for C2H6 and C2H4 at 298 K and 105 Pa[(c)—(e)]of MUV−10(Mn)under different experimental conditions
