咳喘宁对RSV诱导哮喘大鼠的治疗作用及对IL-33表达的影响①
2020-09-29罗银河王孟清陈兴宇黄凯玲王润霞江智豪常晨阳
孙 乐 罗银河 王孟清 陈兴宇 李 艳 黄凯玲 王润霞 江智豪 常晨阳
(湖南中医药大学,长沙 410000)
支气管哮喘(bronchial asthma)是一种以气道慢性炎症为特征的异质性疾病,由多种炎症细胞和细胞组分参与,其特征为反复发作,随病程延长可产生气道不可逆性缩窄、气道重塑等病理改变,急性严重发作时可危及生命。呼吸道合胞病毒(respiratory syncy-tial virus,RSV)是临床常见的下呼吸道感染病原体,可引起RSV相关性哮喘[1]。研究发现,哮喘的发生发展是一个复杂的免疫反应,IL-33是 IL-1 细胞因子家族成员,在免疫反应中具有启动作用[2-4]。临床研究发现哮喘急性发作患者血清中IL-33明显增高,且与肺功能相关指标数值呈负相关[5];此外,IL-33还能促进激素抵抗哮喘儿童肺组织纤维细胞胶原的表达,全程参与RSV诱导哮喘的发生发展过程[6]。但少有关于IL-33在RSV诱导哮喘大鼠血清及肺组织中的表达及咳喘宁对IL-33影响的报道。
本实验构建RSV哮喘大鼠模型,经咳喘宁干预后,观察大鼠行为学表现,测定其气道反应性,观察肺组织病理学改变,检测气道重塑指标和免疫炎症因子IL-33表达水平,以探究咳喘宁对RSV诱导哮喘大鼠的治疗作用及可能的治疗机制。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级Wistar雌性大鼠60只,28~35 d,体质量(100±10)g,购自北京维通利华实验动物技术有限公司,动物许可证号:SYXK(京)2016-0006,饲养于湖南中医药大学实验动物房。
1.1.2试剂与仪器 RSV Long株、人喉癌上皮细胞 (Hep-2)由武汉大学医学部病毒学研究所提供;鸡卵清白蛋白(OVA)购自北京 Solarbio公司;咳喘宁口服液:炙麻黄、苦杏仁、生石膏、大青叶、黄芪、桃仁、细茶叶、 甘草由湖南中医药大学第一附属医院制剂室生产[(湘)卫药剂(06)05第085号],100 ml/瓶,含生药70 g;瑞氏-吉姆萨染液购自北京索宝生物科技有限公司,(货号:G1040);苏木素-伊红染色液(货号:P032IH)、中性树胶(货号:P033IH)购自Auragene公司;二甲苯(货号:10023418)、无水乙醇(货号:10009218)购自国药公司;IL-33酶联免疫(ELISA)试剂盒(货号:E20181109012)购自上海晶天生物科技有限公司;TRIzol试剂(货号:R1022)、DS2000 marker(货号:M1102)、SYBR Green qRCR Mix(货号:P2092)购自东盛生物公司;Thermo Scientific RevertAid First Strand cDNA Synthesis Kit(货号:K1622)购自Thermo公司;DEPC购自Sigma公司(货号:V900882);RT-PCR引物由湖南擎科生物技术有限公司合成。S888E 型超声雾化器购自南京道芬电子有限公司;动物呼吸机、气道阻力和肺顺应性软件分析系统购自美国BUXCO,型号为DHX-50、WBP;YT-6C型生物组织摊烤片机产自湖北孝感;P031IH防脱载玻片购自BurBgene公司;BE41光学显微镜购自Motic公司;MK3型酶标仪购自Thermo公司;16K-R型低温台式离心机购自长沙鑫奥仪器公司;722S型分光光度仪购自上海第三分析仪器厂;7300荧光定量PCR仪购自ABI公司;THERM-1000型PCR仪购自Corning公司;DYY-6C型电泳仪购自北京六一仪器厂公司。
1.2方法
1.2.1建立RSV诱导哮喘大鼠模型 大鼠正常适应性饲养一周,随机选择15只作为正常组,余下45只参照文献[7]制作模型,实验第1、2天分别滴鼻1.0×106PFU RSV,50 μl/只,同时腹腔注射1%OVA 致敏,0.25 ml/只,正常组给予等体积 Hep-2 滴鼻,腹腔注射生理盐水0.25 ml/只。处理后正常喂养一周,实验第9天起,造模大鼠雾化吸入1%OVA激发哮喘,正常组使用等量生理盐水雾化,隔天1次,30 min/次,共14 d,雾化激发阶段可观察到造模大鼠烦躁不安、呼吸急促、频繁挠鼻、大小便失禁等。实验第15天,正常组和造模后大鼠各取5只进行气道反应性测定,经乙酰胆碱(Ach)激发后,造模后大鼠的肺阻力(RI)明显高于正常组(P<0.05),表明造模成功,如图1。
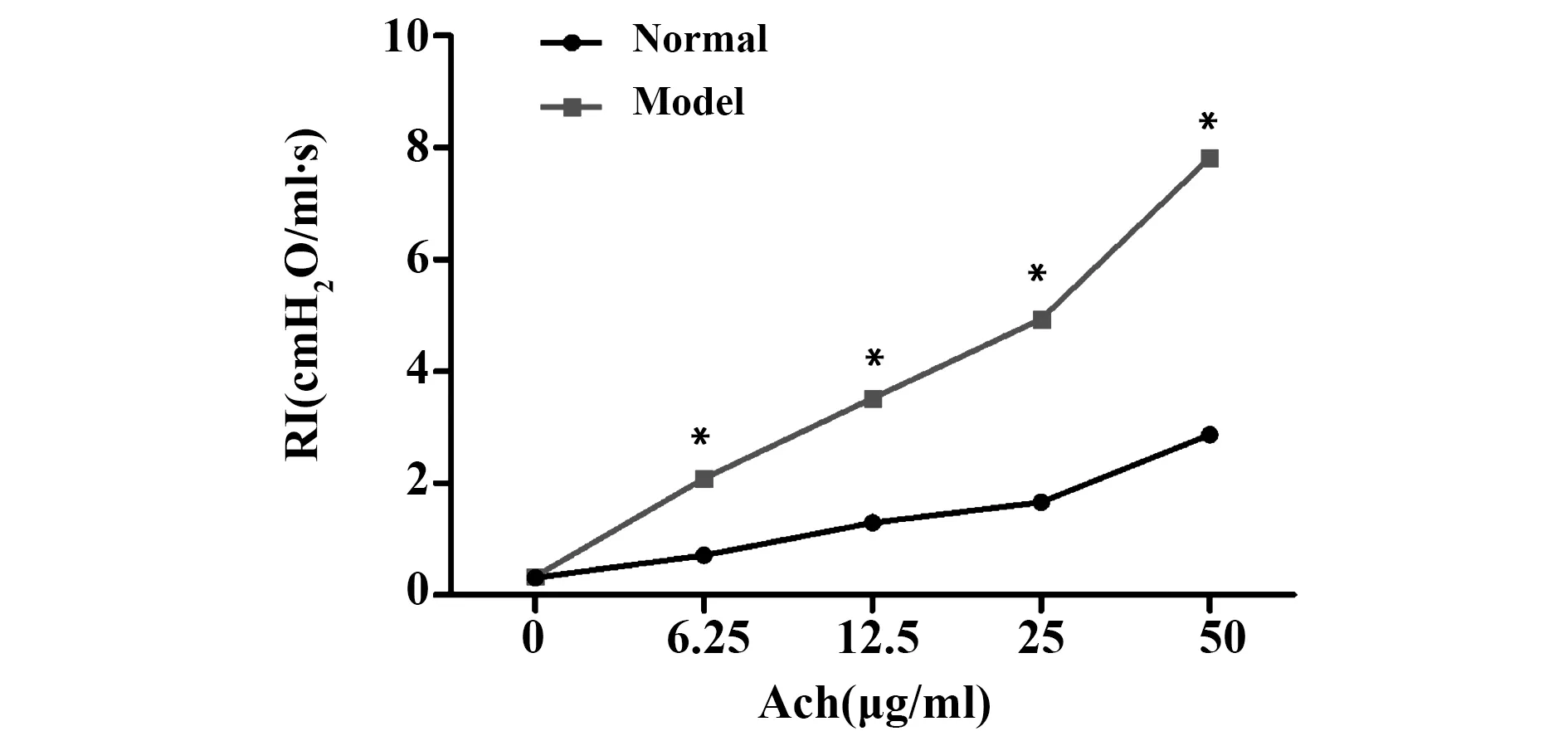
图1 气道反应性检测示造模成功
1.2.2气道高反应性测定 给药前随机取正常组和模型组大鼠各5只,给药14 d后各组所有大鼠均进行气道反应性测定。10%水合氯醛腹腔注射麻醉,0.3 ml/100 g。将大鼠固定于鼠板,暴露气管和颈静脉,用静脉留置针行颈静脉穿刺并固定;V形剪开气管,使用深静脉穿刺针改造的气管导管行气管插管后连接动物呼吸机,设置呼吸频率为75 次/min,吸呼比1∶1,潮气量8 ml/kg。经颈静脉依次间歇推注生理盐水、6.25 μg/ml、12.5 μg/ml、25 μg/ml、50 μg/ml的Ach 0.5 ml,每次间隔约1 min,计算机动物肺功能分析软件检测气道阻力(RL)和用药后的RL,以RL超过基础值的2倍以上为停止Ach推注标准,以RL变化代表气道反应性。
1.2.3分组及给药 造模成功的大鼠随机分为模型组、咳喘宁高剂量组、咳喘宁中剂量组和咳喘宁低剂量组,每组10只。正常饲养1周。按临床量效关系观察结果拟定低、中、高剂量组咳喘宁口服液灌胃浓度分别为0.033 ml/100 g、0.3 ml/100 g和1 ml/100 g,正常组和模型组均灌胃等剂量的生理盐水。实验第29天开始给药,每天1次,共14 d。
1.2.4行为学观察 给药期间每日观察各组大鼠行为学表现,记录有无哮喘急性发作,给药第14天记录单位时间(1 min)内各组大鼠挠鼻和打喷嚏次数以评价咳喘宁药物组大鼠哮喘病情有无改善。
1.2.5HE染色观察肺组织病理学改变 将大鼠肺组织浸入4 %多聚甲醛固定24 h,经乙醇脱水后,置于60℃蜡盒内浸蜡、包埋、切片,分别于苏木素和伊红染液中染色,脱水,中性树胶固定,封片。将制作好的切片置于光镜下观察肺组织病理学改变。
1.2.6Masson染色观察支气管上皮细胞下胶原沉积 取大鼠肺组织,于气管内注射 4 %多聚甲醛1 ml 后将全肺浸入 4 %多聚甲醛中固定24 h。常规石蜡包埋、切片,进行Masson′s Trichrome 染色,中性树胶固封。光镜下观察支气管上皮细胞下胶原沉积情况,其中阳性区域为蓝色。
1.2.7ELISA检测血清IL-33水平 最后一次给药后经腹主动脉采血,室温下静置20 min,2 500 r/min离心20 min,获取血清,ELISA试剂盒检测血清中IL-33水平,操作严格按照试剂盒说明书进行。酶标比色仪测定各反应孔OD值(于波长450nm处,标准孔调零),参照试剂盒提供的标准品绘制曲线并计算血清中IL-33浓度。
1.2.8qPCR 检测IL-33 mRNA水平 TRIzol 法提取肺组织总RNA,取少量测定RNA纯度及完整性,将RNA反转录为cDNA。反应结束后立即进行qRCR定量,设置20 μl反应体系,IL-33上游引物5′-GAAGAGATCCCTGCTTGGCA-3′,下游引物5′-TCCACACCGTCTCCTGATTG-3′。步骤严格按照试剂盒说明书操作。反应参数:95℃,3 min;95℃,10 s;60℃,30 s,共40个循环。参照说明书计算扩增效率,确认各目的基因和内参基因的扩增效率是否一致(接近100%且差距<5%)。使用2-ΔΔCt法行分析基因相对表达量。
2 结果
2.1咳喘宁对哮喘大鼠行为学表现的影响 正常组大鼠精神良好,活动敏捷,呼吸频率正常;模型组大鼠精神萎靡,蜷缩成团,对外界刺激反应迟钝,皮毛枯糙,实验期间常有挠鼻、打喷嚏等症状,多次哮喘急性发作,呼吸急促。与模型组相比,咳喘宁组精神状态较好,对一般刺激较为敏感,蜷缩成团行为少见,偶有哮喘急性发作,挠鼻、打喷嚏症状减少,差异具有统计学意义(P<0.05),其中咳喘宁高剂量组与模型组的差异最为明显(P<0.05)。单位时间内(1 min)各组大鼠挠鼻、打喷嚏次数见表1。

表1 各组大鼠单位时间内挠鼻、打喷嚏次数(次,
2.2咳喘宁对哮喘大鼠肺组织病理学改变的影响 正常组大鼠肺组织和支气管结构完整,肺泡壁无明显增厚,无充血,肺间质未见明显炎症细胞浸润。模型组大鼠肺组织和支气管结构不完整甚至消失,肺泡壁增厚,支气管黏膜和血管壁充血明显,炎症细胞大量浸润。与模型组相比,咳喘宁高、中、低剂量组织破坏程度有明显改善,肺泡壁轻度增厚,支气管腔无明显缩窄,较少炎症细胞浸润,其中咳喘宁高剂量组的破坏最轻,仍留存完整的肺泡结构,支气管平滑肌皱襞不明显。见图2。
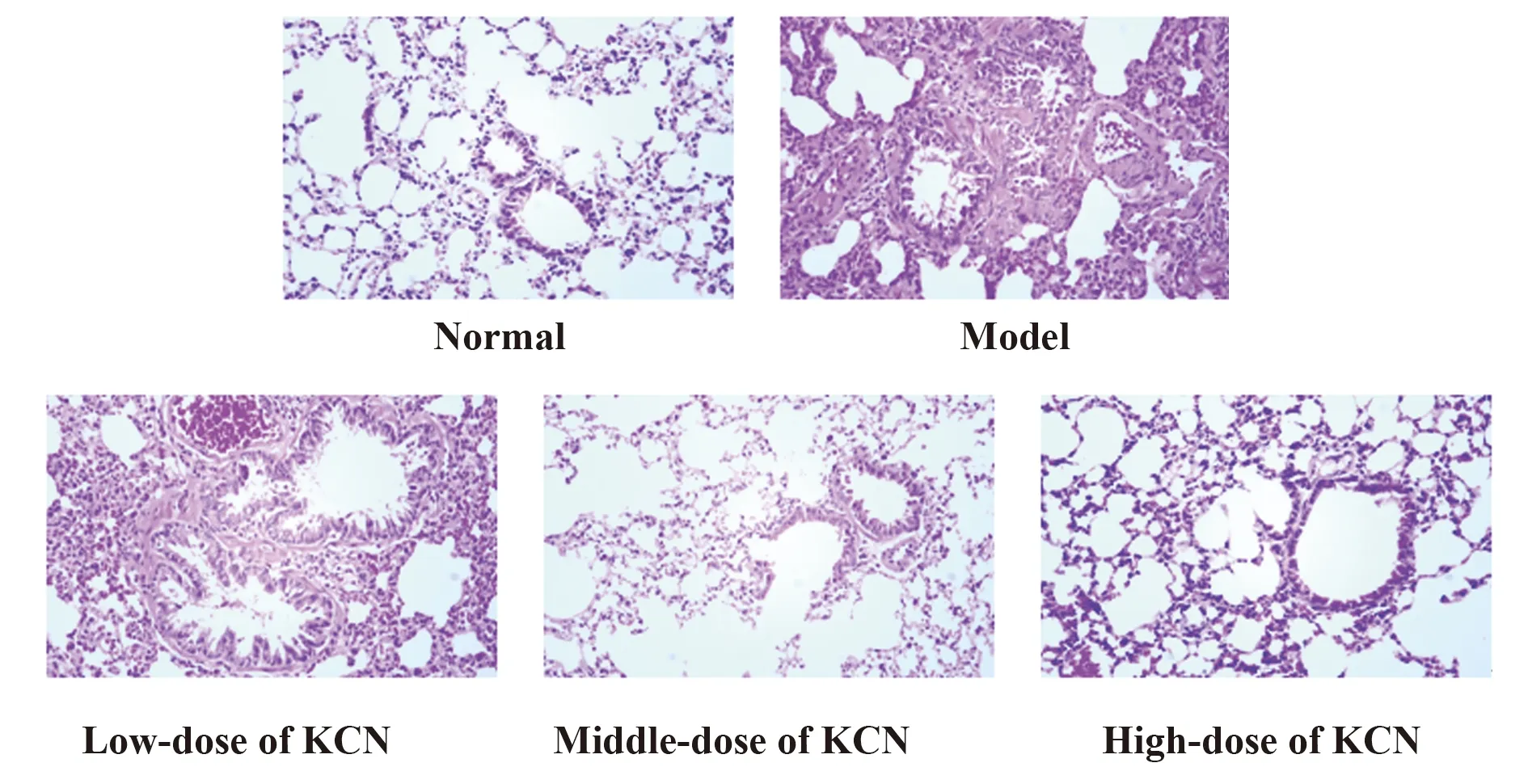
图2 各组大鼠肺组织病理形态变化(×200)
2.3咳喘宁对哮喘大鼠气道高反应性的影响 在不同浓度的Ach激发下,模型组的气道阻力明显高于正常组,差异具有统计学意义(P<0.05);咳喘宁药物组的气道阻力均低于模型组,差异具有统计学意义(P<0.05)。见表2。
表2 不同浓度Ach激发下各组大鼠的气道反应性
2.4咳喘宁对哮喘大鼠气道上皮细胞下胶原沉积的影响 Masson染色结果见图3,正常组大鼠气道上皮细胞下胶原沉积极少;模型组气道上皮细胞下大量胶原沉积,肺组织破坏严重,深度蓝染; 与模型组相比,咳喘宁低剂量组蓝染相对较浅,但仍有较多胶原沉积,咳喘宁中、高剂量组胶原沉积明显减少,高剂量组改善效果最好。
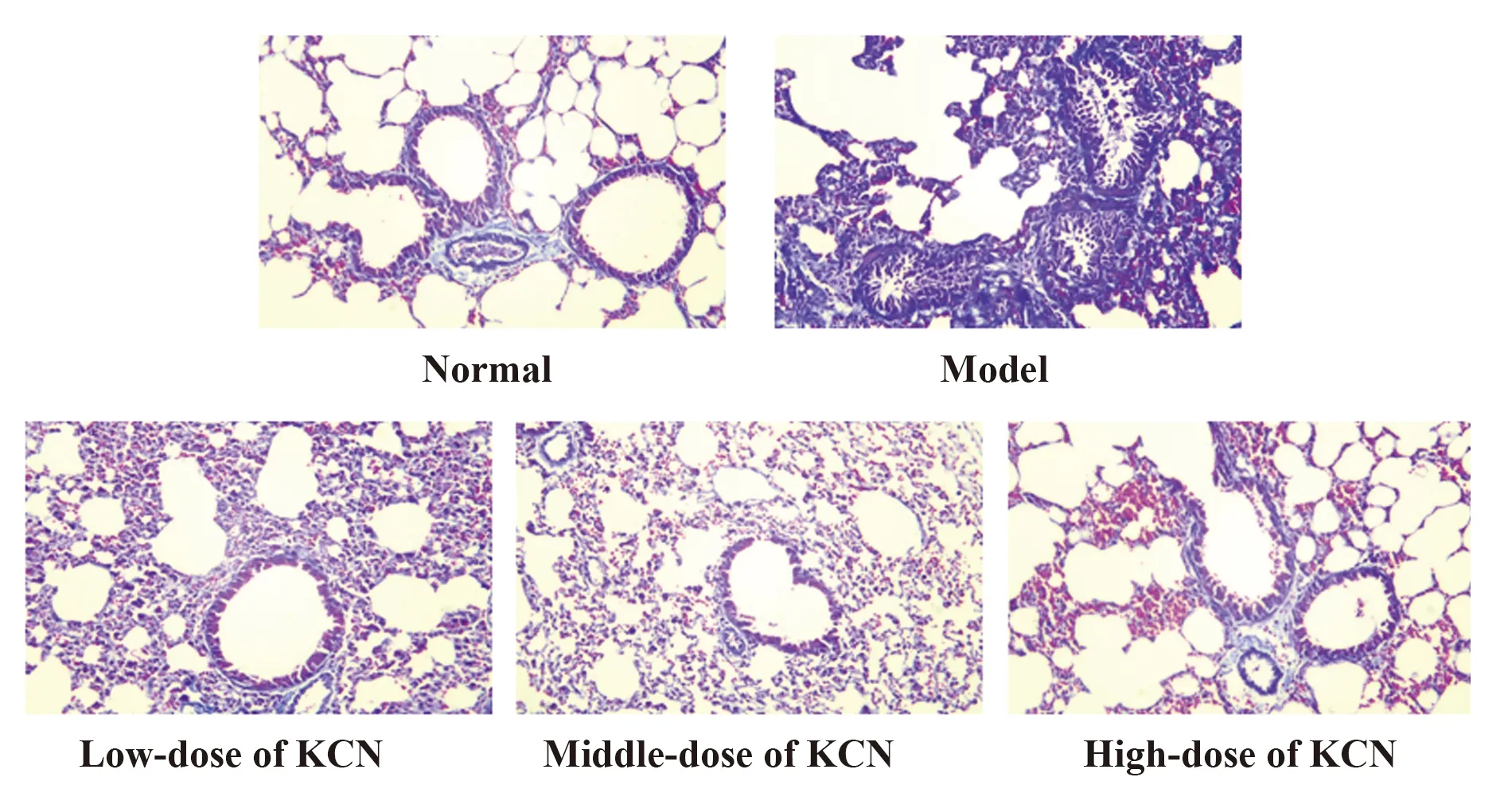
图3 各组大鼠Masson染色结果(×200)
2.5咳喘宁对哮喘大鼠血清IL-33和肺组织IL-33 mRNA的表达影响 ELISA和qPCR结果见表3和表4,其中正常组血清IL-33和肺组织IL-33 mRNA表达最低,模型组IL-33表达显著升高(P<0.05),与之相比,咳喘宁干预后大鼠体内IL-33表达水平下调,其中以咳喘宁高剂量组的下降最为显著(P<0.05)。
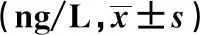
表3 各组大鼠血清IL-33水平
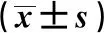
表4 各组大鼠肺组织IL-33 mRNA表达水平
3 讨论
支气管哮喘是严重威胁人类健康的世界性疾病,急性发作未得到及时治疗可迅速致死,危害极大。但其发病机制尚不完全明确,临床使用的药物疗效有限,因此,探究哮喘的发病机制和寻找有效的新药具有重要意义。RSV是一种分布广泛、传染性较强的 RNA 病毒,流行病学资料显示,反复RSV感染可增加婴幼儿日后患哮喘的风险[8]。病毒感染引起的哮喘与炎症免疫反应密切相关,有研究表明呼吸道合胞病毒感染诱导 BALB/c 鼠肺组织巨噬细胞及树突状细胞中IL-33 mRNA高表达可增强由RSV 感染引发的炎症应答[9]。IL-33属于白介素1家族,主要表达于上皮细胞和内皮细胞,可能是一种在细胞受损时向免疫系统发出危险信号的警报[10]。正常情况下,IL-33并不具有促炎作用,当细胞损伤或坏死时,成熟的IL-3395~ 270、IL-3399~270和IL-33109~270释放到细胞外,与选择性表达在 Th2 细胞表面的ST2(suppression of tumorigenicity 2)受体结合激活免疫系统,诱导Th2细胞分泌效应因子,促进炎症反应[11]。同时有研究显示,抗IL-33可降低疾病各阶段的2型炎症,反向证实了IL-33的促炎作用[12]。IL-33也参与气道重塑的发生,Guo等[13]对哮喘患者气道黏膜活检组织进行免疫组化染色,发现受损的气道上皮细胞和间质成纤维细胞高度表达IL-33,HE染色观察到上皮下纤维化严重,基底膜明显增厚,且增高的 IL-33 水平与基底膜厚度呈正相关。此外,IL-33 抗体可减少哮喘模型小鼠中 α-SMA 与 Col1 的蛋白表达,缓解哮喘小鼠气道重塑,因此推测IL-33可能通过上调α-SMA 与 Col1 蛋白表达诱导气道重塑[14]。本研究中,与正常组相比,模型组大鼠HE染色病理学显示肺组织破坏明显,Masson染色中支气管上皮细胞下胶原沉积增多,血清IL-33和肺组织IL-33 mRNA表达显著升高,IL-33表达水平增高与大鼠肺组织、气道病理改变严重程度的趋势呈正相关,与已有研究结果相同。
中医药治疗哮喘疗效确切,且副作用少,在哮喘防治方面具有独特优势[15]。咳喘宁由发散表邪的代表方剂五虎汤另加黄芪、大青叶、桃仁三味药组成,用于治疗喘息性疾病。临床研究和动物实验均证明咳喘宁治疗RSV诱发哮喘疗效显著,且其治疗作用与哮喘发生发展的免疫机制相关[16]。方中麻黄含麻黄碱,可有效舒张支气管,具有抗炎、抗过敏的作用;苦杏仁能平喘止咳;石膏清泻肺热;大青叶具有抗炎抗病毒作用;黄芪扶正祛邪,可增强人体免疫力,抑制病毒;桃仁活血化瘀,缓解炎症反应;细茶叶清神化痰;甘草镇咳平喘,具有抗炎抗过敏作用。
本研究中,与模型组相比,咳喘宁高、中、低剂量组大鼠的哮喘症状、气道高反应性、气道炎症和气道重塑都有不同程度的改善,且高剂量组的治疗作用最为显著,说明咳喘宁对哮喘症状缓解的有效性。ELISA法和qPCR分别从蛋白和基因水平检测IL-33表达,模型组较正常组表达水平显著升高,说明IL-33参与哮喘的发生发展,介导免疫炎症反应,诱导气道重塑;经咳喘宁治疗后,与模型组相比,大鼠血清中IL-33浓度和肺组织IL-33 mRNA表达均下降,其中高剂量组下降最明显,表明咳喘宁能有效下调血清中及肺组织中IL-33的表达,减少Th2细胞分泌效应因子,减轻免疫炎症反应对气道上皮细胞和肺内皮细胞损伤;减少气道和肺组织纤维细胞胶原表达,抑制气道重塑。可见血清与肺组织IL-33的表达变化在一定程度上可提示哮喘的病情变化,反映治疗效果。
综上所述,IL-33与哮喘气道免疫炎症反应和气道重塑的发生关系密切,在哮喘的诊治中,IL-33的表达可为判断哮喘病情进展及药物疗效提供重要依据。因此推测,IL-33很可能是治疗RSV诱导哮喘的重要靶点,咳喘宁对RSV诱导哮喘的治疗作用可能是通过下调IL-33的表达实现的。
