聚集诱导发光材料在药物递送与疾病治疗中的研究进展
2020-09-29张玉权郭帅翁郁华杨勇飞黄渊余
张玉权,郭帅,翁郁华,杨勇飞,黄渊余
(北京理工大学生命学院,前沿交叉科学研究院,医工融合研究院,分子医学与生物诊疗重点实验室,北京100081)
引 言
随着纳米技术的不断发展,纳米药物载体在人类疾病治疗领域发挥了重要的作用。纳米药物递送 系 统(nanotechnology−based drug delivery system,NDDS)是将药物装载于纳米颗粒内部或者修饰在其表面,再通过靶向分子与靶细胞表面受体特异结合富集到靶组织、靶细胞,实现安全有效的药物递送。目前,纳米药物递送系统主要有脂质体、聚合物纳米颗粒、胶束、无机纳米颗粒(介孔二氧化硅等)、细胞外囊泡或外泌体等。与传统药物(剂量大、水溶性差、疗效小、毒副作用高)相比,纳米药物载体因具有能够增加生物质膜的通透性、保持药物浓度的稳定、选择性的释放药物、自发的进行降解等优势[1−2],表现出良好的应用前景。
癌症是一种严重危害人类健康的疾病[3−4],2017年,由癌症造成的死亡人数远远超过人类免疫缺陷病毒/获得性免疫缺陷综合症、结核病或疟疾等传染病造成的死亡人数[5]。2018 年,据GLOBOCAN 估计,全球有1810万人患有癌症,960万人死于癌症[6]。癌症治疗是一项对全社会影响很大的全球性难题。在这一过程中,癌症的诊断显得尤为重要。到目前为止,已经开发出各种用于癌症诊断的成像技术,包括荧光成像、光声成像(photoacoustic imaging,PAI)、计算机断层扫描(computer tomography,CT)、磁共振成像(magnetic resonance,MRI)和正电子发射断层扫描(polyethylene terephthalate,PET)[7−11]。
荧光成像技术因具有灵敏度高、选择性好等优点,广泛应用于生命科学和基础医学领域[12]。在药物递送过程中,为能更好地监测与控制药物在时间和空间上的释放,常引进具有高灵敏度、高时空分辨率的外源造影剂。有机荧光材料是生物研究中最常用的荧光纳米材料之一。与其他荧光材料相比,有机材料具有高亮度、良好的生物相容性、生物降解性等优势,广泛应用于生物成像。然而,由于刚性平面发色团的π−π 堆积,传统的有机荧光材料在聚集态或高浓度下会发生荧光淬灭,这种现象被称为聚集导致淬灭(aggregation caused quenching,ACQ)[13−14]。ACQ 效应的存在,严重限制了有机荧光材料在成像中的应用。特别是疏水性的有机荧光材料在细胞微环境中会自发形成聚集体,产生明显的自淬灭现象,而在较低浓度下使用时,又会发生光漂白、灵敏性差等问题[15−16]。
2001 年,Luo 等[17]发现了一种特殊的荧光素,在稀溶液状态下显示微弱荧光甚至不发光,但是在形成聚集体后显示出明亮的荧光,这种现象称之为聚集 诱 导 发 光(aggregation−induced emission, AIE)现象。具有聚集诱导发光特性的荧光素为克服ACQ效应提供了一种合适的选择。与传统的ACQ 荧光团相比,聚集诱导发光荧光素(AIEgen)具有聚集态发射效率高、斯托克斯位移大、光稳定性好、背景噪声低和生物可视化能力强等独特优势[18−20]。目前关于聚集诱导发光机理中研究最全面、适用范围最广的是分子内运动受限机理[21−22]。在溶液中,AIEgen分子中芳香族取代基等运动单元的自由旋转或振动消耗了激发态能量,导致非辐射衰变,从而导致荧光微弱甚至消失;相反,在聚集状态下,由于空间的限制,分子间进行紧密堆积,分子内旋转受到阻碍,这使得非辐射衰变渠道被抑制,从而使AIEgen分子发出明亮荧光。
本文总结了近年来基于AIEgen 的药物递送系统在可视化药物递送方面取得的进展,介绍了抗癌药物及基因药物的递送。同时还介绍了AIEgen 在可视化光动力和光热治疗方面的应用。
1 基于AIEgen的药物递送系统
由于AIEgen 具有低背景、高亮度、高光稳定性的特点,将AIEgen 和药物递送系统相结合,赋予了纳米药物载体自身可发光能力,有利于药物递送过程的监测[23−25]。本文主要从AIEgen 和不同纳米药物载体结合方面对药物递送系统进行综述。
1.1 小分子AIEgen药物递送系统
AIEgen 分子本身为疏水型,可通过与疏水药物之间的相互作用来递送药物。Xue 等[26]报道了具有聚集诱导发光特性的四苯乙烯(tetraphenylethylene,TPE)纳米颗粒通过静电作用负载抗癌药物阿霉素(doxorubicin, DOX),组成自发光药物输送系统。由于该纳米颗粒及其成分具有不同的颜色,通过监测这些颜色的转变,可以确定观察药物的释放过程。除此之外,AIEgen 可与药物通过化学键连接构成响应性药物输送系统。Gao 等[27]报道了一种对H2O2响应的药物输送系统(ABD)。该系统由TPE、BBE(benzyl−boronic ester)和DOX 组成,并对细胞内活性氧(reactive oxygen species, ROS)之一的过氧化氢(H2O2)敏感。由于荧光共振能量转移(fluorescent resonance energy transfer,FRET)效应,TPE 和DOX 自身荧光很微弱。但是,在H2O2作用后,体系分解导致TPE 和DOX 释放(图1[27])。因此DOX 进入细胞核显示红色荧光,同时TPE 分子聚集发出蓝色荧光,实现了药物释放监测与细胞成像。另外,AIEgen 可与长烷基链连接并自组装形成纳米颗粒。Kim 等[28]报道了一种基于三苯基膦和长烷基链修饰的氰基二苯乙烯衍生物,它能够在水介质中自组装形成纳米颗粒并高效地将DOX 运送到线粒体。体内外实验表明,该纳米粒子具有肿瘤识别特异性,并且可在癌细胞线粒体中聚集使细胞内活性氧的产生显著增加并导致癌细胞线粒体膜电位的降低,最终引起细胞凋亡,这揭示了AIE 探针作为成像引导治疗以及癌细胞靶向递送的巨大潜力。

图1 ABD系统的化学结构及其工作机制示意图[27]Fig.1 Chemical structure of the ABD system and the schematic illustration of its working mechanism[27]
1.2 有机-无机药物递送系统
近年来,人们致力于将AIEgen 有机染料掺杂到无机材料中,这些材料不仅拥有AIE 特性而且继承了无机材料的优点,表现出较大的比表面积、高化学稳定性和易于表面功能化等优势[29−31]。AIEgen 可以通过物理掺杂和化学键固定到无机材料中。Li等[32]在介孔二氧化硅上接枝了TPE 分子,用于药物递送。在365 nm 紫外光激发下,该材料发出蓝色荧光。负载布洛芬(ibuprofen,IBU)药物后,材料的荧光强度进一步增强,表明该材料对药物的负载和释放过程具有光稳定性。但是,该材料载药能力仍受到一定程度的限制,他们进一步制备了一种TPE 功能化的中空介孔二氧化硅纳米球[33]。所得到的核−壳结构纳米材料具有球形的形貌、较大的空穴空间和良好的介孔结构,且具有较强的蓝光发射和良好的生物相容性。该纳米球对DOX 具有很高的载药量,并且在中等酸性环境中能有效释放DOX。
RNA 干扰(RNA interference, RNAi)是近年来一种新的疾病治疗手段,可通过siRNA 或miRNA 特异性地识别靶基因mRNA 并使其沉默[34−35]。除了二氧化硅外,He 等[36]制备了一种核−壳纳米粒子,它是通过贵金属银离子(Ag+)和AIEgen 之间的氧化还原反应自组装而成。该纳米粒的壳层厚度是可以精确调节的,并且随着壳层厚度的增加,纳米粒的红色荧光强度逐渐增强。另外,它们包覆正电荷聚烯丙基胺盐酸盐调节纳米粒电荷,通过静电相互作用结合带负电荷的双链siRNA[图2(a)[37]],用于RNAi的治疗。实验表明,该纳米粒子能够提高siRNA 的传递效率,为实时监测细胞内的行为提供一种优越且稳定的标记方法,并且具有良好的靶基因mRNA 沉默效果和抑制肿瘤生长的能力[图2(b)[37]]。

图2 负载siRNA的核−壳纳米粒子示意图(a)及肿瘤体积生长曲线(b)[37]Fig.2 Schematic diagram of nucleus−shell nanoparticles loaded with siRNA (a)and tumor volume growth curves(b) [37]
1.3 AIE聚合物药物递送系统
自发光荧光聚合物有助于药物释放的监测,而且能够估计药物在细胞内的释放情况。AIEgen 小分子可以与其他分子以共聚或侧链形式偶联成AIE荧光聚合物,此类聚合物以分子间的亲疏水作用自发组装成纳米颗粒,并且拥有AIEgen 小分子无可比拟的优势:多样化的结构、良好的生物相容性和可生物降解性[38−40]。
Wang 等[41]设计了三种D−A 型共轭聚合物用于肿瘤治疗。通过改变聚合物的D−A 结构,即改变给电子部分的结构,聚合物的荧光颜色可以从黄色变化至深红色。其中两种聚合物在负载抗癌药物紫杉醇(paclitaxel, PTX)后,不仅可以显示出黄色或红色荧光信号,而且相比于商业化PTX,体内抑瘤效果提高了近两倍。
由于肿瘤细胞所处的是酸性和氧化还原的环境,近年来,pH 响应性和氧化还原响应性聚合物受到了广泛的关注。同时,为了增加肿瘤细胞对纳米颗粒(nanoparticles,NPs)的摄取能力,一个途径是将电荷转换能力引入NPs 中[42−44]。Yu 等[45]设计了 一 种基于抗癌药物吉西他滨(gemcitabine, GEM)偶联PMPC−b−P(DEMA-co-SS−GEM−co−TPMA)且具有电荷转换能力的pH 和氧化还原双响应聚合物胶束,用于靶向溶酶体生物成像和癌症治疗[图3(a)[45]]。聚合物胶束在血液循环过程中可以保持稳定的结构,当到达肿瘤部位时,负电荷转化为正电荷,促进细胞内吞和肿瘤滞留[图4(a)[45]]。另外,此聚合物具有双光子特性,在细胞成像和深部组织成像中表现出良好的性能,并且在pH=5.0 时表现出良好的pH响应性[图4(b)[45]],而在pH=6.0时表现出较好的稳定性。当培养基中谷胱甘肽(glutathione, GSH)浓度从0增加到10 mmol/L 时,可以观察到GSH 触发的药物释放。此外,增加NPs 细胞内吞的另一个途径是在NPs 表面修饰靶向配体[46]。Hu 等[47]设计了一种基于叶酸(folic acid,FA)修饰的三嵌段共聚物P(TPF−co−IBUP)−PAEMA−PPEG@FA,作为一种具有抗肿瘤和抗炎能力、电荷转换和FA 介导的增强细胞摄取能力的药物递送系统[图3(b)[47]],通过疏水作用将抗癌药物姜黄素(curcumin, CUR)包裹于聚合物胶束中心。另外,聚合物胶束表面可转换的正电荷结合靶向配体FA 可以促进细胞对NPs 的摄取。在酸性环境和高浓度GSH 下,CUR 和IBU 可以从纳米粒中快速释放出来。
在外部条件刺激下,聚合物递药系统释放包埋的化疗药物是提高治疗效率的一种有效策略。Wu等[48]开发了一种光激活前药和AIEgen 共聚物纳米粒(PtAIECP@DOX NP),用于双药监测和联合化疗。在500 nm 可见光诱导下,PtAIECP@DOX NP 聚合物纳米粒的主链发生断裂,继而纳米粒发生解离。纳米粒解离后,TPE 和DOX 呈现自身荧光,实现了光照射下化疗药物释放的时间和空间控制。
1.4 AIE超分子药物递送系统

图3 AIE聚合物的分子结构Fig.3 Structures of AIE polymers

图4 GEM共轭胶束在pH 5.0和pH 7.4时的Zeta电位变化(a),GEM共轭胶束在pH 5.0和0 mmol/L GSH条件下粒径分布的变化(b)[45]Fig.4 Zeta potential changes of GEM−conjugated micelles at pH 5.0 and pH 7.4(a),changes of the particle size distribution of GEM−conjugated micelles at pH 5.0 with 0 mmol/L GSH(b)[45]
在超分子聚合物中引入AIE荧光团可赋予发光材料新的活力,而且超分子聚合物由于具有紧凑的结构可以负载大量的药物[49]。另外,这些超分子聚合物还具有表面功能化的特点,修饰靶向配体能够特异性的被细胞内吞[50]。Yu等[51]制备了一种基于水溶性柱状芳烃(P5)和紫精盐(M)之间的主−客体分子识别两亲性超分子聚合物。它能够自组装成超分子纳米颗粒,并且利用纳米颗粒的疏水核心包裹DOX。在低pH 环境的作用下,负载的DOX 分子被释放,克服了FRET 引起的TPE 和DOX 荧光淬灭现象。继而通过观察依赖于能量转移的荧光变化的位置和大小,实现了药物释放过程的可视化。另外,由于超分子聚合物表面修饰了靶向配体生物素,该纳米粒子优先将DOX 递送至过表达生物素受体的癌细胞。体内外研究表明,负载DOX 的该纳米粒子具有良好的抗肿瘤效果。
Zhang 等[52]通过用TPE 和棕榈酸(palmitic acid,PA)修饰的多肽衍生物TR4 与质粒DNA 在溶液中自组装形成荧光超分子纳米纤维,研究表明该纳米粒具有低细胞毒性、高稳定性和高转染效率的特点。由于TPE 的聚集诱导发光性质,纳米粒在405 nm 可见光照射下呈现蓝色荧光,为体外基因传递过程提供了指示作用。他们进一步用TPE 和PA 修饰的TR4静电吸附带负电荷的siRNA 形成超分子球形纳米粒[53]。同时在纳米粒表面修饰了转铁蛋白(transferrin, TF),带负电荷的TF 能够屏蔽原纳米粒的正电荷,从而降低了细胞毒性。由于转铁蛋白与细胞表面转铁蛋白受体之间的强相互作用,故转铁蛋白涂层可以促进纳米粒的细胞靶向和基因传递,从而表现出高的基因沉默效率。
2 可视化光动力和光热治疗
2.1 可视化光动力疗法
近年来,光动力疗法(photodynamic therapy,PDT)在肿瘤治疗方面取得优异的效果[54],光动力疗法利用光敏剂(photosensitizer, PS)在特定波长光照射下产生ROS,如单线态氧,单线态氧可以和相邻的生物大分子发生氧化反应,产生细胞毒性作用进而杀死肿瘤恶性细胞并调节细胞内的生成代谢[55]。然而传统的光敏剂由于疏水性和分子间堆积作用,在高浓度下荧光会减弱,甚至会发生荧光淬灭,在一定程度上减弱了PDT 效应[56−57]。所以与传统的光敏剂相比,具有AIE 特性的光敏剂有显著的优势。AIE 光敏剂用于荧光引导的PDT 治疗具有亮度高、稳定性好及疗效好的特点[58]。Dai 等[59]合成了具有D−A−D 结构的荧光素TTB,用于图像引导的靶向PDT(图5[59])。荧光素TTB 具有明显的聚集诱导发光特性,在聚集态表现出较强的近红外发射,在白光照射下能够有效产生活性氧。另外,他们将TTB 包裹于两亲性聚合物中,并且在表面修饰了RGD−4R肽,用于靶向癌细胞表面整合素αvβ3,提高纳米药物的靶向能力。纳米粒RGD4R−MPD/TTB 具有较强近红外发射、高光稳定性和低细胞毒性的特点。随后在细胞水平上,对MCF7、PC3、HeLa、SKOV−3 细胞进行了光动力测试,结果表明纳米粒RGD−4R−MPD/TTB 能够有效靶向整合素αvβ3过表达的细胞,增强细胞内化,改善光动力疗法效应。
PDT疗法的核心点是将微环境下的氧气转化为活性氧,在肿瘤微环境中,由于肿瘤的快速代谢生长,造成在肿瘤深层组织中氧气的匮乏,减弱PDT效应[60]。因此,将外源性氧气递送进肿瘤微环境中的策略被广泛研究[61−62]。MnO2纳米颗粒在酸性条件下可以催化H2O2分解为氧,从而减轻肿瘤微环境缺氧状况。Gao 等[63]合成了一种具有产氧能力的纳米酶OGzyme,并将其与MnO2组装在铁蛋白纳米笼空腔内,随后与包埋了AIE分子的脂质体进行复合,构建了纳米粒Lipo−OGzyme−AIE。OGzyme 利用MnO2对pH−H2O2敏感的响应特性,缓解了肿瘤微环境缺氧,从而进一步为光敏剂AIE 分子的转化提供了来源。结果表明,与对照组相比,肿瘤微环境缺氧情况减少了近2/3。同时,提高光敏剂活性氧转化能力的其他策略也被研究。另一个有效方法是在光敏剂中引入重原子,如卤素、过渡金属等。铱Ir(Ⅲ)配合物由于理想的光物理性质、较大的斯托克斯位移,作为光敏剂引起了研究者们的极大关注。Zhang等[64]设计了含有不同数量铱的红色发光配合物,其中AIE分子TPA被用作桥梁来偶联金属铱。体内外实验结果表明,单线态氧产生能力的增加与铱数目的增加保持一致,即含三个金属铱活性中心(含有三个以铱为中心原子的配位化合物)的AIE−NPs 对肿瘤细胞具有较强的细胞毒性作用,并能有效抑制肿瘤生长。
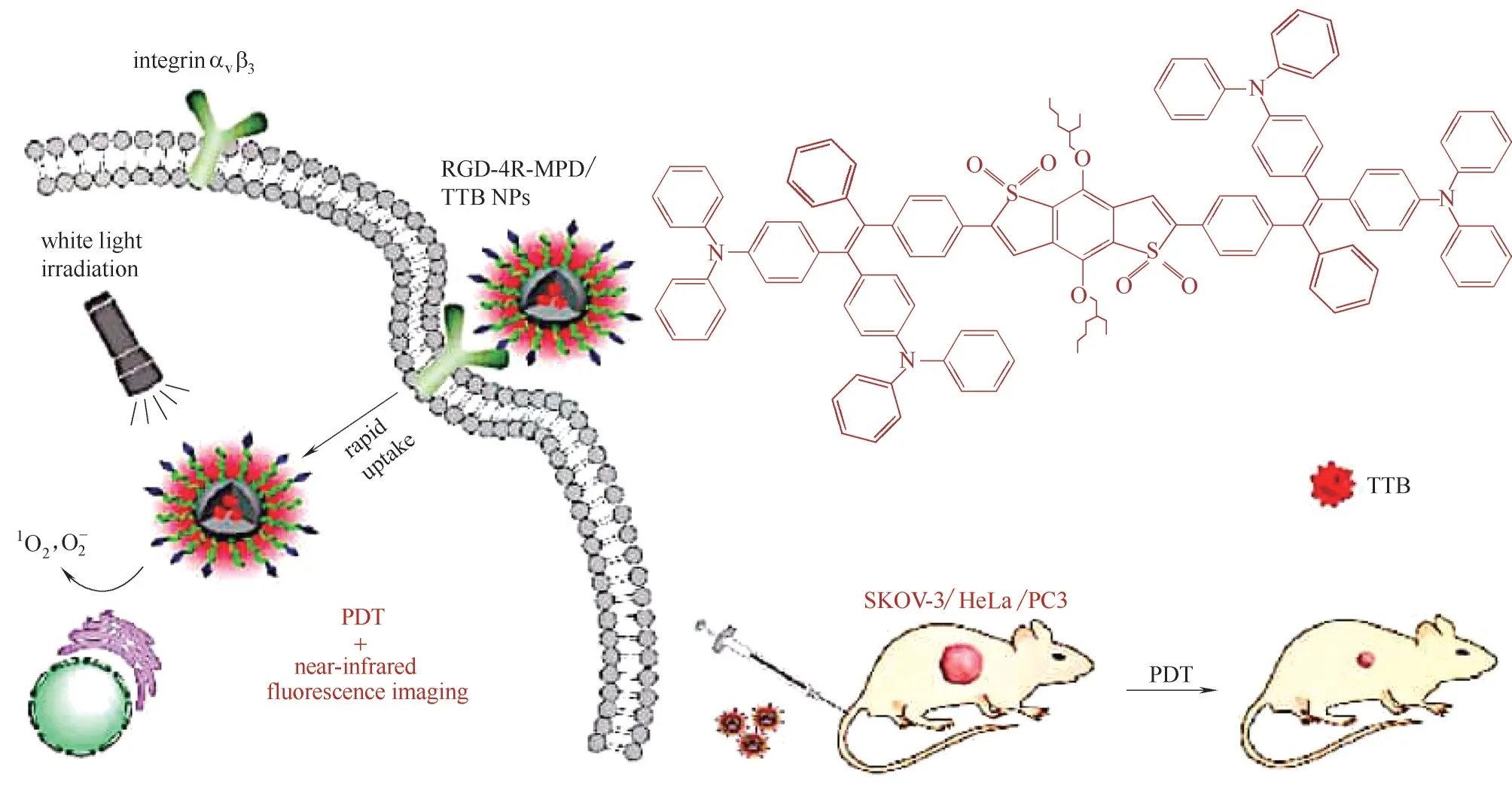
图5 荧光素TTB的分子结构、RGD−4R−MPD/TTB纳米粒子的细胞摄取和光动力治疗示意图[59]Fig.5 Structures of TTB and the photodynamic therapy process of RGD−4R−MPD/TTB NPs[59]
肿瘤的光动力疗法效应随着深度的增加和微环境下氧气的匮乏逐渐减弱。为提高疗效,光动力疗法与基因疗法相结合被认为是一种新的治疗策略。Wang 等[65]将具有RNA 剪切功能的DNAzyme 和具有聚集诱导发光特性的Tb 分子负载于MnO2纳米片上,复合成纳米材料MDT。MDT 可通过AIE 光敏剂Tb 来进行光动力疗法,同时MDT 通过敲除EGR−1 基因的表达抑制细胞生长。结果表明,光动力疗法和基因疗法的联合治疗能够有效抑制小鼠肿瘤生长,提高抗肿瘤效率。
在光动力治疗过程中,癌细胞通过上调血管内皮生长因子(VEGF)水平来抑制PDT 治疗效果。同时,在肿瘤治疗中,小干扰RNA−血管内皮生长因子(siVEGF)用以抑制VEGF 的表达。Jin 等[66]报道了基于AIE 光敏剂的多功能治疗NPs,他们将DSPE−PEG2000−NH2通过GSH 可裂解的二硫键与siVEGF 连接,然后包裹具有AIE 性质的分子TTD,并在表面修饰靶向肽cRGD。结果表明,NPs 的PDT 与siRNA 联合治疗可产生协同效应,进一步改善图像引导PDT的治疗效果。siRNA 协同治疗下调了血管内皮生长因子mRNA 和蛋白的表达,提高了NPs 对MDA−MB−231细胞的杀伤效率。
2.2 可视化光热疗法
光热疗法(photothermal therapy, PTT)是一种利用光热剂将具有深层穿透能力的近红外光能转化为热能,通过局部组织热效应来治疗癌症的方法。PTT 作为一种新的治疗方法,在近红外光辐射下具有副作用小、自发荧光小、穿透深度大等优点,得到了人们的广泛研究[67−69]。另外,光热疗法可以促进细胞的转染效率及增加药物分子在细胞内的释放能力[70−71]。由于传统的荧光染料存在ACQ效应,PTT治疗过程往往发生荧光淬灭,相反,由于AIE荧光剂具有优异的荧光特性,在PTT 治疗过程中显示出极大的优势。Alifu 等[72]合成了一种双亲聚合物(F−127)包裹单分子聚集诱导发光剂(BPN−BBTD)的近红外光致发光系统,用于NIR−II 成像和同步光热治疗。BPN−BBTD 纳米粒子在800~1300 nm 范围内表现出宽发射,并且在785 nm 光照射下具有良好的光热转换能力,转换效率高达39.8%。结果表明,BPN−BBTD 纳米粒子引导的光热治疗一体化对皮下及原位肿瘤具有显著的抑制作用,同时能够长期(32 d)追踪皮下和原位肿瘤。
Wang 等[73]将光热剂二硫化钼(MoS2)纳米片嵌入到介孔二氧化硅纳米颗粒中,并在表面修饰聚集诱导发光荧光素PhENH2和靶向配体叶酸,以促进其靶向生物成像和光热治疗。结果表明,该纳米粒子在808 nm 激光照射下,通过AIE 荧光介导的光热治疗能够对MDA−MB−231 细胞(过表达FA 受体)产生有效杀伤作用。不同于光热剂MoS2,Fan 等[74]利用CuS 纳米颗粒作为光热剂,将CuS 附着在BTPE 修饰的介孔二氧化硅纳米颗粒表面,作为一种多功能的纳米热敏成像系统。
3 讨 论
将AIEgen 引入药物递送系统可以通过图像实时监测药物在细胞内的位置及释放过程,又因其可以在亲水生物环境中形成纳米聚集体而具有强烈的荧光,相较于传统癌症疗法,有利于对肿瘤进行精确诊断和特异性治疗。由于AIE 效应,AIEgen 在纳米粒子内的聚集浓度非常高,这使得在图像引导下的药物递送具有可靠的稳定性,不会发生光漂白现象。两亲性分子基质赋予了AIEgen 良好的生物相容性,延长了其在动物体内的血液循环时间,同时对AIE 纳米粒子进行表面修饰,可以进一步提高癌细胞的识别能力和特定细胞器的靶向药物递送。目前已经开展了基于AIEgen 荧光成像的化疗、光热/光动力治疗、基因治疗和多模式协同治疗,这些基于AIEgen 不同的治疗模式具有成像信噪比高、生物相容性好、治疗功能多样等优点。
虽然基于AIEgen 的药物递送与治疗已经取得了很大的进展,但仍然需要更多的努力来解决以下问题和挑战:(1)进一步扩大近IR−Ⅱ范围内AIEgen的多样性。IR−Ⅱ分子具有更高的信噪比和组织穿透深度,可以进行深层次组织生物成像。目前大多数AIEgen 的吸收位于蓝色和绿色区域,不适合图像引导的深层次治疗。(2)进一步提高多模式协同治疗。不同模式治疗的结合将有望在疾病诊断和治疗过程中提供更精准的检测和更有效的治疗。(3)进一步研究AIE 材料的毒性和清除问题。对于AIE材料的生物相容性和清除机制目前缺少研究,阻碍了AIE材料进一步的临床应用。(4)进一步利用临床样本进行癌症诊断成像。尽管基于AIEgen 的药物递送与治疗具有巨大的潜力,但是其在临床使用上还面临较多的问题,有待后续更深入的研究。
4 结论与展望
本文总结了近年来AIEgen 在药物递送与疾病治疗方面的研究动态。在AIE 荧光药物递送领域中,目前已经成功实现抗癌药物和基因的递送,同时也已经开发出了包括物理刺激和化学刺激在内的不同刺激行为下药物的释放方法,使得荧光药物递送实现时间和空间的远程精确控制。另外,AIE分子克服了传统荧光素的ACQ 效应,使其在光动力和光热治疗方面具有更大的优势。相信不久的将来,AIE 分子会在可视化药物递送与治疗方面呈现出更深的组织穿透、更高的信噪比和更高的亮度等优势,进而为人类疾病的防控提供新的技术和手段。
