中晚期宫颈鳞癌患者CTLA-4的表达与临床特征分析
2020-09-28范佩文马苗苗冯亚宁王若峥
范佩文, 马苗苗, 冯亚宁, 王若峥
(1新疆肿瘤防治研究所, 乌鲁木齐 830011; 2新疆肿瘤学重点实验室, 乌鲁木齐 830011;3中国医学科学院肿瘤免疫与放疗研究重点实验室, 乌鲁木齐 830011;4新疆维吾尔自治区人民医院放疗二科,乌鲁木齐 830001)
宫颈癌目前依然是新疆地区妇女面临的重大疾患之一,HPV作为宫颈癌独立诱发因素,在宫颈病变恶化过程中发挥重要作用,同时,作为一种外源性病毒抗原,可以诱导机体发生免疫反应。肿瘤微环境中包含癌细胞、免疫细胞和多种细胞因子等成分,其中T细胞的数量和功能对宿主肿瘤细胞的清除起至关重要的作用,肿瘤抗原特异性T细胞的功能耗竭是造成肿瘤细胞免疫逃逸的主要机制,抗肿瘤应答的强弱直接影响肿瘤患者的预后[1-3]。
细胞毒性T淋巴细胞抗原-4 (cytotoxic-T-lymphocyte-antigen-4, CTLA-4)又称CD152,属于CD28免疫球蛋白亚家族,是一种主要由T细胞表达的抑制性受体,其基因位于2号染色体长臂33带(2q33)上,其配体CD80和CD86通常存在于抗原递呈细胞的表面,结合后分别产生共刺激或共同抑制反应[4-5]。研究表明,CTLA-4等免疫检查点分子高表达是肿瘤T细胞功能性耗竭的重要标志[6-7],并与肿瘤患者临床特征、疗效和预后有关[8-9]。通过阻断这些免疫检查点的信号通路,能有效地恢复耗竭T细胞的功能[10-11]。
本研究纳入HPV16型感染的中晚期宫颈鳞癌患者,采用多色流式细胞技术检测患者外周血和癌组织中T细胞上CTLA-4表达情况,对比分析宫颈癌患者外周血、癌组织中CD4+、CD8+T细胞上CTLA-4的表达差异,探讨其表达与临床特征的相关性,检测宫颈癌患者放射治疗过程中PBMCs中T细胞上CTLA-4等免疫检查点分子的动态改化,为中晚期宫颈鳞癌患者放疗联合免疫治疗的应用提供理论基础。
1 材料与方法
1.1 研究对象收集2017年2月-2018年8月,就诊于新疆医科大学附属肿瘤医院妇科放射治疗病区的63例中晚期宫颈鳞癌患者。所有患者均为HPV16型感染,年龄39~80岁;患者中IIB期31例,占49.2%,IIIA~IIIB期32例(50.7%);低分化鳞癌20例(31.7%),中分化鳞癌37例(58.7%),乳头状鳞癌6例(9.5%)。收集行放射治疗前、治疗中和治疗结束资料完整的患者22例,年龄范围31~71岁;IIB期12例,III期10例;低分化鳞癌10例,中分化鳞癌12例。所有患者的治疗均遵照卫计委宫颈癌诊疗规范,NCCN指南(2018版),行放射治疗的患者采用适形调强技术进行盆腔外照射,外照射剂量为45~50 Gy;腔内放疗采用Ir192后装机,腔内后装治疗A点剂量为6G y/周,A点总剂量为36~42 Gy,周围器官的保护剂量不大于A点剂量的60%。放疗中给予同步化疗,4~6个周期的顺铂40 mg/m2静脉滴注,或3~4个周期的紫杉醇135 mg/m2静脉滴注。对于不能耐受或拒绝化疗的患者,仅行局部放射治疗。
1.2 研究方法
1.2.1 血液样本留取和处理 采集患者EDTA抗凝外周血10ml,经4℃,3 000 rpm离心10 min后分离获得血浆和血细胞,血细胞中按1:1体积加入RPMI 1640培养基(Sigma公司)混匀,加入等体积淋巴细胞分离液(Sigma公司),密度梯度离心后获得外周血单核细胞(peripheral blood mononuclear cells, PBMCs)。
1.2.2 组织样本留取和处理 取常规病理检查之外剩余的活检组织标本,大小约3 mm×3 mm×3 mm/块,经RPMI-1640培养基漂洗后剪碎转移到中,按照组织分离试剂盒说明书加入所需的分解酶,将组织消化悬液混匀后置于组织分离器(美天旎生物技术有限公司)上进行初步分解后,将C管置于旋转器中进一步利用分解酶消化获取单细胞。将分解消化后的组织悬液经细胞筛过滤以获取包含肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes, TILs)的单细胞悬液。
1.2.3 流式细胞术检测CTLA-4在CD4+T和CD8+T细胞上的表达 向分取的PBMCs和TILs中离心加入Live/dead染料,4℃避光染色20 min后,用FACS 清洗液洗涤两次后,加入针对表面抗原的CD3(AF700, BD公司)、CD4(FITC, BioLegend公司)、CD8(APC-H7, BD公司)和CTLA-4(PE-Cy7, BioLegend公司)荧光标记抗体,再次避光染色后,用BD LSRFortessa流式细胞分析仪(BD公司)检测。
1.3 统计学处理采用SPSS 21.0统计软件包,图表绘制采用GraphPad Prism 7.0进行;PBMCs和TILs中CD4+、CD8+T细胞上免疫检查点分子CTLA-4的表达结果为非正态分布,以中位数(25%,75%)描述;组间比较采用秩和检验;PBMCs和TILs中CD4+、CD8+T细胞上CTLA-4表达的相关性采用Spearman分析;检验水准α=0.05。
2 结果
2.1 中晚期宫颈鳞癌患者PBMCs和TILs中CD4+、CD8+T细胞CTLA-4的表达63例患者 PBMCs中CD4+ T细胞的CTLA-4表达量为4.59%,CD8+CTLA-4+T细胞的表达量为22.50(8.36,25.40)%; TILs中CD4+CTLA-4+T细胞的表达量为5.20(3.01,9.72)%,CD8+CTLA-4+T细胞的表达量为4.95(2.60,15.80)%。PBMCs和TILs中CD4+ T细胞上CTLA-4表达量对比分析,差异无统计学意义(Z=-0.751,P=0.052);PBMCs中CD8+ T细胞上CTLA-4的表达量高于TILs,差异有统计学意义(Z=-5.445,P<0.001)。见图1。
2.2 中晚期宫颈鳞癌患者PBMCs和TILs中CD4+、CD8+T细胞CTLA-4表达的相关性患者PBMCs和TILs中CD4+CTLA-4+T细胞的相关性分析方程Y=-0.103X+8.827,差异无统计学意义(r=0.081,P=0.530);PBMCs和TILs中CD8+CTLA-4+T细胞的相关性分析方程Y=0.361X+17.250,差异无统计学意义(r=0.184,P=0.149); CD4+CTLA-4+和CD8+CTLA-4+T细胞在PBMCs和TILs中表达无相关性。见图2。


图1 中晚期宫颈鳞癌患者PBMCs和TILs中CD4+T、CD8+T细胞CTLA-4的表达
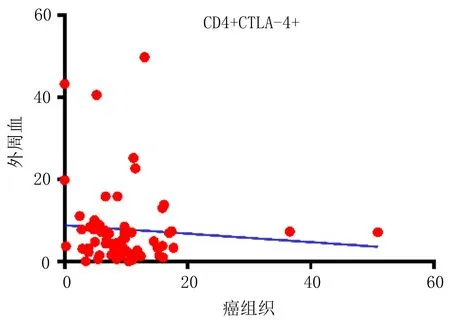

图2 中晚期宫颈癌患者PBMCs和TILs中CD4+T、CD8+T细胞CTLA-4表达的相关性
2.3 中晚期宫颈鳞癌患者PBMCs和TILs中CD4+、CD8+T细胞CTLA-4的表达与临床特征的对比中晚期宫颈鳞癌患者PBMCs中T细胞上CTLA-4的表达量在病理分级中比较,均发现在乳头状鳞癌中最高,其中CD4+T细胞的CTLA-4表达量中分化组为4.33(2.37,7.25)%、低分化组为4.97(1.48,8.78)%,乳头状组为17.55(8.29,31.90)%,差异有统计学意义(Z=7.741,P=0.021);CD8+CTLA-4+T细胞的表达量在病理分级中比较,中分化组21.80(11.69,26.75)%、低分化组22.20(7.21,29.33)%,乳头状分组43.25(31.30,49.38)%,差异有统计意义(Z=7.741,P=0.021);CTLA-4的表达在其他临床特征间比较差异均无统计学意义。患者TILs中CD4+CTLA-4+T和CD8+CTLA-4+T细胞表达量在各临床特征间比较,差异均无统计学意义,见表1、2。
2.4 宫颈鳞癌患者PBMCs中放射治疗前、中、后CD4+、CD8+T细胞CTLA-4表达的对比22例行放射治疗的患者PBMCs中CD4+CTLA-4+T细胞的表达量在治疗前、中和结束时分别为为3.94(1.85,5.70)%、6.80(3.38,41.13)%和7.86(4.47,13.23)%;放疗前与放疗中比较,差异无统计学意义(Z=-2.448,P=0.013);放疗前与放疗结束时比较,差异有统计学意义(Z=-2.653,P=0.008);患者PBMCs中CD4+CTLA-4+T细胞的表达量随放疗进程呈升高趋势。CD8+ T细胞的CTLA-4表达量在放疗前、中和结束时分别为23.40(11.78,3.98)%、27.90(21.95,57.20)%和37.10(18.80,51.73)%,三者比较差异无统计学意义,见图3。

表1 宫颈鳞癌患者PBMCs中CD4+T、CD8+T细胞CTLA-4的表达与临床特征的比较
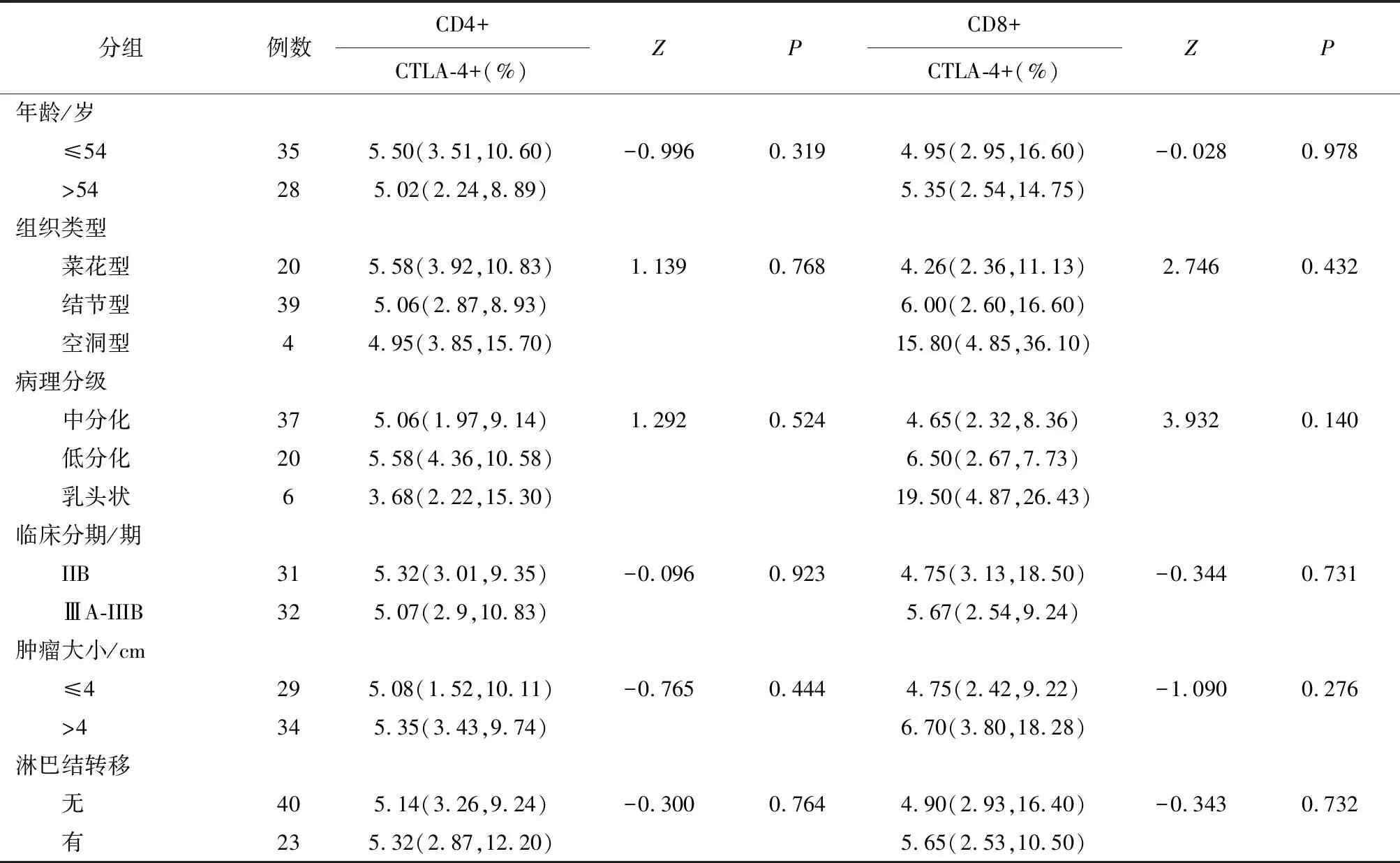
表2 宫颈鳞癌患者TILs中CD4+T、CD8+T细胞CTLA-4的表达与临床特征的比较
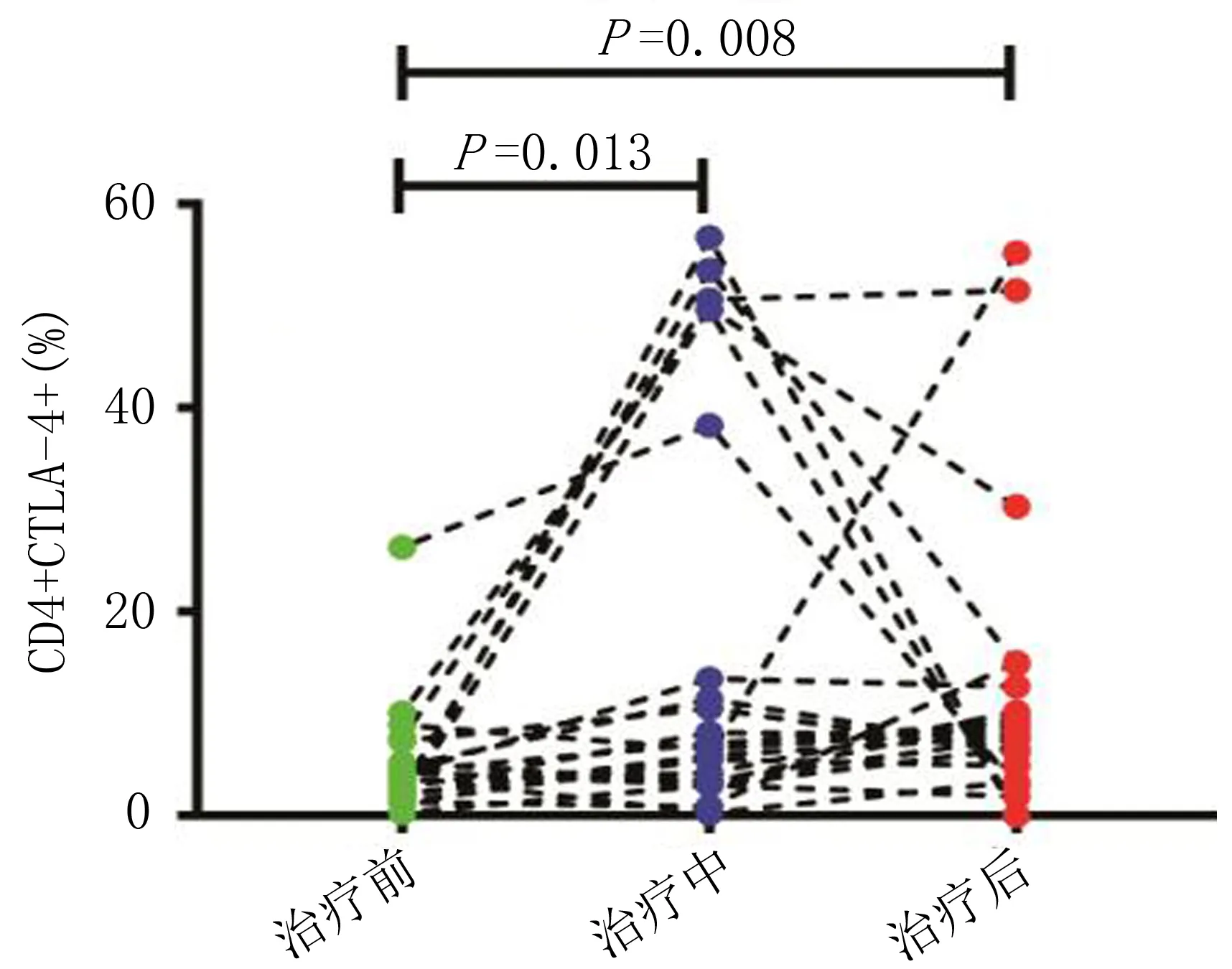

图3 22例中晚期宫颈鳞癌患者放疗前、中、后PBMCs中CD4+T、CD8+T细胞CTLA-4的表达
3 讨论
机体的免疫功能和肿瘤的发生、发展密切相关,其中T细胞介导的免疫反应对清除肿瘤细胞和防止肿瘤发生转移起关键作用[12-13]。正常情况下,机体可以利用免疫系统清除体内的HPV,然而随着持续感染的发生,机体的免疫系统对外源性抗原的识别和清除能力下降,使得受到HPV感染的细胞在宫颈局部组织中存活并大量繁殖,最终导致恶性肿瘤的生成[14-15]。作为影响T细胞功能的关键因素,CTLA-4和抗CTLA-4抗体通过介入免疫微环境,发挥高效功效并补充传统药物而具有特殊的治疗作用,从而为宫颈癌等恶性肿瘤的治疗创造了新的机会。
已有研究报道,在卵巢癌微环境中,CTLA-4等共抑免疫检查点分子参与可导致TILs失活,CTLA-4的阻断有利于卵巢肿瘤碎片中CD8+ TILs的增殖,在肿瘤微环境中靶向CTLA-4可丰富肿瘤反应性TILs,并可能提高基于TILs的过继疗法在卵巢癌中的临床疗效[16]。此外,有学者利用37例宫颈癌患者的癌以及阳性淋巴结组织进行研究,结果发现,CTLA-4、PD-1、Tim-3等免疫检查点分子在T细胞上均有表达,并且在CD4+T细胞上的表达量CTLA-4>PD-1>Tim-3; CD8+T细胞上的表达量PD-1>CTLA-4>Tim-3[17]。本研究通过对HPV16型感染的中晚期宫颈癌患者的研究发现,外周血PBMC中CTLA-4的表达量在CD8+T细胞中22.50(8.36,25.40)%高于CD4+T细胞中4.59(2.06,7.78)%;而癌组织TILs中CD4+CTLA-4+T细胞的表达量5.20(3.01,9.72)%高于CD8+CTLA-4+T细胞的表达量为4.95(2.60,15.80)%,这与上述学者的研究结果较为一致。
本研究分析发现患者CD8+CTLA-4+T细胞的表达量在PBMCs中显著高于TILs中(P<0.01),而通过相关性分析发现PBMCs与TILs中的表达不存在相关性。推测可能由于CTLA-4基因可编码2种形式的蛋白:一种是膜性蛋白,另一种是可溶性的单体蛋白。研究发现,CTLA-4表达于活化的CD4+、CD8+T细胞膜上,在静息和幼稚T细胞中不表达,而是滞留在某些细胞器中,如高尔基体、内质网、囊泡等;当T细胞活化后,这些滞留的CTLA-4蛋白能够迅速转移至细胞膜表面[18]。Adriana 等[19]测定了CTLA-4在不同宫颈癌细胞系细胞表面的表达,结果显示其在细胞表面非常低或不表达,因此进一步评估了该蛋白的细胞内形态,发现所有宫颈癌细胞系都表达CTLA-4 (0.5~35%),也证明了该推测。另外本实验采用流式细胞技术仅检测到外周血中T细胞膜上CTLA-4表达,也可能是出现此结果的原因,需要进一步研究验证。
有研究者利用宫颈癌患者和健康女性的血浆,采用改良的ELISA方法检测CTLA-4自身抗体,发现CTLA-4自身抗体在宫颈癌患者中的表达量高于健康女性对照者,在宫颈癌II期患者中高于I期患者[20]。本研究探讨了外周血和癌组织中细胞上CTLA-4的表达与患者临床特征的关系。结果显示,PBMCs中CD4+和CD8+T细胞CTLA-4的表达量在病理分级上存在差异,在乳头状鳞癌组中表达量高于低分化组,中分化组表达量最低(P<0.05)。既往研究证实,在多种恶性肿瘤中CD4+或CD8+T细胞上CTLA-4的表达与临床特征密切相关,如病理分级、临床分期以及淋巴结转移等,而免疫检查点分子的过度表达对患者的预后也有影响[21]。
已有研究表明,电离辐射会直接造成DNA的损伤,并产生活性氧和自由基,导致DNA、蛋白质和脂质膜损伤,进而导致细胞畸形、凋亡、坏死甚至癌变[22]。本研究纳入了22例接受放射治疗的患者,收集放放疗前、中期及结束时3个阶段的外周血,检测CTLA-4在T细胞中的表达情况。分析发现,随着放疗剂量的累积,患者CD4+T、CD8+T细胞中CTLA-4表达均有升高趋势,随着治疗结束表达有下降趋势,其中在CD4+T细胞中CTLA-4的表达量在放疗前后差异有统计学意义(P<0.05),提示放射治疗可能对机体有免疫抑制的影响。Wilkins等[23]报道了抗CTLA-4抑制剂ipilimumab联合姑息性放疗在39例非小细胞肺癌患者中的临床结果和转译结果,研究发现有18%的患者存在放射学反应,并且有31%的患者病情得到了控制。这些临床结果似乎优于仅使用ipilimumab的历史研究,并提示在一些患者中,辐射可能触发了全身,即所谓的远性免疫反应。表明通过优化放射治疗分割计划和抗CTLA-4抑制联合应用可以产生额外反应效应。
综上所述,CTLA-4在宫颈癌患者外周血和癌组织中均有表达,且随着放射治疗剂量的累加存在变化。随着对T细胞耗竭机制的深入研究和对肿瘤治疗方法的不断探索,新的免疫检查点分子靶标的发现日新月异,靶向药物的推陈出新,相信未来免疫治疗会给宫颈癌患者的治疗带来更多希望。
