克氏原螯虾肝胰腺损伤模型的建立
2020-09-27吴峪楠杨移斌刘永涛刘绍春艾晓辉
吴峪楠,杨移斌,周 顺,刘永涛,董 靖,刘绍春,艾晓辉
(1.上海海洋大学水产科学国家级试验教学示范中心,上海 201306;2.中国水产科学研究院长江水产研究所,农业农村部水产品质量安全控制重点试验室,湖北省水产品质量安全工程技术研究中心,武汉430223;3.岳阳渔美康生物科技有限公司,湖南岳阳 414199)
克氏原螯虾(Procambarusclarkia),也称小龙虾、红螯虾、克氏螯虾,在分类上属节肢动物门(Arthropoda),甲壳纲(Crustacea)十足目(Decopoda)螯虾科(Cabaridae)。克氏原螯虾是我国种群数量最大的淡水虾类之一,其肝胰腺可以分泌与合成消化酶、脂肪酶和酯酶,对营养物质进行吸收[1,2],同时也影响无机物的贮藏、糖类代谢、排泄、蜕皮周期等过程,通常可观察虾的肝胰腺作为判断健康状况的标志[3]。目前水产动物的肝损伤模型研究多为鱼类肝损伤模型[4-6]。甲壳动物的模型研究已有病毒、细菌的预测模型见诸报道[7-9],关于甲壳动物肝胰腺损伤模型的报道则较少。
高效氯氰菊酯,化学名称2,2-二甲基-3-(2,2-二氯乙烯基)环丙烷羧酸-α-氰基-(3-苯氧基)-苄酯,是一种常见的杀虫剂,常用于清塘和防治寄生虫疾病。菊酯类农药对鱼类、虾蟹类等水生动物的毒性很高,会造成许多组织器官的病变[10]。高效氯氰菊酯对作为一种疏水性化合物,能聚集在细胞膜周围,改变膜的流动性,破坏膜的结构,导致氧自由基增多[16,17],进而使鳃和肝胰腺等组织器官受到氧化损伤[11]。
本研究以克氏原螯虾为试验对象,用高效氯氰菊酯诱导克氏原螯虾肝胰腺的损伤,探索克氏原螯虾肝胰腺损伤模型的合适时间与浓度,筛选肝胰腺损伤程度评价指标,为研究克氏原螯虾肝胰腺损伤的发生、发展,肝胰腺损伤的病理特征,以及评价肝胰腺损伤相关防治药物等奠定基础。
1 材料与方法
1.1 药品与试剂
高效氯氰菊酯:购于武汉中博水产生物技术有限公司,药品有效成分含量为4.5%,以此配置成母液,根据试验需要稀释成不同浓度试剂,现配现用。
生化指标试剂盒:SYSMEX CHEMIX-180全自动生化分析仪配套试剂盒。
抗氧化酶和氧化产物检测试剂盒:南京建成生物工程公司生产的SOD(超氧化物歧化酶)酶试剂盒、CAT(过氧化氢酶)酶试剂盒和氧化产物MDA(丙二醛)试剂盒。
苏木精、伊红染液:购买自武汉皮诺飞生物科技有限公司。
1.2 试验动物与养殖条件
克氏原螯虾购自湖北省荆州市沙市农场洪塘分场,选择附肢完整、活力强、规格相近的克氏原螯虾用于试验,试验用虾体重(23±0.67)g。试验开始前将克氏原螯虾放入规格为(40 cm×30 cm×60 cm)的水族箱中暂养7 d,养殖水深10 cm,试验用水为经充分曝气3 d的自来水,水温(25±1)℃,连续充气增氧以保证水中溶氧充足。每天投喂小龙虾饲料2次(9:00和16:00),投喂量为虾体重的1%~3%,每天清除残饵与粪便并换水1/3,以保证水质清洁。
1.3 试验设计
建模浓度确定:根据文献[10]可知,4.5%高效氯氰菊酯农药对克氏原螯虾的96 h LC50为0.2 μg/L,在此基础上进行预实验,根据结果96 h LC50的1/40、1/20、1/10三个浓度对克氏原螯虾是安全的,高于此浓度会导致克氏原螯虾死亡。因此选择0.00、0.005、0.01、0.02 μg/L四个浓度进行试验。试验在水族箱中进行,养殖水体积30 L,水温(25±1)℃。准确加入相应体积的4.5%高效氯氰菊酯农药,每组30尾虾。观察并记录克氏原螯虾的中毒症状和死亡数(用玻璃棒触碰虾腹部5 min内无反应即视为死亡[18]),死虾及时捞出。试验开始后0.5、1、2 d采集虾样,每个浓度组6尾虾。试验期间每天换水1/2并加入相应体积4.5%高效氯氰菊酯农药,以保证水体药物浓度不变。试验前1 d停止投喂饲料,试验期间不投喂饲料。
建模天数确定:克氏原螯虾随机放入水族箱,30尾/箱。试验分成4组,设置2个试验组和2个空白对照组,每组10尾虾。试验前克氏原螯虾隔夜禁食。通过浓度确定试验结果,选择最适给药浓度进行试验,试验条件同模型浓度确定试验,观察克氏原螯虾的表现症状,于染毒后0.5、1、2、3、5、7、14 d分别从空白组和试验组采集6尾虾取样。
肝胰腺损伤程度评价指标筛选与病理切片观察:根据浓度确定试验设置给药浓度,给药方法同建模天数确定试验。在试验第0.5、1、2、3、5、7、14天时从水族箱随机采集6尾虾,采集血清测定生化指标TP(血清总蛋白)、ALP(碱性磷酸酶)和GLU(血糖),采集肝胰腺测定超氧化物歧化酶SOD、CAT和氧化产物MDA和病理切片观察。
1.4 样品采集与测定
1.4.1 样品采集
在各时间点取出克氏原螯虾,称重后用酒精擦拭头胸甲部分,用无菌注射器从克氏原螯虾围心腔采集血淋巴,放入无菌离心管中,在4 ℃,10 000 r/min条件下离心10 min,取上层血清于-20 ℃保存,用于测量生化指标。快速解剖取出虾的肝胰腺,用预冷生理盐水清洗,滤纸吸干;取一小部分放入福尔马林中固定,用于制作病理切片;剩余部分置于-20 ℃冰箱保存,用于测定抗氧化酶和氧化产物。
1.4.2 样品测定
血清生化指标测定:冻存血清置于4 ℃冰箱解冻,生化指标(AST、ALT、TP、ALP和GLU)测定使用SYSMEX CHEMIX-180全自动生化分析仪检测。
肝胰腺抗氧化酶和氧化产物测定:克氏原螯虾肝胰腺样品解冻后称重,按照1 ∶9(W/V)比例加入预冷生理盐水,用玻璃匀浆器制备10%的组织匀浆,在4 ℃、3 000 r/min条件下离心10 min,取上清液,4 ℃保存并于1天内进行测定。抗氧化酶指标SOD、CAT和氧化产物MDA的测定方法按照试剂盒说明书操作。
组织病理切片观察:肝胰腺经酒精梯度脱水、二甲苯透明、石蜡包埋后组织切片,切片厚度4~5 μm,HE染色,中性树胶封片,光学显微镜下观察。
1.5 数据分析
采用SPSS 21.0 软件进行统计学分析,各组数据均表示为平均数±标准差。多组数据的统计方法采用单因素方差分析(one-way ANOVA)法,当差异显著时,采用Duncan′s法进行多重比较;两两数据的比较方法采用独立样本t检验方法。P<0.05为差异显著。
2 结果与分析
2.1 不同浓度高效氯氰菊酯对克氏原螯虾血清转氨酶的影响
由图1可知,经过不同浓度高效氯氰菊酯给药后,与空白对照组相比,克氏原螯虾血清AST活性在0.5、1 d时所有实验组皆没有显著变化;给药2 d后,仅0.02 μg/L实验组与空白对照组相比,AST活性有显著升高。
不同浓度高效氯氰菊酯对克氏原螯虾ALT活性的影响见图1,0.02 μg/L高效氯氰菊酯实验组在0.5 d时与对照组相比无显著变化,在1 d和2 d时与对照组相比,ALT活性均显著升高。其他浓度给药组各时间点与对照组无显著差异。
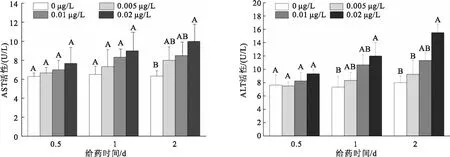
图1 不同浓度高效氯氰菊酯对克氏原螯虾血清转氨酶活性的影响
根据试验结果,确定0.02 μg/L高效氯氰菊酯为建立克氏原螯虾肝胰腺损伤模型的适宜染毒模型浓度。
2.2 不同时间高效氯氰菊酯对克氏原螯虾血清转氨酶的影响
根据2.1的结果,采用0.02 μg/L高效氯氰菊酯对克氏原螯虾进行给药,各时间点克氏原螯虾的血清AST和ALT活性见图2。

图2 不同时间克氏原螯虾血清转氨酶变化
与空白对照组相比,染毒2 d后实验组AST活性开始显著上升,至第3 d达到峰值,差异极显著。第7 d时有所下降,但仍显著高于空白对照组14 d时AST活性和空白对照组之间已没有显著差异。实验组 AST活性第2天至第5天显著高于0.5天实验组的AST活性,总体呈现先上升后下降的趋势。各时间点对照组 AST值无显著变化。
与空白对照组相比,1 d后实验组的血清ALT活性显著升高,3 d时ALT活性达到峰值,在5 d时开始下降并持续到第7 d,但仍显著高于空白对照组。第14天时实验组ALT活性恢复至正常水平。实验组 ALT活性在第1天至第3 d显著高于0.5 d实验组的ALT活性,第5 d时ALT活性接近0.5 d时ALT活性,总体呈现先上升后下降的趋势。各时间点对照组 ALT值无显著变化。
根据试验结果,在第3 d时,血清转氨酶活性与空白对照组相比有显著变化;第3 d时血清转氨酶活性与实验组0.5 d时相比有显著变化。因此确定3 d作为克氏原螯虾肝胰腺损伤模型的适宜染毒模型天数。
2.3 克氏原螯虾肝胰腺损伤程度评价指标筛选
2.3.1 克氏原螯虾血淋巴生化指标筛选
由表1可以看出,在试验开始后至第2 d,实验组TP含量相比空白对照组略微下降,无显著差异(P>0.05);随着时间延长,TP含量呈现下降趋势。第3 d时TP含量对比空白对照组显著下降(P<0.05),第5 d开始TP含量极显著降低且持续至第14 d(P<0.01)。与实验组0.5 d相比,第5 d至第14 d实验组TP含量出现显著降低(P<0.05),说明此时肝胰腺出现较严重损伤。
根据表1,对比对照组ALP活性在2 d时升高,第3 d降低,第5 d升高,变化均没有显著差异(P>0.05),且变化无明显规律。GLU的变化如表1所示,在第2 d实验组数值下降,第3 d又上升,和空白对照组相比全程无显著变化,没有明显变化规律。
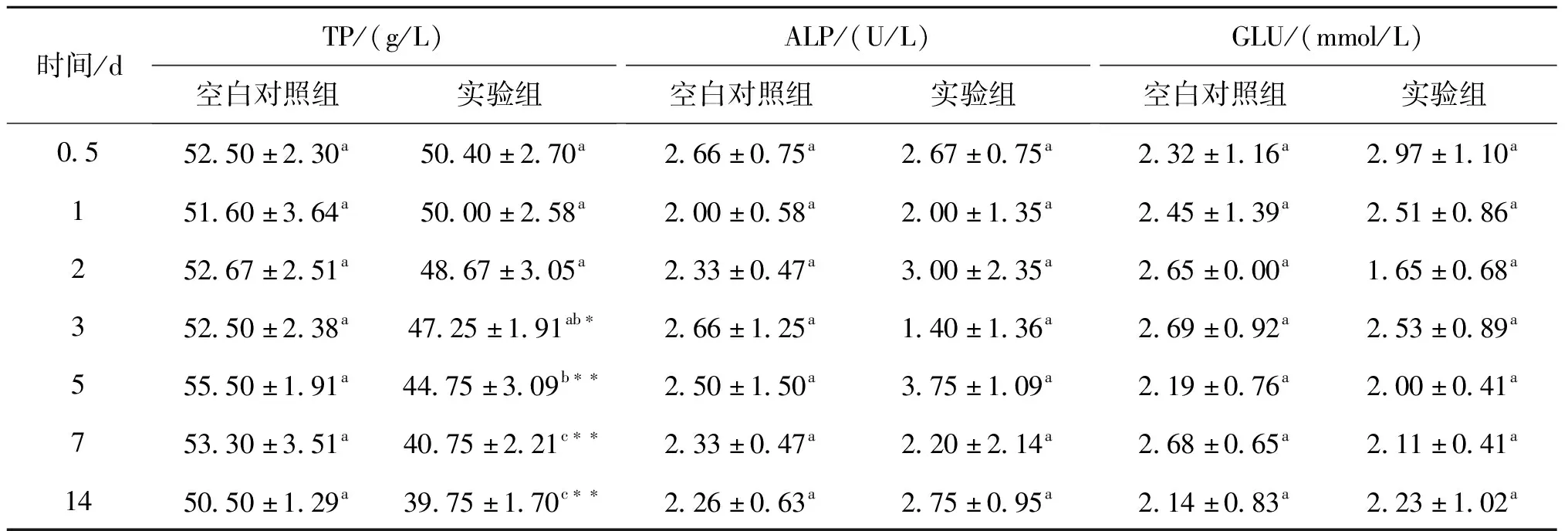
表1 高效氯氰菊酯给药后各时间点血清生化指标水平
2.3.2 克氏原螯虾肝胰腺抗氧化指标筛选
高效氯氰菊酯对克氏原螯虾肝胰腺CAT活性影响随时间变化情况如图3所示,各时间点空白对照组 CAT值无明显变化(P>0.05)。与空白对照组相比,给药1 d后,实验组CAT活性显著上升(P<0.05),到第3 d时CAT活性达到最大值且显著高于空白对照组(P<0.05),第7 d时CAT活力下降至与空白对照组相似(P>0.05),14 d时CAT活力显著低于空白对照组(P<0.05)。CAT活性总体呈现先上升后下降趋势。
由图3可知,与空白对照组相比,实验组SOD活性在第2 d开始显著升高(P<0.05),第3 d时达到最高峰,差异极显著(P<0.01)。第5 d活性下降,与空白对照组相比仍显著升高(P<0.01)。第7 d SOD活性接近对照组,无显著差异(P>0.05),第14 d时SOD活性恢复至正常水平(P>0.05)。与实验组0.5 d相比,第2 d至5 d实验组SOD活性显著升高(P<0.05),SOD活性总体呈现先上升后下降趋势。
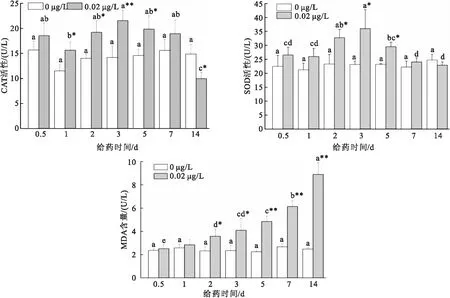
图3 不同时间克氏原螯虾肝胰腺CAT、SOD和MDA水平
根据结果,对比空白对照组,肝胰腺MDA的含量在试验第2 d显著增加(P<0.05),随着时间增加,MDA含量极显著增多(P<0.01),并一直持续至14 d。与实验组0.5 d相比,第2 d至第14 d实验组MDA的含量显著降低(P<0.05)。
2.4 高效氯氰菊酯胁迫下克氏原螯虾肝胰腺组织结构观察
对0.20 μg/L实验组的不同时间的组织切片观察发现,试验开始0.5 d后,空白对照组克氏原螯虾肝胰腺小管呈星形,结构完整,细胞饱满,分布均匀,肝管上可见少量棕色颗粒(图4-1)。而0.5 d后克氏原螯虾肝管上皮细胞内可见大量液泡,与0.5 d空白对照组比较,未见淤血或炎症反应,肝管上棕色颗粒数量增多(图4-2)。处理1 d后切片显示,克氏原螯虾肝管排列紧密,肝管上皮细胞内可见大量液泡,肝管上可见少量棕色颗粒,与对照组比较,管腔未见明显变窄(图4-3)。2 d时肝管上皮细胞内可见大量液泡,管腔未见明显变窄,肝管上可见少量棕色颗粒,局部肝管排列疏松,间隙增宽,间质可见少量炎性细胞渗出,炎症反应出现(图4-4)。实验组给药3 d时,肝管排列较紧密,肝管上可见少量棕色颗粒,肝管上皮细胞内可见大量液泡,少量液泡明显增大,间质偶见炎性细胞渗出(图4-5)。第5 d时,实验组肝管上可见大量液泡,肝管上可见少量大液泡,并可见破裂后相互融合,肝管上可见少量棕色颗粒,肝管排列疏松,间隙大(图4-6),肝细胞出现较明显损伤且损伤不可逆转。第7 d时,肝细胞坏死溶解(黑色箭头),可见棕色颗粒增多,肝管上皮细胞内可见大量液泡管腔变大(图4-7)。实验组14 d时,棕色颗粒数量减少,肝细胞肿大,细胞数量明显减少,肝胰腺小管基膜破裂,肝胰腺小管结构受损严重(图4-8)。
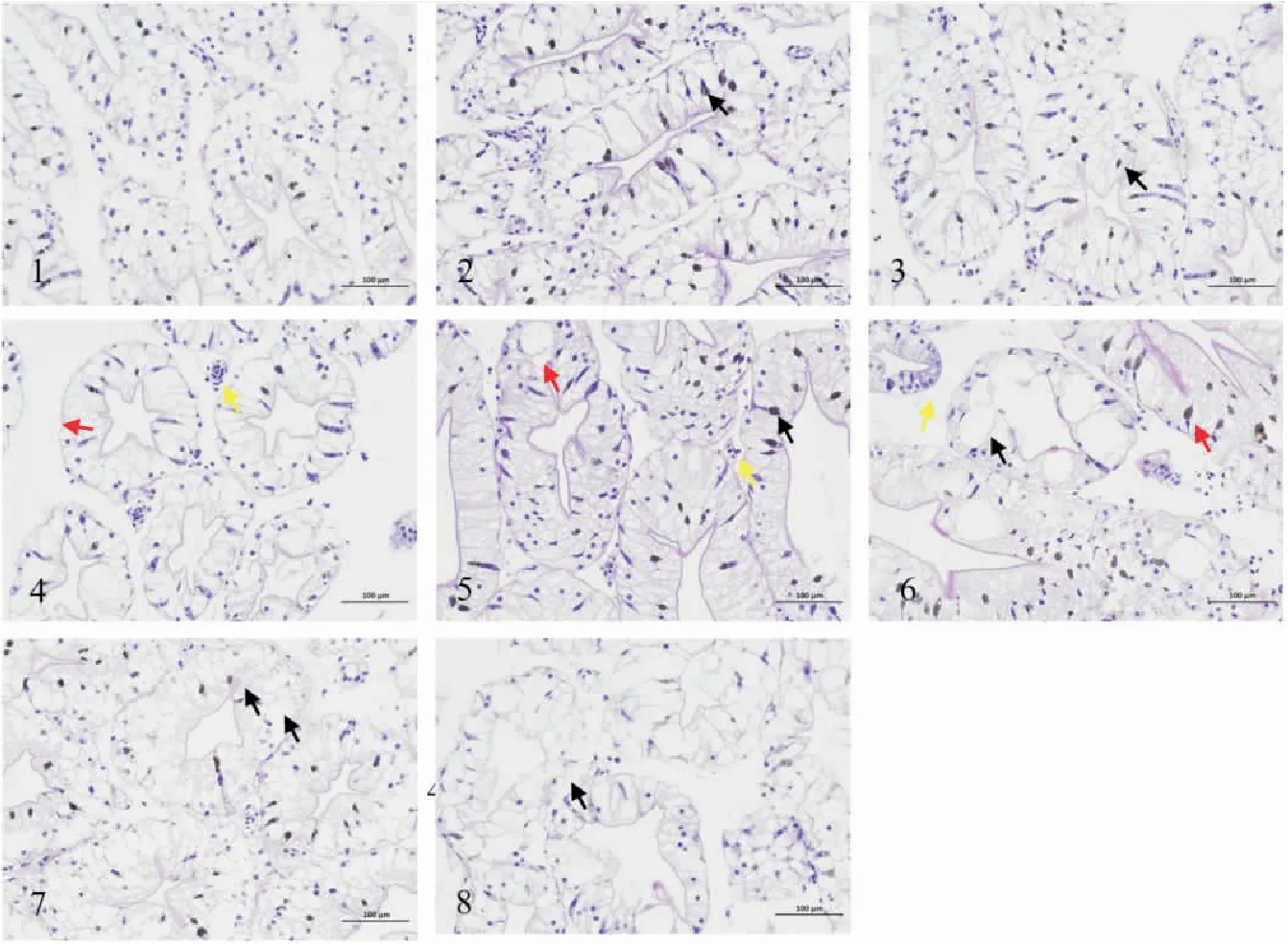
图4 克氏原螯虾肝胰腺组织病理
3 讨论
3.1 高效氯氰菊酯对克氏原螯虾血清生化指标的影响
ALT主要存在于细胞质内,而 AST主要存在于线粒体和细胞质中。正常情况下二者只有极少量释放入血液,当肝组织受到急性损伤时,这两种酶会随组织损伤逸出脏器,使血清中转氨酶的活性显著升高[19]。如果血清ALT升高并同时伴有AST明显升高则提示肝细胞严重受损,因此转氨酶是评价肝脏损伤程度的重要指标。卢敬让等[20]的研究发现,在不同镉浓度胁迫中华絨螯蟹条件下,血清ALT活力随着镉浓度增加而升高;同一镉浓度组中,ALT活力在72 h内随时间增加而提高,该实验结果与本试验结果一致。在本试验中,0.02 μg/L实验组给药1 d时ALT活性开始显著升高并持续至第3 d,第5 d ALT活性降低,说明第1 d至第3 d克氏原螯虾的肝细胞膜受到损害,细胞膜通透性增加导致血清中ALT活性升高;第5 d开始肝细胞损伤已进入较严重阶段,肝细胞中ALT流失较多,因此血清ALT的活性下降。本试验AST活性在第3 d时显著升高,第5 d时有极显著升高,由于AST主要分布于肝细胞的线粒体和细胞质中,因此AST的升高晚于ALT。根据结果推测第1 d至第3 d处于肝损伤的进展阶段,第5 d时克氏原螯虾肝胰腺损伤较严重,可能已经造成线粒体损伤。
血清总蛋白TP为血清中所含各种蛋白质的总称,TP主要由肝脏合成,当血液中TP降低,则反映肝脏合成功能和肝实质细胞储备功能的下降[21]。试验结果显示第3 d时TP含量出现显著降低,说明第3天开始肝胰腺细胞受到损伤;第5 d呈现极显著降低且持续至14 d,表示第5 d开始肝胰腺出现不可逆损伤导致TP含量持续降低。ALP和GLU的检测结果未表现出明显规律可能与检测方法不适用于克氏原螯虾有关。
3.2 高效氯氰菊酯对克氏原螯虾肝胰腺的抗氧化结果的影响
SOD和CAT是机体抗氧化系统的关键酶,MDA是脂质过氧化的代谢产物,这 3 个指标的变化能反映机体受氧化损伤程度。杨宗英等[22]研究发现1.6、8.0和16.0 μg/L阿维菌素胁迫克氏原螯虾96 h,克氏原螯虾肝胰腺SOD的活性呈现先上升后下降的趋势,CAT和MDA的值随着时间增加而增大。陶易凡等[23]研究发现,高pH(pH=10.2)胁迫克氏原螯虾96 h后,克氏原螯虾的肝胰腺CAT活性呈现先升高后降低的趋势,SOD活性呈逐渐下降的变化趋势,MDA的含量随着时间增加而增大。本试验中,肝胰腺CAT的活性在从第1 d开始与空白对照组相比显著升高,SOD的活性在第2 d开始显著升高,在第3 d时活性均达到最大,同时肝胰腺中的 MDA含量持续升高,说明此时是高效氯氰菊酯对克氏原螯虾的氧化胁迫进展阶段,细胞产生损伤同时尚能产生抗氧化酶与自由基对抗;第5 d之后CAT和SOD的活性开始下降,但仍然高于对照组,MDA的含量与0.5 d相比显著升高,此时机体的活性氧产生速度超过了对活性氧的清除能力,说明肝胰腺受到的氧化损伤较严重,机体的抗氧化平衡受到破坏。14 d时实验组CAT活性显著低于对照组,SOD的活性略低于对照组,此时MDA大量积累,肝胰腺损伤严重。本试验与其他研究结果不同的原因可能是由于不同的药物对克氏原螯虾的毒性不一样有关。
3.3 高效氯氰菊酯对克氏原螯虾肝胰腺组织结构的影响
克氏原螯虾的肝胰腺位于头胸部中央,心脏前方,肝胰腺小管是其结构和功能的基本单位,肝胰腺是甲壳动物进行解毒、排泄和代谢的重要器官。本试验中,随着给药时间增加,肝胰腺细胞中空泡数量增加,体积增大,这与中华絨螯蟹受到溴氰菊酯胁迫表现出的症状相似,因此肝胰腺上皮细胞空泡中可能含有氯氰菊酯或其代谢物,空泡的作用是将有毒物质排出体外。据王权[24]推测,克氏原螯虾肝胰腺中的棕色颗粒的产生可能与克氏原螯虾的解毒功能有关。本试验中,0.5 d时出现棕色颗粒并持续至第7 d,第14 d时棕色颗粒数量明显减少,可能是由于肝胰腺受损严重导致解毒功能降低有关。在试验第2 d时肝胰腺有炎症反应出现,此时间质可见少量炎性细胞渗出,第3 d炎症加剧。第5 d时出现细胞破裂现象,此时肝细胞损伤严重,已出现不可逆修复,之后随着时间延长肝胰腺结构受损加剧,此时间段开展药物治疗试验不会有显著效果出现,结合血清生化指标和抗氧化相关指标的结果认为选择第3 d建立肝胰腺损伤模型较为适宜。
