吉富罗非鱼肠道微生物群落初步研究
2020-09-27朱昊俊陶易凡包景文陈德举
朱昊俊,强 俊,陶易凡,包景文,陈德举,徐 跑,
(1.南京农业大学无锡渔业学院,江苏无锡 214081;2.中国水产科学研究院淡水渔业研究中心,农业农村部淡水渔业和种质资源利用重点实验室,江苏无锡 214081)
动物肠道微生物环境是由多种微生物构成的复杂微生态系统,鱼类肠道微生物与宿主在所处的水生环境下,会形成一个复杂的微生态系,这是动物长期进化的结果。肠道微生物组成一方面具有相对稳定性[1],另一方面又具有宿主特异性[2]。肠道微生物在宿主体内的定植与稳态对宿主具有重要意义,其对宿主的营养代谢、免疫应答、疾病状态甚至行为均会产生影响[3-5]。肠道微生物来源于环境,同时受遗传背景和食物等因素的影响,其与宿主之间的关系现在越来越受研究者们的关注。关于鱼类肠道菌群的研究国外开展很早,研究涉及菌群的形成、种类、数量等[6-8],以及肠道菌群对鱼体正常生理理功能的调节作用[9],而我国的研究侧重点是在致病菌与肠道菌群的关系,疾病条件下肠道菌群的组成结构变化等[10,11]方面。本研究采用高通量测序技术对人工饲养环境下吉富罗非鱼肠道微生物进行分析,旨在了解罗非鱼肠道微生物的结构组成和不同肠道分段的差异,为深入研究罗非鱼肠道菌群结构,同时优化养殖条件、预防疾病发生等提供数据支撑。
1 材料与方法
1.1 罗非鱼肠道样品获取
试验用吉富罗非鱼(Oreochromisniloticus)由中国水产科学研究院宜兴水产养殖基地繁殖,饲养于南京农业大学无锡渔业学院水产温室内,采用循环水养殖,每日定时(7:00时,16:00时)投喂颗粒饲料两次。维持水温(28±0.3)℃,溶氧>6 mg/L,pH 7.4~7.8,氨氮盐<0.1 mg/L,亚硝酸盐<0.01 mg/L。随机选取在系统内饲养90 d吉富罗非鱼活体4尾,平均体重100 g,体长15 cm左右,麻醉后在无菌操作台进行解剖。取出整个肠道,用生理盐水进行洗涤,然后分别截取肠道靠近胃部(前段、IC1段)和靠近肛门部位(后段、IC2段)肠道放入冻存管,液氮冷冻后放入-80 ℃冰箱保存。
1.2 肠道微生物总DNA提取和测序
肠道样本使用TIANGEN粪便提取试剂盒(DP328)提取肠道微生物总DNA,提取完毕后使用Nano Drop Lite微量核酸检测仪进行浓度测定。对16S rRNA基因v3-v4区域进行微生物测序及信息分析采用通用引物338F:5′-ACTCCTACGGGAGGCAGCA-3′和806R:5′-GGACTACHVGGGTWTCTAAT-3′。
对PCR产物采用Quant-iT PicoGreen dsDNA Assay Kit在Promega QuantiFluor荧光定量系统上对文库进行定量,合格的文库浓度应在2 nmol/L以上。将合格的各上机测序文库(Index序列不可重复)梯度稀释后,使用MiSeq测序仪进行2×300 bp的双端测序,试剂为MiSeq Reagent Kit V3(600 cycles)。
1.3 数据分析
根据Illumina MiSeq平台双端测序的重叠关系,将序列拼接(merge)成一条序列tags,同时过滤Reads的质量和合并的效果。将序列相似度大于97%的相似序列聚类为OTU(Operational Taxonomic Units)。根据已有细菌和真菌的分类学数据库将OTUs进行分类和标注,同时计算Alpha多样性(observed_species,chao1,shannon,simpson)和Beta多样性指数。
Alpha多样性以及Beta多样性均由 QIIME流程分析,图片由R(v3.5.2)包绘制。采用Wilcoxon秩和检验方法,分析了不同样品间Alpha多样性和相对丰度差异的显著性。使用ADONIS分析Beta多样性的差异显著性。P<0.05是被认为差异显著。
2 研究结果
2.1 基因组DNA提取和PCR扩增情况
电泳检测结果如图1示。电泳图DNA条带明显,使用超微量分光光度计检测样本OD值和浓度,样品浓度≥120 ng/μL,OD 260 nm/280 nm 值在1.8~2.1。
图1 肠道微生物宏基因组DNA质量检测
2.2 门水平上和属水平上不同肠道分段微生物比较
由图2可知,在门水平上优势种群是拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)6个门,占到相对丰度的95%以上。对样本中平均相对丰度大于1%的菌门进行差异分析,如图2b所示,梭杆菌门(22.71% vs 43.21%)和放线菌门(3.01% vs 0.77%)的相对丰度存在显著差异。而拟杆菌门(41.90% vs 36.94%)、变形菌门(17.78% vs 5.62%)、疣微菌门(6.84% vs 9.51%)、厚壁菌门(5.97% vs 3.49%)没有显著差异。
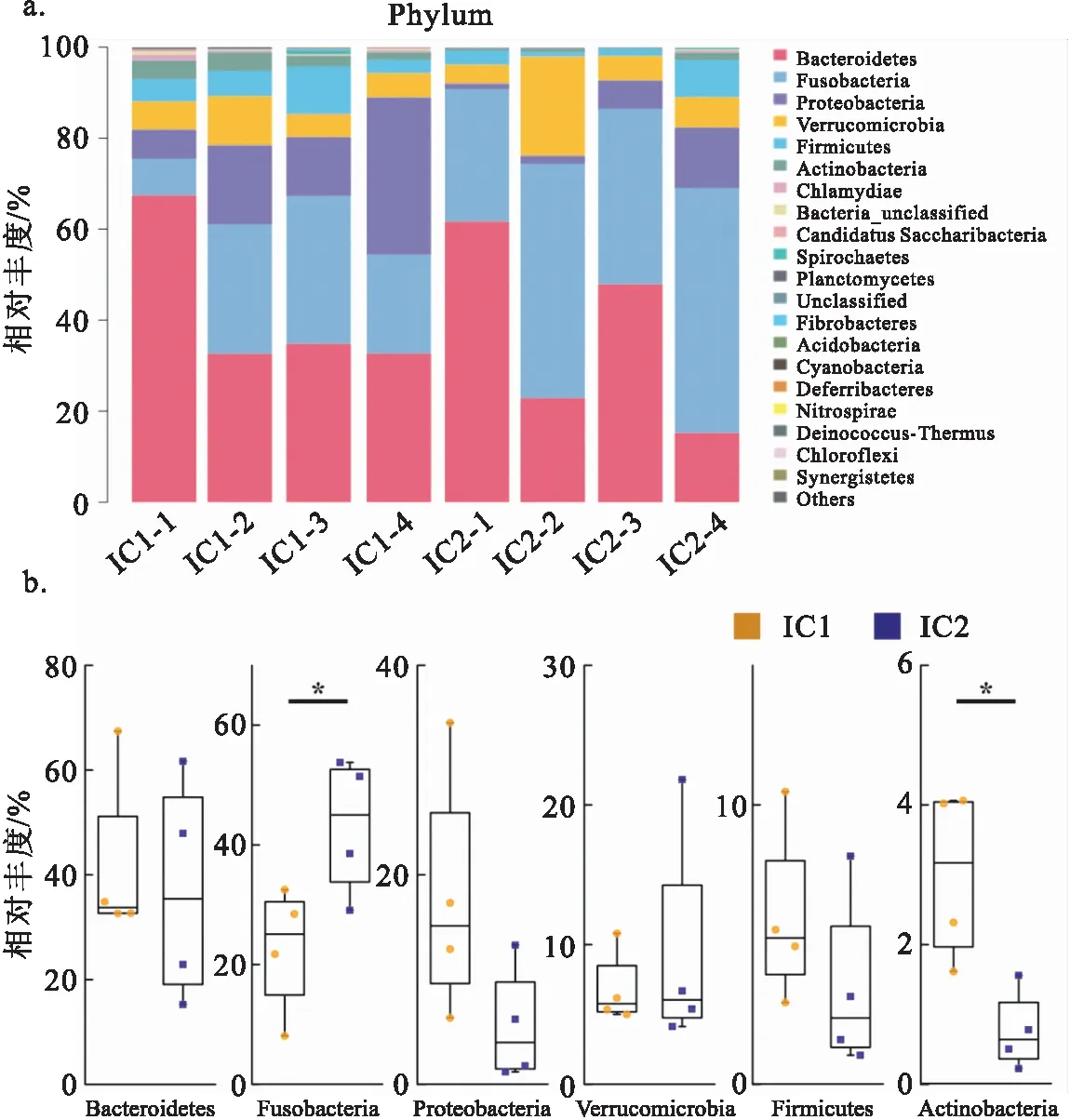
图2 门水平上肠道优势菌群
图3可知,在属水平上相对平均丰度大于1%的属有8个,分别为鲸杆菌属(Cetobacterium)、拟杆菌属(Bacteroides)、石斑科-未分类(Porphyromonadaceae-unclassified)、阿克曼属(Akkermansia)、不动杆菌属(Acinetobacter)、栖水菌属(Enhydrobacter)、Romboutsia属和邻单胞菌属(Plesiomonas)。其中鲸杆菌属(22.71% vs 43.21%)相对丰度存在显著差异。
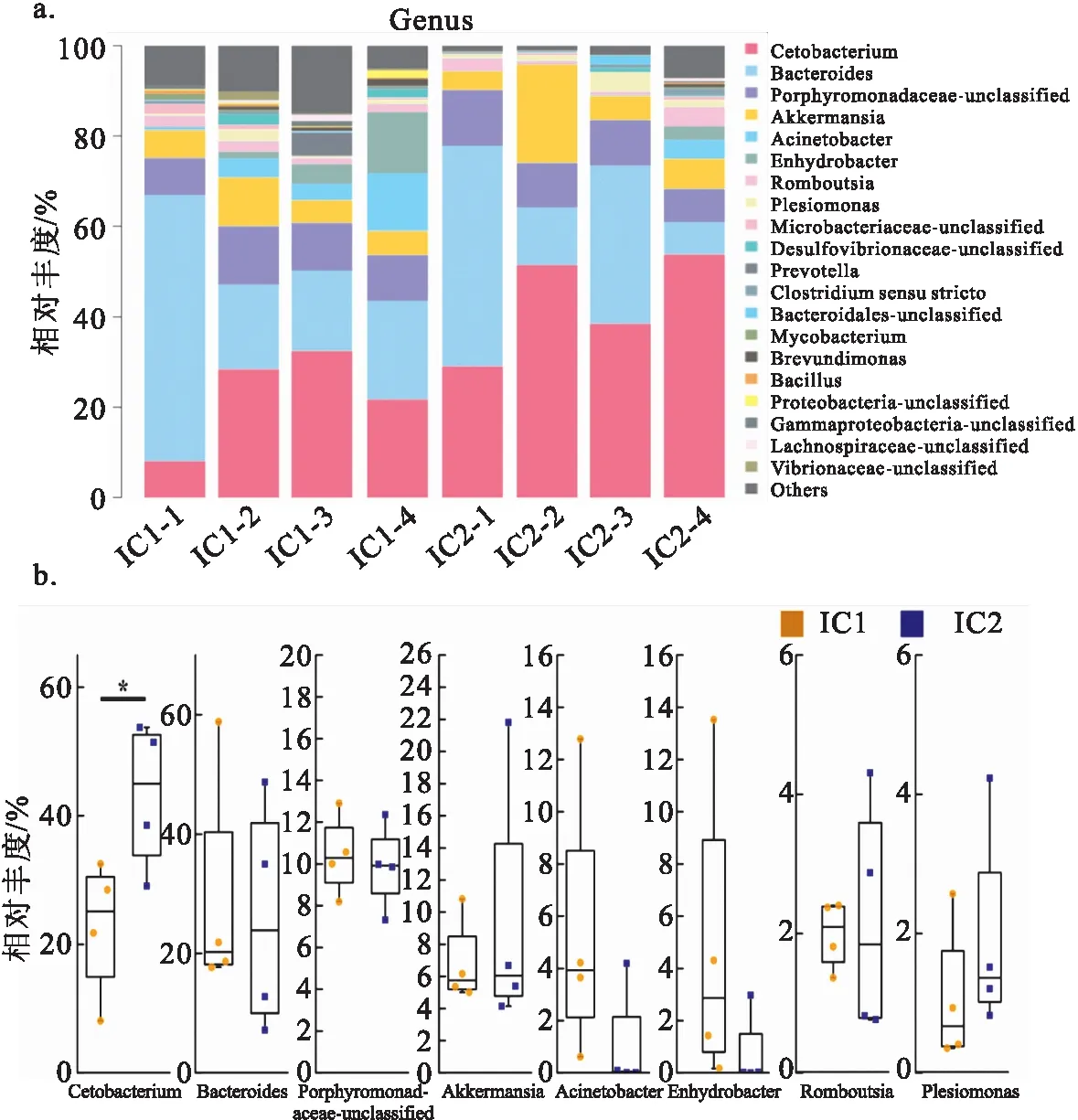
图3 属水平上肠道优势菌群
2.4 Beta多样性分析结果
基于weighted unifrac距离的PCoA分析结果如图4所示,PC1贡献度为59.86%,PC2贡献度为21.31%。从图中可以看出,不同肠道分段间样本明显区分,IC1段和IC2段样品分别聚为一类,结果具有显著差异。
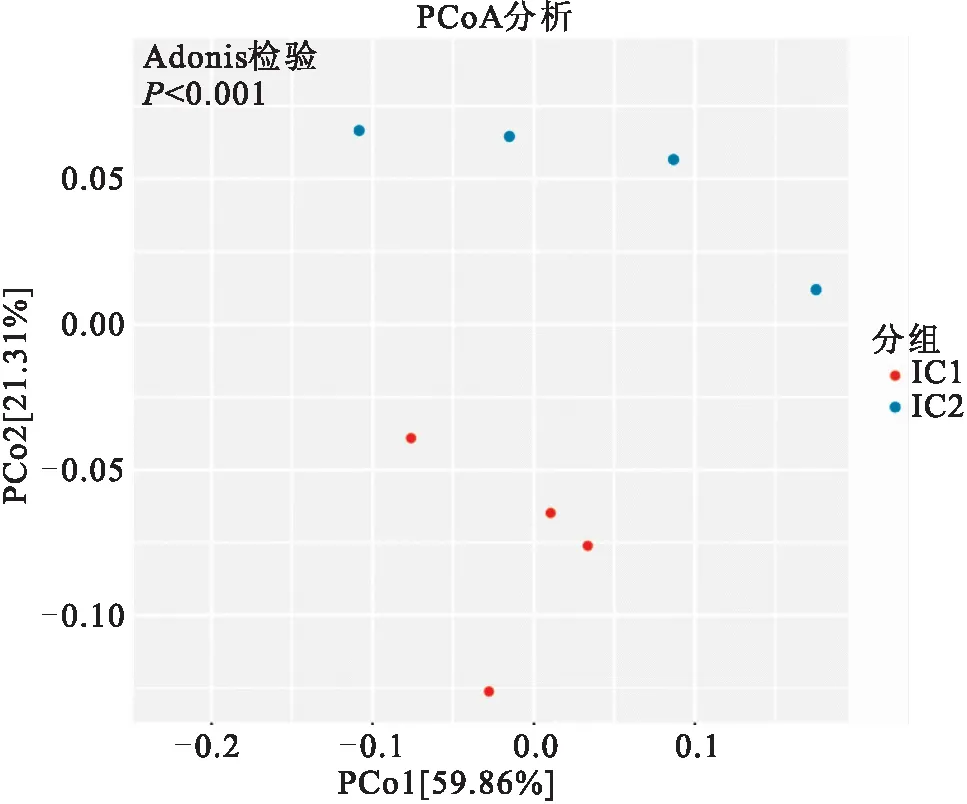
图4 PCoA分析2D示意图(Weight_uniFrac)
2.3 Alpha多样性分析结果
各样品的Alpha多样性计算结果见表2。根据方差分析结果可知,IC1分段和IC2分段物种数目、Chao1指数、辛普森指数和香农-威纳指数均存在显著差异,IC1段的多样性明显要高于IC2段。

表2 样品的多样性指数
2.5 物种分类热图结果
如图5所示,在门水平和属水平上,不同肠道分段的微生物群落组成有所不同,从聚类分析上可以看出,IC1段和IC2段各自聚为一类,其组间差异明显大于组内差异。同时,IC1段的多样性水平要高于IC2段,在靠前的20个门或属类别上,IC1段大部分的表达量明显高于IC2段。
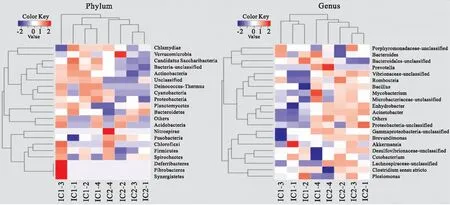
图5 门水平和属水平上物种分类热图
3 讨论
本研究中,在门水平上相对平均丰度大于1%的优势菌门是拟杆菌门、梭杆菌门、变形菌门、疣微菌门、厚壁菌门和放线菌门。在不同的肠道段,优势菌门种类一致,但是在其相对丰度存在差异,其中梭杆菌门和放线菌门相对丰度存在显著差异。在属水平上,相对丰度大于1%的优势菌属有8个,存在显著差异的只有一个鲸杆菌属(Cetobacterium)。Fan等[12]研究吉富罗非鱼肠道与周围水体内微生物关系时发现罗非鱼肠道门水平上优势种群是梭杆菌门、变形菌门和厚壁菌门。同时有研究指出鱼类肠道中常见的微生物主要是厚壁菌门、变形菌门、假单胞菌门、不动杆菌门等[13,14];拟杆菌属、梭状芽孢杆菌属和梭杆菌属是淡水鱼的肠道优势内源性菌群的主要种类[15]。本研究结果与相关研究结果部分一致,在优势菌群种类和丰度方面存在较大差异。导致肠道微生物组成改变的因素很多,不同的物种、饲料组成、性别、年龄、生存环境、甚至采样和分析方法均可能导致菌群相对丰度的改变[16,17]。另外有报道指出厚壁菌门是大部分脊椎动物肠道中的优势菌群[18],而在本研究中,厚壁菌门所占的比例较少,仅占相对丰度的5.97%(IC1段)和3.49%(IC2段),导致这种差异的原因可能与不同品种以及不同生活环境有关,鱼类肠道结构比较简单,其肠道菌群容易受到水质和饵料影响[19],具体原因需进一步验证。
肠道内的复杂菌群既可以代谢机体的营养物质,又可以与机体代谢相互作用产生各种代谢物质,其对营养素的代谢利用及其产生的代谢产物既能影响饲料营养素的高效利用,又能调控宿主的正常生理功能。拟杆菌门和厚壁菌门可以产生多糖水解酶,多糖水解酶可以有效降解膳食纤维进而产生单糖和短链脂肪酸(SCFA),是肠道内壁细胞基本代谢的能量来源之一[20],厚壁菌门和拟杆菌门的丰度也被研究者认为是评价动物机体肥胖程度的重要指标[21,22]。拟杆菌门和厚壁菌门均是本研究中罗非鱼肠道的优势菌门,这些肠道菌群的定植对机体的营养吸收具有重要作用。变形菌门是细菌中最大的一门,广泛存在于土壤、污水、动物以及植物体内,包含一些无机化能和光合种类,同时也包括很多病原菌,如大肠杆菌、沙门氏菌、弧菌、假单胞菌等种类。变形菌门丰度的提高可能是肠道菌群失衡的一个重要标志[23]。在本研究中,变形菌门在门水平上占有相对较高的丰度,其种类繁多,对宿主的作用比较复杂。梭杆菌门下的鲸杆菌属是鱼类肠道内比较普遍的一类益生菌,被认为具有发酵多肽碳水化合物的能力,代谢产生乙酸,少量产生丁酸、丙酸、乳酸和琥珀酸,同时与产维生素B12相关[24],对鱼类的营养吸收发挥重要的作用。目前肠道菌群和宿主免疫之间的关系是热点领域之一,近年来的大量研究均表明,动物肠道微生物对宿主免疫功能的建立和维持起着重要的作用,但具体的调控机制仍在研究中。
鱼类的肠道是机体重要的消化器官,肠道结构相对简单,由相似的细胞组成,没有消化吸收功能上的严格分区。在大部分研究中,鱼类的肠道一般被人为分成前中后三段[25,26]。本研究选取了前段和末段的肠道进行研究。对比前后肠道分段发现,肠道IC1段和肠道IC2段的优势菌群种类基本一致,但是各优势种群的相对丰度存在差异。同时IC1段肠道的多样性要显著高于IC2段。反映生物多样性的chao1指数、辛普森指数和香农-威纳指数均存在显著差异,从物种分类热图也可以清晰的看出IC1段的多样性要更为丰富。推测可能原因是鱼类相对简单的胃部结构导致食物本身携带的一些微生物不会在胃部失去活性,进而进入肠道,从而影响罗非鱼本身的微生物群体组成;同时,鱼类肠道由前向后,其内部蛋白酶、淀粉酶等主要消化酶的活性均逐渐下降。前部是罗非鱼消化吸收的重点部位,也是消化腺体等集中部位,部分参与宿主消化吸收功能的微生物群体在前段的丰度要高于后段。
