分光光度法测定茶游离氨基酸总量标准溶液的选择
2020-09-26周顺珍赵华富郭灿尹荣秀李花徐静
周顺珍,赵华富,郭灿,尹荣秀,李花,徐静
(贵州省农业科学院茶叶研究所,贵阳 550006 )
茶叶中的游离氨基酸有20 多种,游离氨基酸总量是茶叶中所有游离氨基酸含量之和,是构成茶叶鲜爽味的重要物质,对茶叶品质影响较大[1–2],游离氨基酸含量与茶叶品质呈显著正相关,因此其检测结果准确与否直接影响茶叶品质评价工作。
目前茶叶中游离氨基酸总量可由两种方式获得,一是利用国家标准检测方法GB/T 8314–2013 《茶游离氨基酸总量测定》[10],二是通过检测游离氨基酸组分的含量,得到游离氨基酸总量。游离氨基酸组分的测定方法有高效液相色谱法、液相色谱–质谱联用法、气相色谱法和氨基酸分析仪法[3–9]等。GB/T 8314–2013 法因其经济、简便和快捷而被广泛应用。但在实际应用中发现该方法存在问题。该标准规定可以使用“茶氨酸或谷氨酸”标准溶液制作标准曲线,而实际采用茶氨酸制作的标准曲线线性较差,难以获得准确的结果[14]。由于选择的标准样品不一致,各检测机构对同一样品的测定结果存在较大差异。
笔者分别使用茶氨酸和谷氨酸标准溶液制作标准曲线,对测定结果进行比较,发现应首选谷氨酸作为GB/T 8314–2013 方法测定茶游离氨基酸总量的标准样品。
1 实验部分
1.1 主要仪器与试剂
电子天平:BSA224S–CW 型,北京赛多利斯科学仪器有限公司;
紫外分光光度计:TU–1810 型,北京普析通用仪器有限责任公司;
恒温水浴锅:HH·SY21–Ni8 型,北京长源实验设备厂;
超纯水制备器:Molecular 型,重庆摩尔水处理设备有限公司;
L-茶氨酸标准样品:编号为A0789,纯度为98.923%,北京世纪奥科生物技术有限公司;
L-谷氨酸标准样品:编号为GTL–710247,纯度为99.92%,北京世纪奥科生物技术有限公司;
茶叶样品:贵州省茶叶研究所茶叶质量检测中心;
实验用水:去离子水(实验室自制)。
1.2 溶液配制
茶氨酸、谷氨酸标准储备液:质量浓度均为1 mg/mL,分别精密称取100 mg 茶氨酸和谷氨酸标准样品于100 mL 容量瓶中,加适量水溶解后,定容至标线,摇匀。
茶氨酸和谷氨酸系列标准工作溶液:分别移取1.0,2.0,3.0,4.0,5.0,6.0 mL 茶氨酸、谷氨酸标准储备液于10 mL 容量瓶中,用水定容,摇匀。该系列标准工作溶液的质量浓度分别为0.1,0.2,0.3,0.4,0.5,0.6 mg/mL[10]。
磷酸氢二钠溶液:称取23.9 g 十二水磷酸氢二钠(Na2HPO4·12H2O,分析纯),用水溶解后转移至1 L 容量瓶中,定容至标线,摇匀[10]。
磷酸二氢钾溶液:称取于110℃烘干2 h 的磷酸二氢钾(KH2PO4,分析纯)9.08 g,用水溶解后转移至1 L 容量瓶中,定容至标线,摇匀[10]。
磷酸盐缓冲液:pH 8.0,分别取磷酸氢二钠、磷酸二氢钾溶液,按照体积比95∶5 混合,摇匀[10]。
茚三酮溶液:0.02 g/mL,称取水合茚三酮(纯度不低于99%)2 g,加入50 mL 水和80 mg氯化亚锡(SnCl2·2H2O),搅拌均匀,分次加入少量水溶解,于暗处静置24 h,过滤后用水定容至100 mL[10]。
1.3 实验步骤
1.3.1 样品预处理
称取3 g(准确至0.001 g)磨碎茶叶样品于500 mL 锥形瓶中,加沸蒸馏水450 mL,立即移入沸水浴中,浸提45 min(每隔10 min 摇动一次),浸提完毕后立即趁热减压过滤,残渣用少量水洗涤2~3次,将滤液转入500 mL 容量瓶中,冷却后用水定容至标线,摇匀[11]。
1.3.2 标准曲线的制作
分别吸取1 mL 茶氨酸和谷氨酸系列标准工作溶液于一组25 mL 比色管中,各加pH 8.0 磷酸盐缓冲液0.5 mL 和茚三酮溶液0.5 mL,在沸水中加热15 min。待冷却后用水定容至25 mL,放置10 min,用5 mm 比色杯,测定570 nm 波长处的吸光度。以溶液质量浓度为横坐标、吸光度为纵坐标,绘制标准曲线,计算线性方程和相关系数。
1.3.3 样品测定
准确吸取1.3.1 所得样品溶液1 mL 于25 mL比色管中,加入磷酸盐缓冲液0.5 mL 和茚三酮溶液0.5 mL,在沸水中加热15 min,冷却,用水定容至25 mL,放置10 min,用5 mm 比色杯,以试剂空白溶液作参比,于570 nm 处测定吸光度[10]。
2 结果与讨论
2.1 标准曲线
按照GB/T 8314–2013 方法,分别测定茶氨酸、谷氨酸系列标准工作溶液,制作标准曲线,计算线性方程和相关系数。两个系列标准工作溶液吸光度测定值列于表1,线性方程和相关系数列于表2。
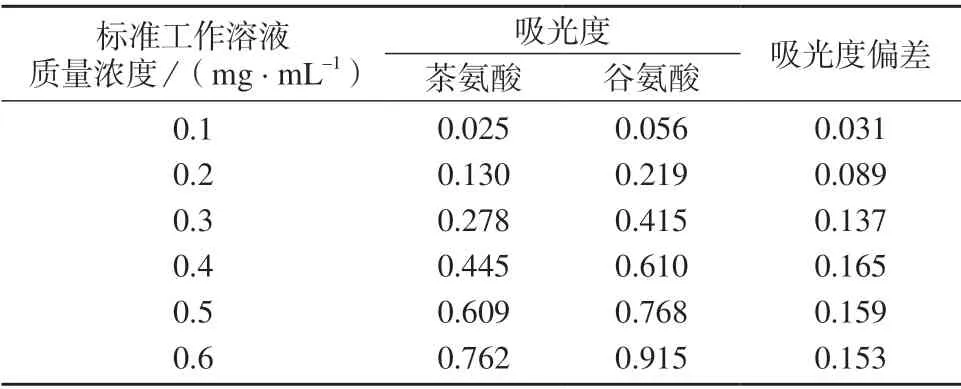
表1 茶氨酸、谷氨酸系列标准工作溶液测定结果
由表1、表2 数据可知,茶氨酸、谷氨酸系列标准工作溶液同一浓度下吸光度相差很大。通常认为当线性相关系数(r2)大于0.99 时,浓度与吸光度之间有显著的线性相关性[12]。实验数据表明,茶氨酸标准曲线的线性相关系数小于0.99,表明线性较差,不能满足检测要求;而谷氨酸标准曲线线性相关系数大于0.99,表明线性关系良好,可用作游离氨基酸总量测定的校正曲线。

表2 茶氨酸、谷氨酸标准曲线线性方程、相关系数
2.2 统计分析结果
分别采用茶氨酸、谷氨酸标准曲线,对茶叶样品各平行测定15 次,采用SPSS 统计软件对测定数据进行配对样本t检验(双尾总体检验)[16],对测定数据进行转换,构建新变量作为独立样本,样本t检验结果列于表3。由表3 可知,利用茶氨酸标准工作曲线法测定的茶叶样品中游离氨基酸总量平均值为4.413%,而谷氨酸标准曲线法测定的平均值为3.481%,标准偏差分别为0.789%,0.659%,说明谷氨酸标准工作曲线法测定茶游离氨基酸总量的精密度优于茶氨酸标准曲线法,两者测定值相差0.932%。配对t检验结果:t14=24.884,P<0.001,表明两者的差异达到了显著水平,拒绝H0假设,两种标准工作溶液测定的游离氨基酸总量存在显著差异。
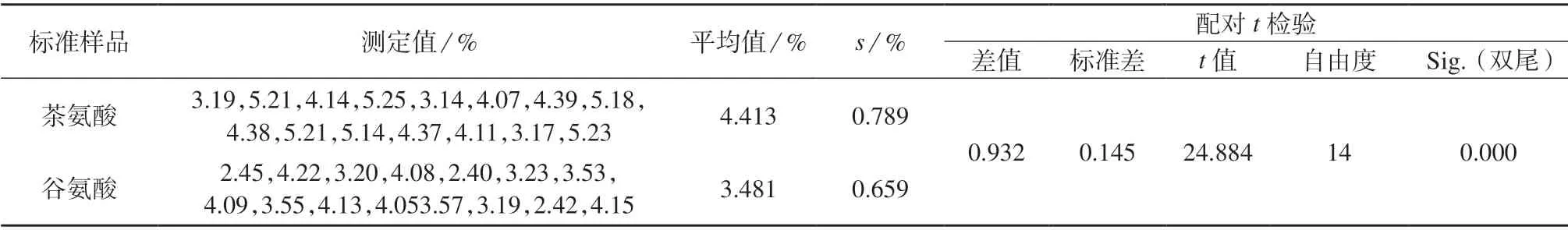
表3 茶叶样品测定及统计分析结果
2.3 加标回收试验
向样品中加入10 mL 质量浓度为1 mg/mL 茶氨酸或谷氨酸标准溶液,进行加标回收试验,试验数据列于表4。由表4 可知,茶氨酸标准曲线法平均加标回收率为68.28%,表明准确度不理想。而谷氨酸标准曲线法平均加标回收率为94.63%,表明谷氨酸标准曲线法测定结果准确度较高,适用于茶叶中游离氨基酸总量的测定。
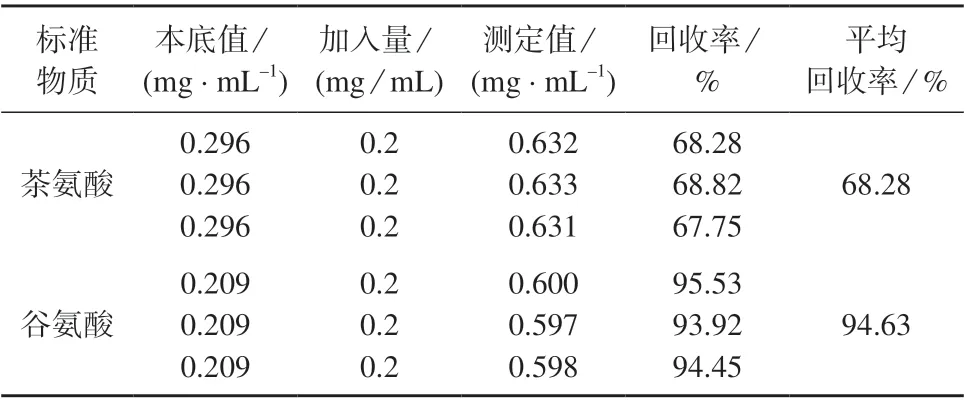
表4 加标回收试验结果
3 结语
根据茶叶中各种氨基酸的相对分子质量及含量,用加权法计算所得混合氨基酸的相对平均分子质量为147~150,与谷氨酸相对分子质量147.1 接近,而与茶氨酸相对分子量174.2 相差较大,表明单位质量浓度对应的光密度存在偏差[12–15],且差异越大,检测结果与真实值的偏差越大。周国兰等[13]提出用茶氨酸制作标准曲线时需称取174 mg 溶于100 mL 水中作为母液,然后制作标准曲线,从一个侧面说明完全按照GB/T 8314–2013 方法采用茶氨酸标准曲线法测定,测定结果是不准确的,而采用谷氨酸制作标准曲线能满足测定要求。因此建议茶叶中游离氨基酸测定的国家标准应该明确采用谷氨酸做标准样品,取消茶氨酸作为标准样品。
