中重度阻塞性睡眠呼吸暂停低通气综合征患者外周血内皮祖细胞数量和功能的变化
2020-09-25池伟伟牛英豪董丽萍张继华武广丽宋冬梅
池伟伟,牛英豪,董丽萍,张继华,武广丽,宋冬梅*
(1.河北医科大学第一医院临床生物样本库,河北 石家庄 050031;2.河北医科大学第一医院耳鼻咽喉头颈外科,河北 石家庄 050031)
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome, OSAHS)是临床常见的睡眠类疾病,其发病率逐年增高[1-3]。众多研究也已证实,OSAHS是心脑血管疾病的源头性疾病,是心血管疾病发生、发展的独立风险因素[4-5],对人类健康造成严重危害。因此,探明其疾病进程的分子机制,制定出有效治疗方案是这一领域研究的重点。数量众多的临床证据显示,OSAHS患者血管功能受到损伤,内皮功能如内皮依赖性血管舒张功能失调,由此可能造成OSAHS并发症如糖尿病微血管病变及高血压等心脑血管病变,最终引起动脉粥样硬化形成的始动原因[6]。因此,血管内皮损伤机制是现阶段OSAHS研究的主要热点,但是,与OSAHS相关的血管内皮修复机制关注较少。最近在心血管疾病的领域的研究结果显示,内皮祖细胞(endothelial progenitor cells,EPCs)在可以修复损伤的血管,在修复血管的损伤的过程中具有重要意义[7-9],EPCs是一种能直接分化为血管内皮细胞的前体细胞,在血管形成以及血管内皮损伤修复中起显著作用,其中EPCs的数量与功能又是决定内皮再生和血管修复的关键因素[10-12]。因此,探明OSAHS过程中,血管内皮祖细胞数量与功能的变化,有助于进一步明确OSAHS发生、发展及其介导并发症的发病原因,才有可能制定有效的针对性防治策略。因此,本研究通过评估OSAHS患者和正常人群EPCs的数量和增殖、迁移及黏附能力,旨在明确OSAHS患者EPCs数量和功能的变化规律,为OSAHS疾病及其导致的并发症的预防与治疗提供依据。
1 资料与方法
1.1一般资料 前瞻性研究2016年11月—2018年7月收录于河北医科大学第一医院临床样本库经耳鼻咽喉科确诊为OSAHS并住院治疗的成人患者30例为OSAHS组,男性18例,女性12例,年龄24~67岁,平均(43.6±10.4)岁。纳入标准:PSG监测每晚7 h睡眠过程中呼吸暂停和低通气反复发作>30次或睡眠呼吸暂停低通气指数(apnea hypopnea index,AHI)≥5次/h者,且呼吸暂停和低通气以阻塞性为主,参考依据《阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版)》[13]具体标准进行。排除标准:①就诊前或住院期间发现患有慢性阻塞性肺疾病、肺动脉高压、支气管哮喘等肺部疾病者;② 3个月内有心绞痛、心肌梗死发作病史者;③ 就诊时患有严重中枢性疾病及精神疾病者;④ 患有甲状腺功能减退症、慢性肾功能衰竭者;⑤ 就诊前或住院期间发现患有恶性肿瘤疾病或自身免疫性疾病者;⑥ 患有胸廓畸形或神经肌肉性疾病者;⑦ 近期曾服用或正在服用影响睡眠呼吸类药物者;⑧ 近期患有上呼吸道感染者;⑨ 既往急慢性肝炎或其他肝脏疾病者;⑩全身性激素替代疗法史或肢端肥大症者。同时选取河北医科大学第一医院进行体检的人员中选择年龄匹配的、自愿接受免费的多导睡眠监测(polysomnography,PSG)检查后排除OSAHS者30例为对照组,男性16例,女性14例,年龄28~65岁,平均(42.8±11.2)岁。2组性别、年龄等一般资料无统计学意义(P>0.05)。具有可比性。
本研究经医院伦理委员会通过,入组人员均知情同意并签署知情同意书。
1.2方法
1.2.1外周血内皮祖细胞的分离、鉴定与培养 无菌采集参与者(空腹12 h,静坐10 min)新鲜静脉全血10 mL至肝素抗凝 (10 U/mL) 离心管。密度梯度离心法收集单核细胞,接种至预先包被人纤维连接蛋白的24孔细胞培养板,内皮细胞生长培养基(endothelial cell growth medium-2,EGM-2)培养4 d,非贴壁细胞予以磷酸盐缓冲液除去,培养液更换至1周。收集细胞,在其中加入acLDL-Dil和FITC-UEA-1抗体,常温孵育1 h,染色,完成后用荧光显微镜拍照,acLDL-Dil及FITC-UEA-1双标记者为EPCs。
1.2.2测定2组人群EPCs的数量 采用菌落形成法,使用浓度为20 mg/L人纤维连接蛋白预孵育六孔板,调整单核细胞的密度为5×109个进行接种,继续孵育2 d后收集非黏附细胞,调整密度为1×109细胞/孔,接种至铺有人纤维连接蛋白的24孔板中,连续培养5 d,观察集落形成并计数,评价两组EPCs的数量。
1.2.3测定2组EPCs的增殖能力 贴壁细胞收集消化,用人纤维连接蛋白包被24孔细胞培养板,接种相同数目的内皮祖细胞,每个标本设置3个空白对照复孔,在5% CO2、37 ℃下培养24 h,将20 μL二苯基四氮唑溴盐(methylthiazolyldiphenyl-tetrazolium bromide,MTT)液体加入每孔内,培养4 h,去除上清,每孔加入150 μL二甲基亚砜,混匀,在490 nm波长的酶标仪下检测吸光度,评价2组EPCs的增殖能力。
1.2.4测定2组EPCs的迁移能力 贴壁细胞收集消化,Boyden小室的下室加入EGM-2培养基,向上室注入2×105个内皮祖细胞,在5%二氧化碳温箱内、37 ℃培养24 h;将滤膜上的未移动细胞刮去,甲醇固定,4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染色10 min,显微镜下观察向低层迁移的细胞,评价2组EPCs的迁移能力。
1.2.5测定2组EPCs的黏附能力 贴壁细胞收集消化,用人纤维连接蛋白包被24孔细胞培养板,接种相同数目的内皮祖细胞,在5% CO2、37 ℃下培养0.5 h,用PBS洗去未贴壁的细胞,评价两组EPCs的黏附能力。
1.3统计学方法 应用SPSS 22.0统计软件处理数据。计量资料比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1临床资料比较 OSAHS组BMI为(28.400±4.857),明显高于对照组(25.100±3.650),差异有统计学意义(t=2.587,P<0.05);OSAHS组AHI为(35.900±11.015),明显高于对照组(2.600±1.016),差异有统计学意义(t=13.440,P<0.01)。
2.2OSAHS患者外周血EPCs数量评估 OSAHS组外周血EPCs数量为(23.490±5.69)个,明显低于对照组(33.150±9.85)个,差异有统计学意义(t=4.395,P<0.01),见图1。
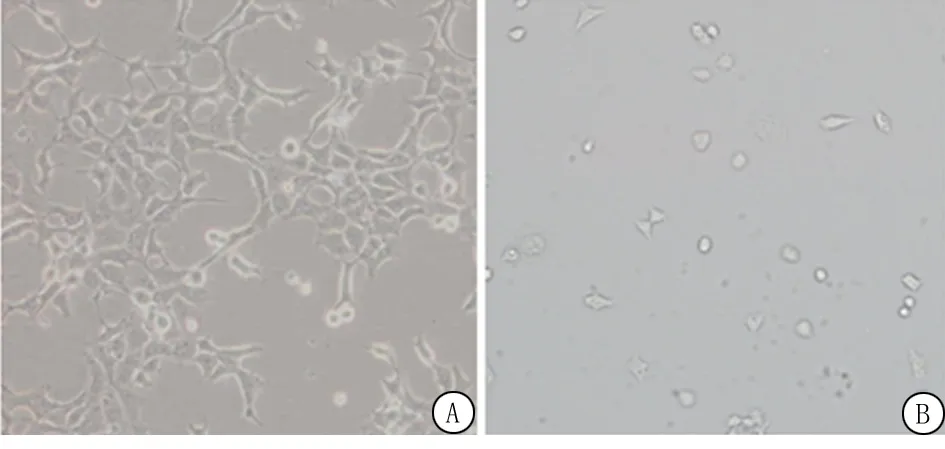
图1 2组人群外周血内皮祖细胞数量结果
2.3OSAHS患者外周血EPCs增殖能力评估 OSAHS组吸光度为(0.350±0.019),明显低于对照组(0.920±0.038),差异有统计学意义(t=70.260,P<0.01)。
2.4OSAHS患者外周血EPCs迁移能力评估 OSAHS组外周血EPCs迁移数为(14.590±7.256)个,明显低于对照组(26.460±5.987)个,差异有统计学意义(t=6.063,P<0.01)。
2.5OSAHS患者外周血EPCs黏附能力评估 OSAHS组外周血EPCs黏附率为(17.680±4.397)%,明显低于对照组(23.280±3.857)%,差异有统计学意义(t=30.790,P<0.01)。
3 讨 论
EPCs是一种前体细胞,可以直接分化形成血管内皮细胞,它的作用涉及血管形成、血管内皮损伤、血管内皮修复等方面,具有重要显著作用。当前的研究表明EPCs作用机制有两个方面,一在促进新心血管形成方面:通过EPCs本身的分化、增殖而形成新生血管,从而无需本来的血管系统为依靠;二在内皮细胞修复方面:EPCs本身可以通过旁分泌效应分泌血管内皮生长因子等细胞生长因子,从而促进局部血管内皮细胞增殖。在心脑血管疾病的研究中已经发现高血压、高血脂、高血糖以及相关血流动力学改变可降低骨髓活化进入外周血EPCs的数量,并使EPCs修复功能下降,同时还可导致EPCs早衰和凋亡[14-17],使其无法对有功能缺陷的内皮细胞进行及时修复,这是内皮功能受损后无法及时修复的主要原因;同时研究人员发现这些骨髓来源的EPCs通过骨髓动员、归巢,在损伤部位分化为成熟的血管内皮细胞并分泌促进血管生成的相关因子,对心肌梗死以及缺血性休克具有潜在的治疗效果[18-19],因此EPCs在血管内皮损伤及修复中的地位和作用也日益得到了广泛的关注。
在OSAHS研究领域,尽管已知OSAHS患者的血管内皮功能受损可能是导致动脉粥样硬化形成的起始诱因[5],但是涉及OSAHS相关血管内皮修复问题,尤其是EPCS介导的内皮修复问题的研究较少;OSAHS患者EPCs数量、功能的变化规律还不清晰、研究尚处于初始阶段,初步临床研究结果也存在不一致之处,例如Jelic 等[20]研究显示,无心脑血管相关疾病的成年OSAS患者其外周血EPCs数量减低,血流介导的血管舒张功能下降,但是也有报道并不认同这一结论,Carreras 等[21]研究发现,大鼠OSAS动物模型中外周血间充质干细胞的数目明显增多,为了明确EPCs数量和功能在OSAHS患者体内的变化规律,本研究评估了正常对照组和OSAHS患者2组人群EPCs数量和功能,结果显示,OSAHS患者体内EPCs的数量明显低于健康对照组,与Jelic等[20]研究结果相符;OSAHS患者体内EPCs数量减少的原因,可能是OSAHS患者体内的慢性间断性缺氧状态,影响了PI3K/AKT/eNOS等EPCs相关信号通路,导致EPCs功能障碍继而造成了EPCS的数量减少。同时,EPCs可以定向分化为内皮细胞,从而达到修复血管内皮损伤的目的,是保持血管完整性的最重要的机制之一。然而,当血液中EPCs的数量减少时会影响其修复功能。外周血EPCs的增殖能力、黏附能力、迁移能力决定其是否可到达受损部位,本研究的结果显示,OSAHS患者体内EPCs的增殖细胞数、迁移细胞数及黏附细胞数较对照组均降低,提示OSAHS患者血管修复能力已受到损伤。
综上所述,OSAHS可以导致外周血中EPCs数量减少并使其增殖能力、黏附能力及迁移能力受到损伤,继而影响血管内皮的功能,这可能是OSAHS引起动脉粥样硬化血管疾病发生发展的重要途径。除直接损伤血管外,影响血管内皮修复机制,减弱EPCs的数量、减退内皮祖细胞功能,可能也是OSAHS而导致血管内皮功能障碍的原因。
