COPD并发肺炎患者外周血内皮祖细胞数量和功能的变化及机制研究
2020-09-23黎银焕张平陈卫民蒋鹏
黎银焕,张平,陈卫民,蒋鹏
(1.东莞市人民医院呼吸与危重症医学科,广东 东莞 523059;2.中山大学附属第一医院急诊科,广东 广州 510080)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种发病率高、危害性大的疾病[1-3]。近年来,COPD病死率逐渐升高,世界卫生组织资料显示预测2020年COPD死因顺序上升至第三位[4]。研究显示血管内皮损伤和功能障碍在COPD发生发展起着重要角色[5]。COPD属于慢性基础疾病,常发生气管-支气管结构变性,呼吸道防御能力下降,极易引起呼吸道感染及肺部感染[6]。
内皮祖细胞(endothelial progenitor cells,EPCs)起源于骨髓,具有有效修复血管内皮损伤并参与血管新生,改善血管内皮功能的作用[7-10]。研究发现稳定期 COPD患者外周血EPC下降,其下降可能与炎症反应相关[11]。肺部感染可引起一系列的炎症反应,而外周EPC反而上升[12-13]。而COPD并发肺部感染患者外周EPC数量及功能变化及其机制尚未明了。
GTP环化水解酶(GTP cyclohydrolase,GTPCH) 1及其合成产物四氢生物蝶呤(Tetrahydrobiopterin,BH4) 是调节内皮祖细胞功能活性的重要细胞信号分子[14-15]。上调GTPCH1能使NO产生增加,并通过抑制TSP-1表达改善内皮祖细胞功能[16-17]。一氧化氮(NO)是重要的血管舒张因子,对肺内血管张力及阻力具有重要调节作用,同时也是影响EPC功能关键因子[18-19]。本文研究通过观察COPD并发肺部感染患者EPC数量及功能变化,分析其可能相关机制,探讨其在COPD并发肺部感染的作用。
1 对象和方法
1.1 研究对象
根据2013年《慢性阻塞性肺疾病诊治指南》的诊断标准,2018年12月-2019年12月从我院纳入COPD稳定期患者20例, COPD合并肺部感染患者20例,正常对照组20例(详见表1)。COPD稳定期标准:患者咳嗽、咳痰、气促等症状稳定或轻微,近期未使用激素;外伤、近期手术、肿瘤、代谢性疾病、免疫性疾病等排除。
1.2 研究方法
1.2.1EPCs分离与培养 经外周静脉抽取20 mL静脉血,用PBS等体积稀释后,加入含 Ficoll-Paque人淋巴细胞分离液的离心管上层,常温下,离心半径15 cm,2 000 r/min 离心30 min,小心吸取中间白膜层细胞,PBS洗涤2次后,以离心半径15 cm,1 500 r/min离心8 min获取单核细胞。将单核细胞重悬于含体积分数10%胎牛血清内皮细胞全培养基,以1×106浓度接种于预先包被好纤维连接蛋白(5 μg/cm2)的25 cm2细胞培养瓶中,置37 ℃,体积分数5%CO2培养箱中培养,3 d后换液除去未贴壁悬浮细胞,贴壁细胞继续培养,以后每3 d换液1次。待细胞80%左右融合后以1∶3比例传代培养。培养期间,每天在倒置相差显微镜下观察贴壁细胞的形态和数量变化。
1.2.2EPCs的鉴定、标记 选取生长良好的细胞,将培养的细胞用4%多聚甲醛固定细胞2 h,PBS洗涤,3×5 min,5%BSA封闭,室温60 min。滴加兔抗CD31、CD34、Flk-1、vWF多克隆抗体,漂洗后加入1∶100山羊抗兔IgG-FITC,避光孵化1 h,PBS洗涤后共聚焦显微镜鉴定双阳性细胞为正在分化的内皮祖细胞,并随机选择5个视野计数(×200)。
1.2.3EPCs在体外迁移、粘附、增殖功能检测
1.2.3.1迁移实验(Transwell 迁移法) 收集各组胰酶消化的初级 EPC-CFUs并计数,将1.5 mL 1×104个/mL EPC 悬浮液加入Transwell上室,在下室中加入 2.5 mL含10 μg/L SDF-1α的新鲜培养基,培养24 h后,取上室并用酒精棉球轻擦掉上室膜上未迁移的细胞,95%酒精固定10 min,苏木素染色 5 min,1%盐酸酒精分染2 s,随机选择3个连续显微镜视野(100×)计数迁移到上室膜下的细胞,取均数。
1.2.3.2增殖实验MTT比色法 0.25%胰酶消化各组初级内皮祖细胞集落单位(EPC-CFUs)并计数,将 200 μL 1×104个/L EPC 均匀接种到明胶包被的96 孔培养板(n=5),培养 48 h,每孔加 10 μL MTT(5 g/L),于 37℃、5% CO2培养箱继续培养 4 h,弃上清液,加入二甲基亚砜(150 μL/孔),于微量振荡器充分振荡 10 min,置酶标仪于波长 490 nm处测吸光度值。
1.2.3.3EPC黏附纤维蛋白(FN)能力检测 用0.25%胰酶消化贴壁细胞,1 000 rpm(离心半径10 cm)离心5 min,用含5%FBS的EBM-2 培养基(无生长因子)重悬细胞,调整细胞密度为2×104/ml,取500 μL细胞悬液接种于预先用FN 包被的24孔板中,37 ℃孵育30 min,弃上清,PBS 洗去未贴壁细胞,4%多聚甲酸固定10 min,PBS 洗3遍,加入DAPI 染色液(5 μg/mL)37 ℃避光孵育10 min,弃上清,PBS 洗3 遍,置于倒置荧光显微镜下观察计数。
1.2.4Western印迹和高效液相色谱(High performance liquid chromatogram,HPLC) Western印迹方法检测内皮祖细胞GTPCH1表达,采用高效液相色谱(High performance liquid chromatogram,HPLC) 法检测细胞内BH4水平,ELASA法检测NO水平。
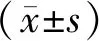
2 结果
2.1 各组的临床资料情况
如表1所示,各组在性别、年龄、血糖、血脂等指标上均差异无统计学意义(P>0.05)。

表1 临床和生化特点
2.2 各组数量与功能间差异
如图1,与正常对照组相比, COPD组外周血 EPC 数量明显减少,增殖、迁移和粘附能力显著降低 (P<0.05); 与正常对照组相比, COPD并肺部感染组外周血 EPC 数量明显升高,而增殖、迁移和粘附能力显著降低 (P<0.05);相对COPD组相比,COPD并肺部感染组外周血 EPC 增殖、迁移和粘附能力显著降低(P<0.05)。
A:显微镜计循环 EPC 数量,B:EPC的增殖功能,C:EPC的迁移功能,D:EPC黏附功能;与对照组比较,*P<0.05;与COPD组比较,#P<0.05
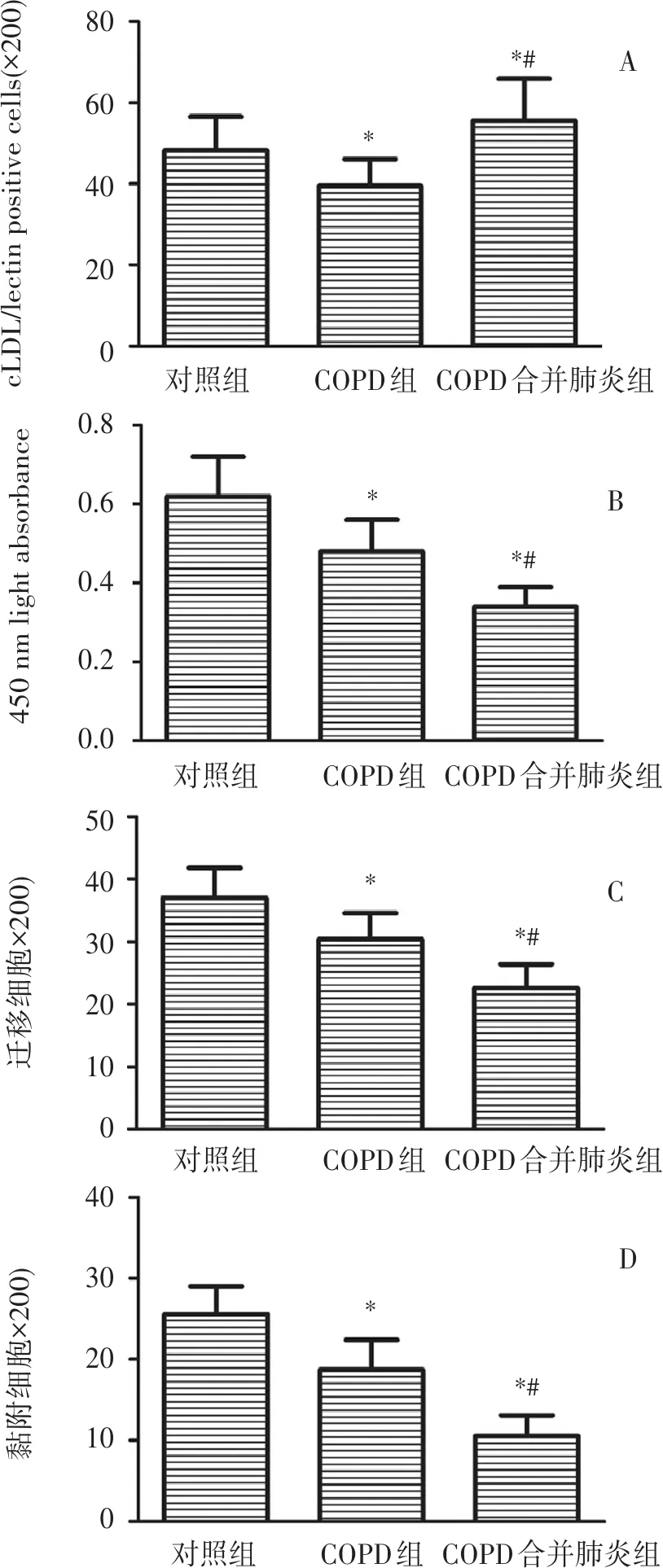
2.3 循环EPCs中GTPCH1/BH4通路表达和eNOS磷酸化
如图2所示,相对对照组,COPD组和COPD合并肺炎组的EGTCPH I (a)和胞内BH4 (b)水平均明显降低,而且相对COPD组,COPD并发肺炎后EGTCPH I (a)和胞内BH4 (b)水平更低 (P<0.05)。COPD组和COPD合并肺炎组的eNOS磷酸化(c)和eNOS蛋白表达相比对照组均明显下降,而且,COPD合并肺炎组的eNOS磷酸化(c)水平相对COPD组表达更低(P<0.05)
COPD合并肺炎组COPD组对照组COPD合并肺炎组COPD组对照组COPD合并肺炎组COPD组对照组ACDB1.51.00.50.010864201.51.00.50.0GTCPHI(foldofcontrols)IntracellularBH4(pmol/mgprotien)p-eNOS/eNOS(foldofcontrols)*#*#*#***β-ActineNOSp-eNOSGTPCHI
2.4 EPC增殖、黏附和迁移能力与EPCs分泌NO水平相关性
如图3所示,外周血EPC增殖、迁移和黏附能力与EPCs分泌NO水平呈正相关(R=0.65、0.79、70,P<0.01)。
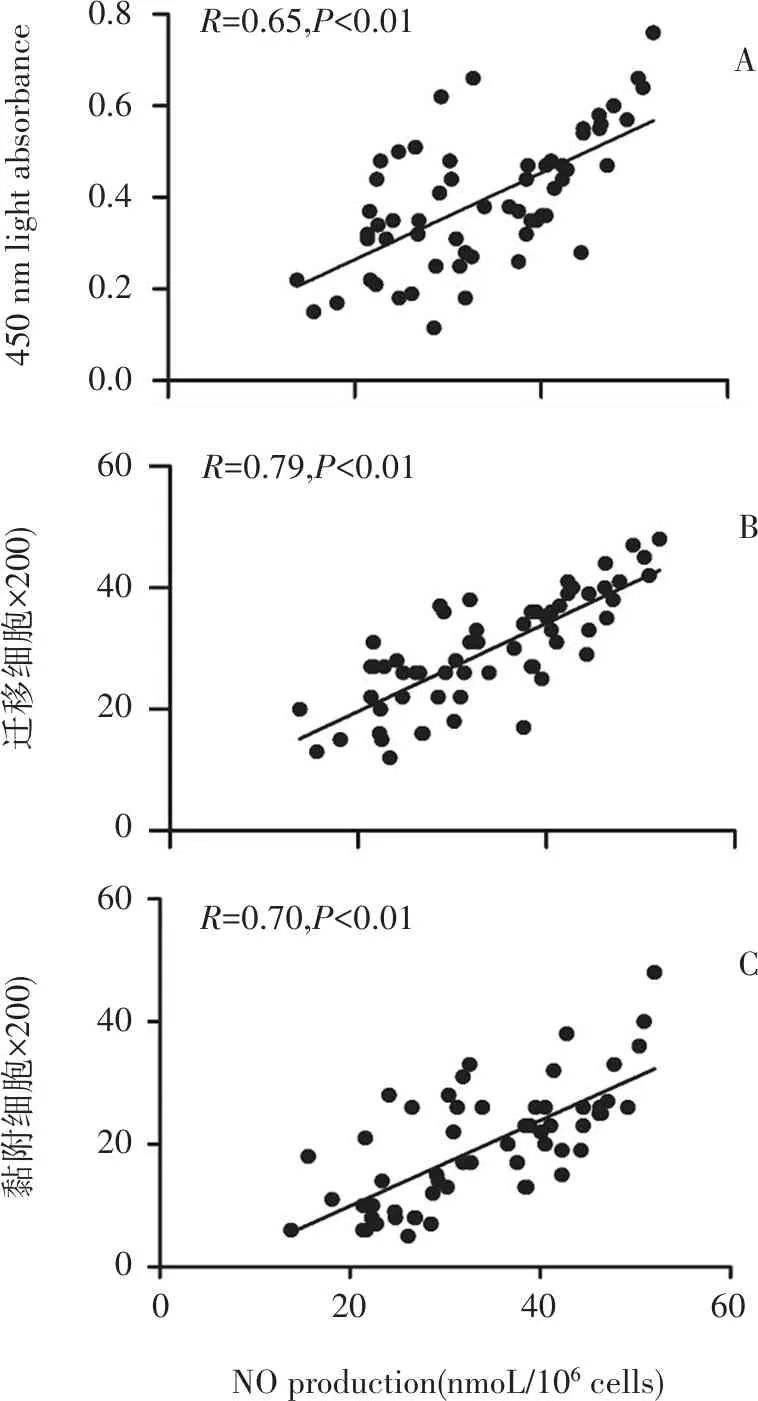
A:EPC增值能力与NO分泌水平正相关(R=0.65,P<0.01),B:EPC迁移能力与NO分泌水平正相关(R=0.79,P<0.01),C:EPC黏附能力与NO分泌水平正相关(R=0.70,P<0.01)
3 讨论
目前认为肺血管内皮细胞损伤是慢性阻塞性肺疾病发生、发展的主要原因[20]。肺血管内皮细胞可起到屏障作用,防止外界有害物资侵入,也可以分泌内皮素-1(ET-1)、血管紧张素II(AngII)及一氧化氮(NO)、前列环素(PGIS)等调节血管壁收舒等功能[21]。内皮祖细胞是参与内皮损伤修复的内皮前提细胞,可以向损伤内皮进行趋势,并定向分化成熟内皮细胞,加速损伤内皮的修复[22-24]。前期研究发现COPD患者外周循环内皮祖细胞数量及功能下降,可能与骨髓中的 EPC 被过度消耗或者EPC 在局部受损组织过度的积聚有关[11]。本研究纳入的COPD患者内皮祖细胞数量及功能均下降,提示EPC受损可能是加剧COPD发展的原因。
痰液等分泌物增多是COPD主要的临床表现,同时自身免疫力差,气道重塑,肺顺应性变差,容易导致肺部感染。研究指出,肺部感染通过一系列炎性反应,炎症刺激诱导EPC快速释放进入人体循环,这说明足量的EPC是肺炎后肺损伤修复必要的条件。
那么COPD并发肺炎后,外周EPC变化如何呢?本研究通过观察COPD并发肺炎后外周血EPC数量及增殖、迁移及粘附功能变化,结果发现COPD并发肺炎EPC数量较正常组得到相应增加,但迁移、增殖及粘附能力却受到不同程度的损伤。这说明COPD内皮祖细胞功能下降可能是导致肺部感染易感的因素之一,同时也暗示EPC功能下降可能是导致COPD并发肺炎患者较单纯肺炎患者预后不佳的原因。
一氧化氮对内皮细胞功能调节起着关键性的作用。有研究表明COPD患者内皮损伤修复能力与NO释放水平相关[25]。本研究研究外周EPC分泌NO水平与下降的功能呈正相关,这说明EPC释放水平NO水平是决定EPC功能主要因子,同时也暗示COPD并发肺炎通过NO途径诱导血管内皮功能障碍。
GTPCH1及其合成产物BH4是调节内皮祖细胞功能活性的重要细胞信号分子[26-27]。GTPCH1 是BH4从头合成途径的限速酶,控制着细胞内BH4的浓度。BH4是一氧化氮合酶 (Nitric oxide synthase,NOS)的关键辅因子,在BH4充足时,NOS催化底物L-精氨酸生成NO[28];在BH4缺乏时,出现NOS脱偶联及活性下降,NO产生减少,主要产生超氧阴离子。而上调GTPCH1能使NO产生增加,并通过抑制TSP-1表达改善内皮祖细胞功能[28]。因此,GTPCH1/BH4通路是调节内皮祖细胞功能的重要机制。本研究发现,COPD组和COPD并发肺炎组,GTPCH1/BH4通路下降,同时eNOS磷酸化(c)水平也相应下降,而EPCs分泌的NO水平与EPC具有明显相关性,这说明GTPCH1/BH4通路可在调节的EPCs功能方面起到重要作用。COPD并发肺炎EPCs功能下降可能与GTPCH1/BH4通路密切相关。
总之,我们首次发现COPD并发肺炎患者循环 EPC数量增加,增殖、迁移及黏附能力下降。COPD并发肺炎EPCs功能下降可能与GTPCH1/BH4通路密切相关。GTPCH1/BH4通路可为COPD并发肺炎内皮祖细胞重要的调节靶点。
