四株红曲霉菌固态发酵木耳红曲的性能比较
2020-09-23傅思瑞张彩梅
傅思瑞,刘 嵬,张彩梅,梁 立,甘 亚,颜 军,何 钢
(成都大学,四川抗菌素工业研究所,药食同源植物资源开发四川省高校重点实验室,四川成都 610052)
红曲霉菌是一种丝状真菌,在发酵过程中可产生以洛伐他汀(Lovastatin)[1]、红曲色素[2]为主的具有降血脂[3]、抗氧化功效[4]的次级代谢产物。已有研究表明红曲霉菌发酵过程中产生糖化酶、蛋白酶等酶类,将原料中多糖、蛋白质等大分子物质降解成人体易于吸收的小分子片段,同时产生新的活性次级代谢产物[5]。黑木耳为木耳科木耳属黑木耳的子实体,是一种珍贵的药食兼用胶质真菌,研究表明黑木耳多糖具有降血脂、降血糖、抗氧化[6]及抗衰老等多种功效[7]。我国是黑木耳生产大国,但大多是粗加工,其有效成分没有得到充分利用,应用深度和广度不够,因此黑木耳具有巨大的开发价值和良好前景。
微生物发酵或转化是提高药食同源真菌、植物资源功效成份高效利用的重要手段[8]。目前红曲霉菌的生物转化和固态发酵技术已有大量研究[9]和产品[10]开发上市,如:红曲米、青稞红曲茶、红曲酒、红曲面包等,但缺乏利用红曲霉菌和木耳这类天然食用真菌的固态共发酵进行微生物转化的报道,以木耳为发酵基质,用红曲霉菌进行发酵生产具有降血脂和抗氧化的红曲-木耳产品具有重要开发价值。由于部分红曲霉菌代谢产生洛伐他汀及其同系列化合物的同时也会代谢产生高度致癌化合物桔霉素[11],限制了红曲及红曲霉菌发酵产品的开发和应用[12]。所以在红曲霉菌发酵产品应用中需要对生产菌株进行筛选,得到低毒、高活性的生产菌株。故本实验用四种不同的红曲霉菌对木耳和大米进行了固态发酵,并对产品各项性能进行了分析比较,希望筛选出最适合固态发酵的产高色价、高含量洛伐他汀、低含量桔霉素的红曲霉菌,结果可为后续生产木耳和红曲发酵产品提供依据,为相关新型食品和药品的研究与开发提供参考。
1 材料与方法
1.1 材料与仪器
MonascuspurpureusWent.z 507(M.z507)、MonascuspurpureusWent.c 507(M.c507)、MonascuspurpureusWent.b 2019(M.b2019)、MonascuspurpureusWent.h 2019(M.h2019) 四株红曲霉菌从不同厂家红曲米中分离纯化得到,经过分子鉴定为子囊菌纲曲霉科红曲霉属真菌红曲霉菌,保藏于四川抗菌素工业研究所药食同源开发重点实验室;无水葡萄糖、浓硫酸、苯酚、3,5-二硝基水杨酸、NaOH、酒石酸钾钠、无水亚硫酸钠、NaCl、Na2HPO4、NaH2PO4、FeSO4、30%H2O2、水杨酸、磷酸、甲苯、乙酸乙酯、甲酸 均为分析纯,成都市科龙化工试剂厂;无水乙醇、95%乙醇、75%乙醇 均为分析纯,成都市科隆化学品有限公司;BCA试剂盒 北京庄盟国际生物基因科技有限公司;DPPH标准品(>97%) 梯希爱(上海)化成工业发展有限公司;甲醇(色谱纯) 西格玛奥德里奇(上海)贸易有限公司;乙腈(色谱纯) 赛默飞世尔科技(中国)有限公司;洛伐他汀标准品(99.9%) 北京坛墨质检科技有限公司;桔霉素标准品(98%) 北京百灵威科技有限公司。
HPLC A10型高效液相色谱仪 美国PerkinElmer Altus公司;UV-2600紫外可见分光光度计、LC-20A型高效液相色谱仪 岛津仪器(苏州)有限公司;TGL-16C型台式离心机 上海安亭科学仪器厂;GL-21M型冷冻离心机 湖南湘仪离心机仪器有限公司;FA2004B型电子分析天平 上海越平科学仪器有限公司;DHP-9050B智能型电热恒温培养箱、LG-160S型全温振荡培养箱 上海琅玕实验设备有限公司;GR60DA型高压灭菌锅 致微(厦门)仪器有限公司;HZQ-C/40-220r型空气浴振荡器 哈尔滨市东明医疗仪器厂;ZHJH-C1214B型超净工作台 上海智城分析仪器制造有限公司;KQ-400KDE型高功率数控超声波清洗器 昆山市超声仪器有限公司;JY-1000A型高速多功能粉碎机 上海塞耐机械有限公司;ELX800型全自动酶标仪 美国伯腾仪器有限公司;UPT-II-10T型超纯水器 四川优普超纯科技有限公司。
1.2 实验方法
1.2.1 红曲霉菌孢子悬浮液制备 马铃薯葡萄糖液态培养基(PDA):40 g土豆加入200 mL纯水煮沸30 min,过滤,取滤液,加入4 g无水葡萄糖,补水至200 mL。
挑取斜面培养基上红曲霉菌菌丝,接种于含有200 mL液态培养基的500 mL锥形瓶中,置于恒温振荡培养箱中在转速100 r/min,28 ℃下培养3~5 d至液体培养基变红即可。
1.2.2 红曲霉菌固态发酵木耳方法 红曲霉菌固态发酵木耳的方法按照文献方法稍做修改[13]。具体如下,大米浸泡1 h后蒸煮35 min,装料量18 g/250 mL,大米∶木耳=4∶1,料液比(发酵原料∶水,g/mL)=1∶2,于高压蒸汽灭菌锅121 ℃灭菌20 min,灭菌完毕后取出放入超净工作台冷却至室温,接种红曲霉菌(M.z507、M.z507、M.b2019、M.h2019)孢子悬浮液15 mL至固态发酵培养基中,每株红曲霉菌做3个平行实验,用接种铲搅拌均匀,发酵温度30 ℃,发酵时间14 d,每隔7 d补水一次,补水量为初加水量的5%。发酵结束后,发酵产物60 ℃烘干,粉碎,过40目筛备用。
1.2.3 发酵性能参数测定 发酵产物中粗多糖含量测定按照文献[14]方法,称取适量样品进行热水水浴提取,乙醇沉淀多糖,粗多糖复溶后采用硫酸-苯酚法测定含量。还原糖含量测定按照文献[15]所述,取多糖提取液直接采用DNS试剂测定还原糖含量。蛋白质含量测定按照文献[16] 方法,称取适量样品,用PBS缓冲液,超声提取30 min,提取液采用BCA试剂法测定蛋白质含量[17]。对照组均为未发酵的固态培养基原料。
1.2.4 红曲色素含量 红曲色素包括水溶性和醇溶性色素两类[18],以红曲发酵样品的色价替代红曲色素含量。按照文献方法[19]所述制备水溶性红曲色素样品,称取1.0 g发酵样品粉末3份,倒入150 mL锥形瓶,分别加入100 mL超纯水,玻璃棒搅拌均匀,功率为280 W条件下超声辅助提取30 min,提取液10000 r/min离心5 min,收集上清液待测。取上清液于试管中,加水稀释,以蒸馏水为空白,于410和505 nm测定吸光度值。醇溶性红曲色素样品制备将提取溶剂换成75%乙醇溶液,其余步骤同上所述。以75%乙醇为空白,于410和505 nm测定吸光度值。水溶性和醇溶性红曲色素均含有红色素和黄色素,色价计算方法如下。
红色素色价(U/mL)=OD505×稀释倍数
黄色素色价(U/mL)=OD410×稀释倍数
总色价(U/mL)=红色价+黄色价
1.2.5 洛伐他汀含量测定
1.2.5.1 样品前处理 称取各样品粉末1.2 g于50 mL容量瓶中,加入30 mL 75%乙醇,功率为280 W条件下超声提取1 h后,用75%乙醇定容[20]。提取液8000 r/min离心10 min,过0.22 μm有机相微孔滤膜微滤,装入进样瓶,待测。
相当一部分基层民警对公安信息化也存在认识误区。比较典型的错误认识包括:一是认为情报信息不是什么新事物,解放初期就有“警务跟着警情走”的说法,因此认为公安信息化建设只不过是“新瓶装旧水”。二是认为信息化只是一场技术革新,公安信息化建设就是装监控、建平台,因此认为它是信通等技术部门的事,与我无关。三是认为信息化是形象工程,花那么多钱建平台是摆那儿给各级领导参观的,因此认为公安信息化建设中看不中用。这些认识误区是基层民警对公安信息化建设提不起兴致,消极被动应付的根本原因之一。
1.2.5.2 标准曲线制作及样品中洛伐他汀含量测定 准确称取0.0030 g洛伐他汀标准品于10 mL容量瓶中,用色谱纯甲醇溶液溶解并定容至刻度线,配制成300 μg/mL洛伐他汀标准储备液。移取适量洛伐他汀标准储备液,配制成2、10、50、75、150、300 μg/mL的洛伐他汀标准工作液。以系列标准洛伐他汀浓度为横坐标,以峰面积为纵坐标制得标准曲线。
色谱条件:高效液相色谱仪;安捷伦C18色谱柱(4.6 mm×250 mm,5 μm);柱温:室温;流动相:V(甲醇)∶V(0.2%磷酸)=73∶27;流速:1 mL/min;进样量10 μL;检测波长:238 nm。
1.2.6 桔霉素含量测定
1.2.6.1 样品前处理 称取2.0 g样品粉末于5 mL磨砂玻璃试管中,加入2 mL萃取剂(甲苯∶乙酸乙酯∶甲酸=7∶3∶1,V/V,TEF)[21],涡旋30 s后,功率为280 W条件下超声提取10 min,10000 r/min离心2 min,残渣重复萃取1次,合并两次上清液,过0.22 μm有机相微孔滤膜微滤,装入进样瓶,待测。
1.2.6.2 标准曲线制作及样品中桔霉素含量测定 准确称取0.0010 g桔霉素标准品于10 mL容量瓶中,用色谱纯甲醇溶液溶解并定容至刻度线,配制成100 μg/mL桔霉素标准储备液,4 ℃保存。并梯度稀释成2、1、0.5、0.25、0.1、0.05、0.025、0.0125 μg/mL的桔霉素标准工作液。以系列标准桔霉素浓度为横坐标,以峰面积为纵坐标制得标准曲线。
色谱条件:荧光高效液相色谱仪;InertSustain C18色谱柱(4.6 mm×150 mm,5 μm);柱温:30 ℃;流动相:A液为乙腈,B液为0.1%磷酸溶液;流速:0.7 mL/min;进样量50 μL;检测波长:激发波长350 nm,发射波长500 nm[22]。检出限和定量限分别为25和80 μg/kg。梯度洗脱条件见表1。

表1 梯度洗脱条件Table 1 The conditions of gradient elution
1.2.7 红曲色素抗氧化性
1.2.7.1 羟自由基的清除能力 按照文献[23] 方法,配制1.8 mmol/mL FeSO4溶液、0.3% H2O2、1.8 mmol/mL水杨酸-乙醇溶液。将1.2.4中提取得水溶性和醇溶性色素样品稀释为0.01 g/mL,向试管中分别加入色素样品各1.0 mL,FeSO4溶液2 mL,水杨酸-乙醇溶液1.5 mL,最后加入H2O20.1 mL启动反应,振荡均匀,水浴37 ℃保温30 min。以1.0 mL超纯水作为空白,操作同上。在波长510 nm处测定吸光度。
清除率(%)=[(A0-As)/A0]×100
式中:A0为空白管吸光度;As为样品管吸光度。
1.2.7.2 DPPH·的清除能力 按照文献[23]方法,移取水溶性和醇溶性色素样品各0.1 mL,加入3.9 mL 0.1 mmol/L DPPH(95%乙醇配制),振荡均匀,避光37 ℃反应30 min。以0.1 mL超纯水作为空白,操作同上。于517 nm处测定吸光度。
清除率(%)=(1-As/A0)×100
式中:A0为空白管吸光度;As为样品管吸光度。
1.3 数据处理
数据处理采用Excel 2013软件进行数据处理,所有实验均重复操作3次,实验结果均表示为平均值±标准差。
2 结果与分析
2.1 发酵产物形态对比
M.z507红曲霉菌株发酵产物颜色呈淡红色,基质潮湿且略微松散,表面附着有一层橘红色菌丝(图1a);M.c507红曲霉菌株发酵产物颜色红色较浅,基质略微干燥且松散,表面菌丝生长旺盛(图1b);M.b2019红曲霉菌株发酵产物颜色呈鲜红色,基质紧密潮湿,表面红色菌丝生长旺盛(图1c);M.h2019红曲霉菌株发酵产物颜色呈深紫红色,基质非常紧密潮湿,表面无明显附着菌丝(图1d)。通过比较原料发酵产物外观形态来看,M.b2019和M.h2019这两株红曲霉菌株在含有木耳的基质原料中生长良好,代谢产生红曲色素比另外两株多,可能更适合用于固态发酵。

图1 发酵产物形态对比Fig.1 Comparison of morphology of the fermentation products注:a:M.z507;b:M.c507;c:M.b2019;d:M.h2019。
2.2 发酵性能参数测定结果
4株红曲霉菌固态发酵木耳和大米原料14 d后,按照1.2.3方法对发酵产品的性能参数进行测定,结果如表2所示。

表2 红曲霉菌发酵木耳红曲产品性能参数测定Table 2 The determination of performance parameters of Auricularia auricula Monascus products after fermentation by Monascus strains
由表2可得知,同原料对照组相比较,四株红曲菌株发酵产物中粗多糖和蛋白质含量均比发酵前少,其中M.h2019菌株发酵组原料粗多糖消耗最多,仅剩原料的1/4,M.c507菌株发酵组原料粗多糖含量消耗量最少,仅为M.h2019消耗量的一半;M.z507组剩余蛋白质含量最少,减少至约对照组的1/3,M.h2019组剩余蛋白质含量最多,比对照组相比约消耗了一半。四组发酵产物中还原糖含量相对于发酵前都增加了,其中M.c507增加得最多,约为对照组的10倍,M.b2019和M.h2019较少,M.z507增加得最少。菌株生长过程中分泌糖苷酶和蛋白酶降解大米中淀粉、蛋白质等营养物质[24],同时代谢如果胶酶和糖苷酶,将木耳中大分子多糖化合物而转化成了分子量较小的短链多糖、寡糖、还原糖等。M.c507菌株发酵组还原糖含量较高的原因可能是该菌株在大米-木耳混合基质上生长缓慢,消耗还原糖的量少,与之相反,其他3株菌在大米-木耳混合基质上生长良好。M.h2019组水溶性红曲色素和醇溶性红曲色素含量均是最高,其红曲色素含量约为M.b2019组所产红曲色素的5倍,其他两株菌所产色素明显较少,故M.h2019红曲霉菌株适合用于高产红曲色素的固态发酵。
2.3 洛伐他汀含量分析
由图2可知,在2~300 μg/mL的范围内,峰面积与洛伐他汀浓度线性关系良好,回归方程为y=31067x-62851,R2=0.9986。

图2 洛伐他汀标准曲线Fig.2 The standard curve of lovastatin
四种红曲固态发酵产物中洛伐他汀含量见图3和表3,标准品和发酵样品中洛伐他汀均在25 min左右出峰,峰型良好,保留时间一致。样品中,M.h2019菌株发酵所产洛伐他汀含量最高,为M.b2019菌株所产洛伐他汀的2.5倍,约为M.z507菌株所产洛伐他汀的17倍,M.c507菌株在发酵过程中几乎不产洛伐他汀。这是由于洛伐他汀产量与红曲色素产量呈正相关[25],四株红曲菌株中M.h2019产红曲色素最多,故其洛伐他汀产量最高,M.b2019和M.z507菌株产色素较少,则洛伐他汀产量相应较少,而M.c507菌株在发酵过程中只产生了极少量红曲色素,所以几乎不产洛伐他汀。因此,M.h2019最适合制备高产洛伐他汀的发酵产品。
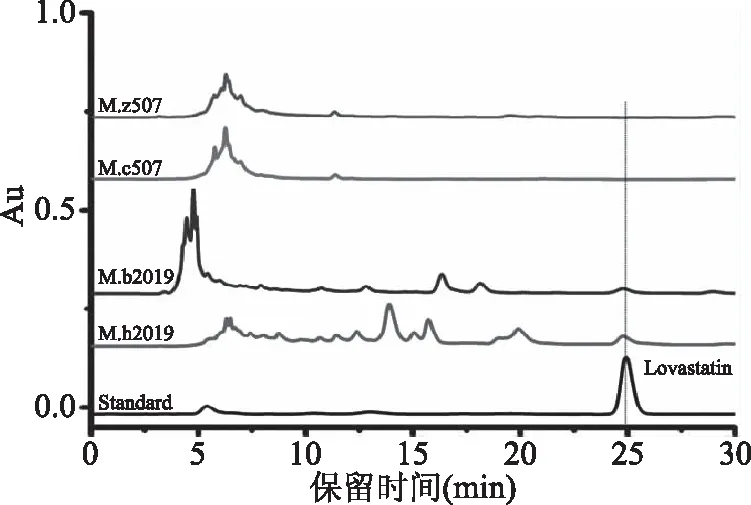
图3 洛伐他汀色谱图Fig.3 The chromatogram of lovastatin

表3 四株红曲霉菌产洛伐他汀和桔霉素的含量Table 3 The lovastatin and citrinin contents of four Monascus strains
2.4 桔霉素含量分析
图4可知,在0.0125~2 μg/mL的范围内,峰面积与桔霉素浓度线性关系良好,回归方程为y=4160396x+16884,R2=0.999。
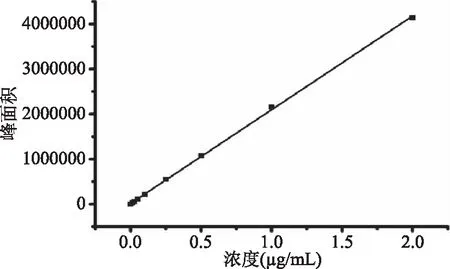
图4 桔霉素标准曲线Fig.4 The standard curve of citrinin
四种红曲固态发酵产物中桔霉素含量见图5和表3,标准品和发酵样品中桔霉素出峰时间均在9 min左右,保留基本时间一致,标准品峰型良好。样品中,M.z507、M.c507、M.b2019均不产桔霉素,M.h2019菌株产桔霉素但含量低于国标限量(0.05 mg/kg)[26],所以该四株红曲菌株发酵产品都具有安全性。
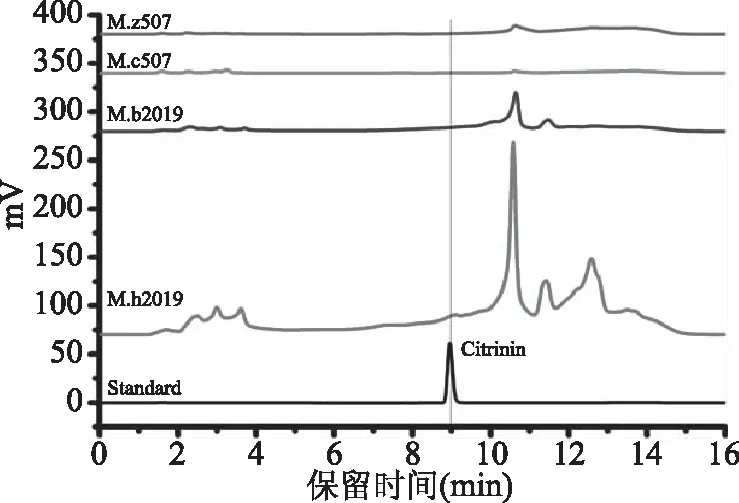
图5 桔霉素色谱图Fig.5 The chromatogram of citrinin
2.5 红曲色素抗氧化性分析
2.5.1 羟自由基的清除能力 四株红曲固态发酵产物中水溶性和醇溶性红曲色素对羟自由基的清除能力见图6。
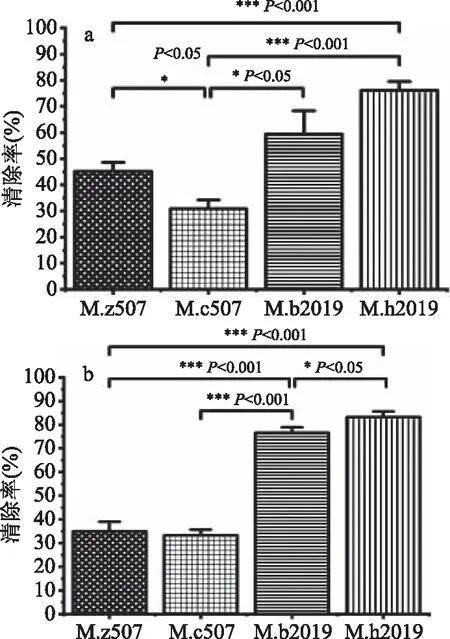
图6 四种红曲色素羟自由基清除能力Fig.6 The hydroxyl radical scavenging ability of four Monascus pigments注:a:水溶性红曲色素;b:醇溶性红曲色素;图7同。
由图6a可知,水溶性红曲色素的羟自由基清除能力由强到弱均依次为M.h2019、M.b2019、M.z507、M.c507,其清除率分别为76.19%、59.52%、45.24%、30.95%。M.h2019和M.b2019与M.c507存在显著性差异,M.h2019清除率约为M.c507的2.5倍,M.b2019清除率约为M.c507的2倍,但M.b2019与M.h2019比较无显著性差异;M.z507清除率与M.c507、M.h2019均具有显著性差异。由图6b可知,醇溶性红曲色素的羟自由基清除能力由强到弱均依次为M.h2019、M.b2019、M.z507、M.c507,其清除率分别为83.33%、76.67%、35.00%、33.33%。M.h2019清除效果最好,约为M.c507的2.5倍,差异十分显著;M.b2019清除能力显著高于M.z507和M.c507。由此可知,除M.z507外,其余三组醇溶性红曲色素的羟自由基清除能力均大于水溶性红曲色素的羟自由基清除能力,M.h2019菌株无论是水溶性红曲色素还是醇溶性红曲色素对羟自由基的清除能力均为最强。
2.5.2 DPPH·的清除能力 四种红曲固态发酵产物中水溶性和醇溶性红曲色素对DPPH·的清除能力见图7,这四株红曲霉菌醇溶性红曲色素均高于各自水溶性红曲色素的清除能力。M.h2019菌株水溶性红曲色素DPPH·清除率为19.90%,醇溶性红曲色素DPPH·清除率为45.42%,其醇溶性的清除能力约为其水溶性的2倍,由图7可知其水溶性和醇溶性红曲色素DPPH·清除能力最强。M.c507、M.z507、M.b2019水溶性红曲色素DPPH·清除率分别为11.75%、11.10%、10.45%,都约为M.h2019清除率的1/2。M.b2019、M.c507、M.z507醇溶性红曲色素DPPH·清除率分别为16.34%、13.35%、11.12%,都约为M.h2019清除率的1/3。
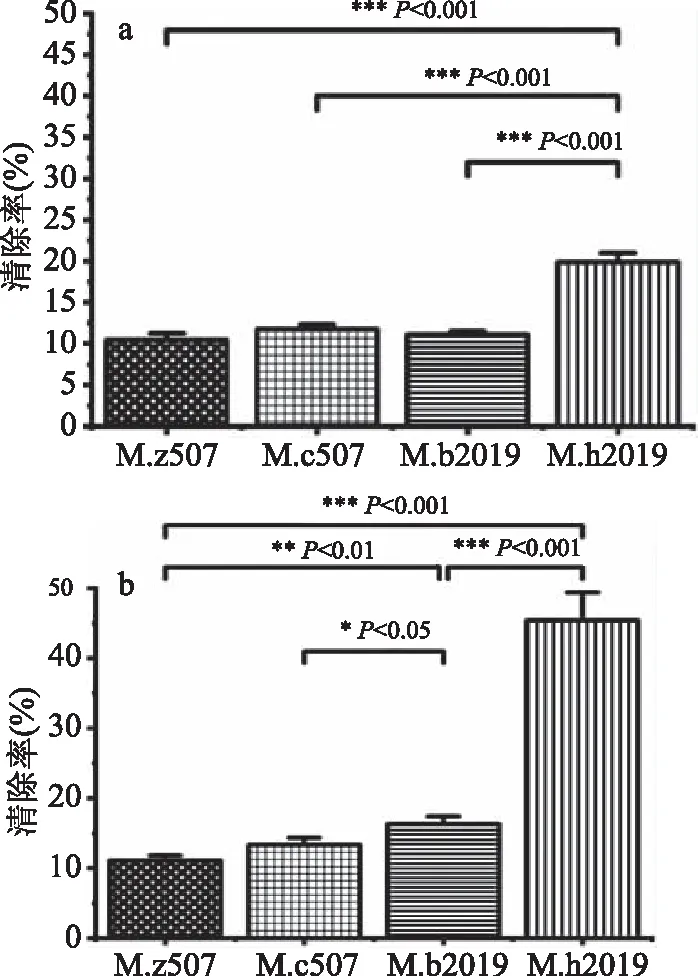
图7 四种红曲色素DPPH·的清除能力Fig.7 The DPPH· scavenging ability of four Monascus pigments
综上,表明红曲色素具有抗氧化活性,四株红曲霉菌株除M.z507外,所产的红曲色素中醇溶性色素的抗氧化性均比水溶性色素的抗氧化性强。M.h2019菌株在木耳-大米复合基质上能够较好生长,代谢产生大量红曲色素。从洛伐他汀和桔霉素产生情况综合分析表明,M.h2019适合木耳-大米复合基质固态发酵,生产抗氧化、降血脂的功能性食品。
3 结论
试验结果表明利用红曲霉菌对木耳进行微生物发酵之后,M.z507、M.b2019、M.h2019这三种红曲霉菌株的固态发酵产物中洛伐他汀和红曲色素等功效性成分和抗氧化性能力均有所提升。通过分析比较四株红曲霉菌菌株对木耳-大米复合基质的发酵性能参数,功效成份含量,有害成份含量测定筛选出M.h2019可用于该复合基质的发酵生产。发现M.h2019菌株固态发酵产物中洛伐他汀含量最高,达到了1724.189 μg/g,且桔霉素含量低于国家标准限量,其他性能指标除多糖、还原糖和蛋白质之外均为最高值,可能是由于该种菌株在发酵过程中消耗了培养基中部分大分子糖类和蛋白质,转化为了其他小分子代谢产物。所以选用M.h2019作为后续固态发酵制备高产色素和洛伐他汀的木耳红曲产品的最佳菌种。
