腰椎间盘突出症患者术后核心肌肉训练干预效果分析
2020-09-23袁宁翟树玉刘凯
袁宁 翟树玉 刘凯
腰椎间盘突出症 ( Lumbar disc herniation,LDH )又称腰椎纤维环破裂或腰椎间盘髓核脱垂,是骨科常见病、多发病之一,是引起腰背部疼痛和下肢放射性疼痛的主要原因[1]。LDH 终生患病率约为 1%~3%,大多数患者 LDH 发生在 30~59 岁,但也可能发生在青少年和老年人中[2]。椎间盘退变、脊柱负荷过重以及慢性炎症反应等是 LDH 发生、进展原因[3]。约 2%~5% 的 LDH 患者需要临床治疗[2-3]。LDH 的治疗方法通常采用微创技术,其中包括显微内镜椎间盘切除术 ( microendoscopic discectomy,MED ) 和经皮内镜腰椎间盘切除术 ( percutaneous endoscopic lumbar discectomy,PELD )[4]。PELD 包括经皮内镜经椎间孔椎间盘切除术 ( percutaneous endoscope transforaminal discectomy,PETD ) 和经皮内镜下椎间盘摘除术( percutaneous endoscopic discectomy,PEID )。最近研究认为 PETD 是 LDH 患者治疗的最佳选择[5]。
LDH 患者 PETD 术后康复是一个有争议的话题,其治疗效果缺乏确凿证据及理论依据。随机对照试验表明,从长期来看,LDH 患者术后参与综合物理治疗方案可能并不优于虚假治疗[6]。而循证医学研究表明,术后 4~6 周开始康复训练对术后疼痛缓解和改善患者功能效果显著且降低 LDH 患者术后复发风险[7-8]。
腰-盆-腹区域通常被称为“核心区域”。局部核心肌群和整体核心肌群之间缺乏合作,肌肉的精确协调常常受到损害。这也是 LDH 形成原因[3,9]。研究发现,腰背部和骨盆束带疼痛患者经常出现局部 / 整体核心肌肉不协调和去适应现象[9]。核心区域的肌肉训练可以改善大学生 LDH 患者腰椎功能、椎旁肌肉力量和抗疲劳能力[10]。目前尚不得知核心肌肉训练对于 PETD 术后患者的恢复进程影响。为此,本研究开展一项单盲、随机临床对照研究。试图证实核心肌肉训练可能加快 LDH 患者术后恢复进程。
资料与方法
一、纳入标准与排除标准
1. 纳入标准:( 1 ) 年龄>18 岁;( 2 ) 腰、下肢明显疼痛,下肢放射痛及麻木,肌力下降或肌腱反射消失;( 3 ) 术前常规保守治疗至少 1 个月,疗效不佳;( 4 ) 经 CT 或 MRI 诊断为单节段 LDH ( L4~5或L5~S1),影像学诊断结果与症状相符;( 5 ) 无合并腰椎不稳、滑脱;无手术或椎管内硬膜外介入治疗史;( 6 ) 完整临床资料并获得术后 6 个月随访。
2. 排除标准:( 1 ) 其它原因导致腰腿疼痛,如腰椎结核、慢性腰肌劳损或强直性脊柱炎等疾病;( 2 ) 既往脊柱手术、精神疾病、恶性疾病病史者;( 3 ) X 线片、CT、MRI 检查发现中重度中央椎管狭窄、重度椎间盘钙化等疾病者;( 4 ) 慢性非特异性疼痛障碍,如纤维肌痛、鞭痛等疾病者;( 5 ) 内科疾病,如高血压、糖尿病或心脏病等疾病;( 6 ) 类风湿性关节炎或其它严重全身性炎症性疾病患者。
二、一般资料
选取 2017 年 1 月至 2019 年 1 月我院收治的 90例 LDH 患者,所有患者符合《腰椎间盘突出症分级诊疗指南》中的诊断标准,术前经 CT 和 MRI 检查确诊为 LDH。所有患者均有与椎间盘突出程度相对应神经根受压的疼痛症状和体征。根据随机数字表发将90 例分为观察组及对照组,每组各 45 例。本研究采取单盲法,两组受试者不了解分组情况。末次随访,观察组患者因个人原因退出研究 1 例,因无法完成训练项目退出研究 1 例,最终有效随访 43 例;对照组因个人原因退出研究 3 例,因 LDH 复发退出研究1 例,最终有效随访 41 例。本研究入组患者均获得签署知情同意并签署知情同意书。本研究经医院伦理委员会审核通过两组患者临床资料比较差异无统计学意义,具有可比性 (P<0.05 ) ( 表 1 )。

表 1 两组患者临床资料比较Tab.1 Comparison of clinical data of the 2 groups
三、方法
1. 康复治疗:两组患者术后 0~3 周进行初步物理治疗。两组患者均由本院物理治疗师进行相关术后康复训练的宣教。术后第 1 天开始运动,包括通过激活深腹肌增加躯干稳定性、背部和臀部肌肉运动以及如何起床等训练。训练后 3 周,观察组采用核心肌肉训练,根据神经肌肉激活法原理[11],优化核心区域的肌肉协调及强度。
干预的两个主要目标:( 1 ) 达到对局部肌肉放松的有意识控制,并了解患者在运动中的表现;( 2 )将局部肌肉与产生扭矩的整体肌肉系统相结合,从而使二者协调一致。在这项技术中,受试者的任务是将下腹部 ( 在肚脐和耻骨联合之间 ) 轻轻移至仰卧位,不激活上腹部。在正确的操作过程中,超声对侧腹壁的反馈显示腹横肌厚度明显增加,腹内 / 外斜肌厚度的变化更小。第 1 个目标是通过训练单独的、有意识的激活局部肌肉来实现。本阶段根据标准指南[12]采用仰卧位局部控制技术,并结合超声反馈来进行。观察组患者主要任务是将下腹部 ( 在肚脐和耻骨联合之间 ) 轻轻移至仰卧位,不激活上腹部。操作过程中,超声可显示腹横肌厚度增加,腹内 / 外斜肌厚度变小。早期通过一个初步训练来掌握这项康复技能。预期目标是能够轻松地进行两组 10 s 收缩,没有全身肌肉激活现象并保持正常的呼吸。第 2 个目标是通过两个标准封闭式动力链训练来实现,分别称为仰卧桥和俯卧桥[13-14]。仰卧桥:以仰卧位进行桥锻炼,膝关节 90°,双臂展开约30°,双手着地。头部和颈部保持笔直。俯卧桥:以俯卧位进行桥锻炼,肘部成 90°,身体由前臂和脚趾支撑,颈部略微伸长。受试者每周进行 3 天锻炼,每次锻炼 5 个组合 ( 仰卧桥及俯卧桥 ),共 30 次,每次锻炼时腰椎活动位置维持 3 s,组间停顿时间为3 min,为期 8 周。运动项目均在我院康复科训练场且康复师监督下进行康复。
2. 疗效评估:( 1 ) 疼痛:根据疼痛视觉模拟评分 ( visual analogue scale,VAS ) 评估腰背部及下肢的疼痛程度,该量表分值 0~10,分数越高,疼痛程度越重。( 2 ) 腰背部功能:采用 Oswestry 功能障碍指数 ( oswestry disability index,ODI ) 评估腰背部功能,改评分由 10 个问题组成,每个问题 6 个选项,每个问题的最高得分为 5 分,选择第一个选项得分为 0 分,依次选择最后一个选项得分为 5 分,分值0~50 分,分值越高表明腰背部功能障碍越严重。上述指标均于术前 1 天、术后 3 个月、术后 6 个月进行收集。( 3 ) 炎症因子:两组患者均空腹抽取静脉血 20 ml,采用酶联免疫吸附法 ( enzyme-linked immunosorbent assay,ELISA ) 检测高敏 C-反应蛋白( high sensitivity c-reactive protein,hs-CRP )、肿瘤坏死因子 α ( tumor necrosis factor-α,TNF-α )、白介素( interleukin,IL ) -1、IL-6、IL-10、IL-18。
四、统计学处理
采用 SPSS 22.0 软件进行统计学分析。计数资料采用率 ( % ) 表示,采用χ2检验。计量资料采用±s表示,采用独立样本t检验,不同时间点计量资料比较采用方差分析,两两比较采用 SNK-q检验。P<0.05 为差异有统计学意义。
结 果
一、两组患者疼痛及腰背部功能变化情况
两组患者术前 1 天 VAS 评分 ( 腰背部及下肢 )、ODI 评分比较差异无统计学意义 (P>0.05 )。两组患者的不同时间点 VAS 评分 ( 腰背部及下肢 )、ODI 评分比较差异有统计学意义 (P<0.05 ),其中,术后3 个月及 6 个月的 VAS 评分 ( 腰背部及下肢 )、ODI评分较术前 1 天下降 (P<0.05 ),术后 6 个月的 VAS评分 ( 腰背部及下肢 )、ODI 评分较术后 1 个月下降(P<0.05 )。观察组患者术后 3 个月及 6 个月的 VAS评分 ( 腰背部及下肢 )、ODI 评分均低于对照组患者(P<0.05 ) ( 表 2 )。
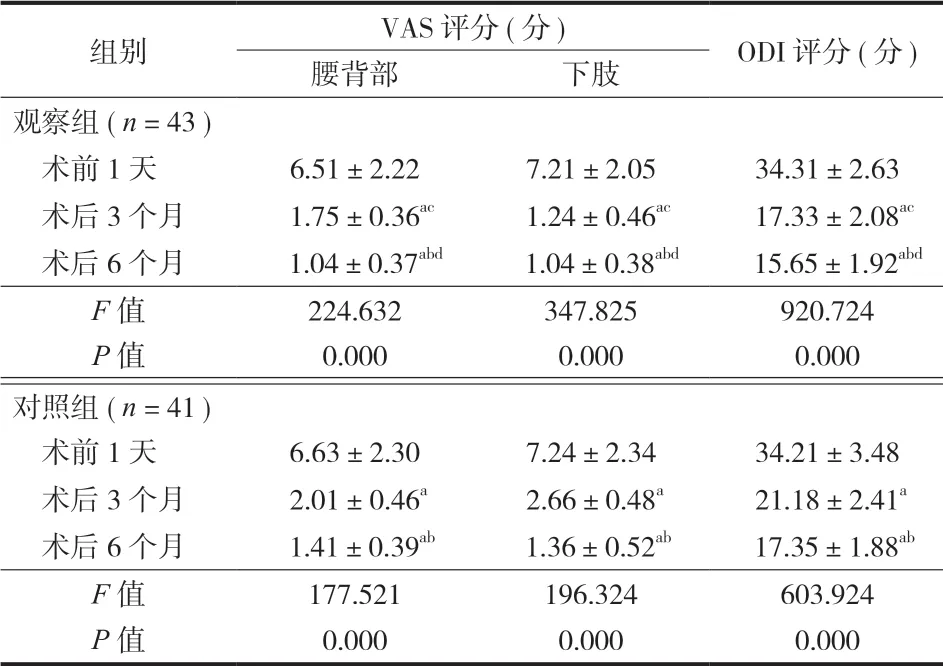
表 2 两组患者疼痛及腰背部功能变化情况Tab.2 Changes of pain and low back functions of the 2 groups
二、两组患者炎症因子变化情况
两组患者术前 1 天 hs-CRP、TNF-α、IL-1、IL-6、IL-10、IL-18 的水平比较差异无统计学意义(P>0.05 )。两组患者的不同时间点 IL-1、IL-18 水平比较差异有统计学意义 (P<0.05 ),其中,术后3 个月及 6 个月的 IL-1、IL-18 水平较术前 1 天下降(P<0.05 ),术后 6 个月的 IL-1、IL-18 水平较术后3 个月下降 (P<0.05 ) 。观察组患者术后 3 个月及6 个月的 IL-1、IL-18 水平均低于对照组患者 (P<0.05 ) ( 表 3 )。
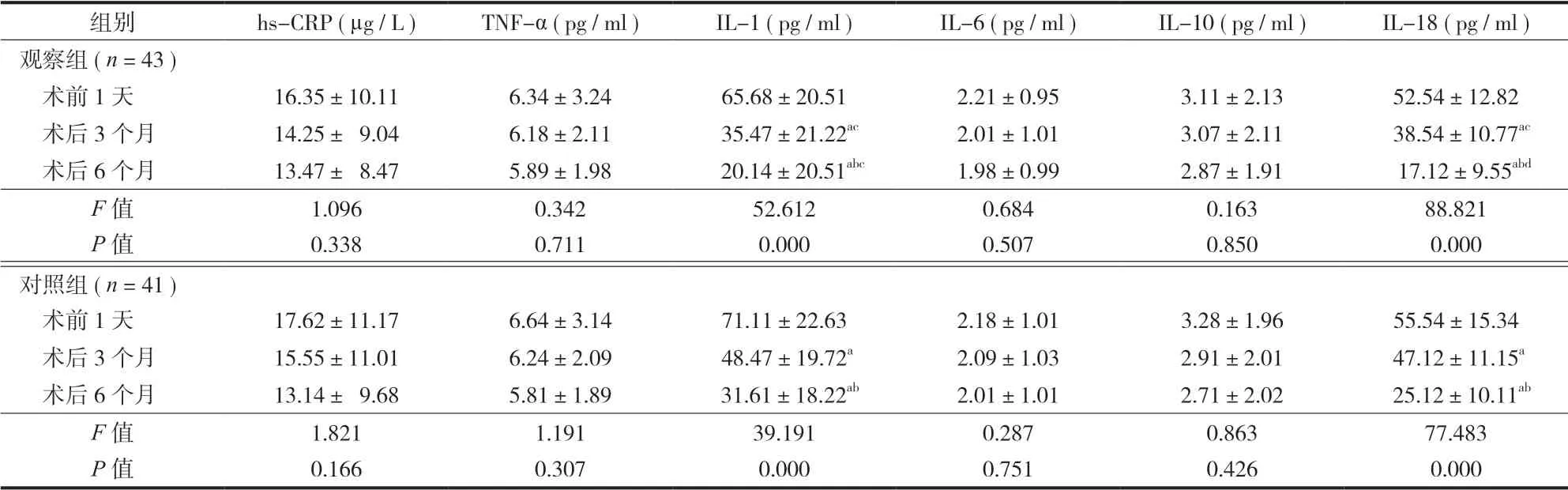
表 3 两组患者炎症因子变化情况Tab.3 Changes of inflammatory factors of the 2 groups
讨 论
多年来,学者们对 LDH 患者术后康复模式进行研究,其内容和结果各不相同[6,8]。本研究旨在探讨 LDH 患者 PETD 术后核心肌肉训练对机体炎症因子、疼痛及腰背部功能的影响。正如预期那样,核心肌肉训练能显著降低 IL-1 及 IL-18 水平,降低术后腰背部及下肢疼痛,改善腰背部功能,加快康复进程。
LDH 发病机制一个重要原因是坐姿不当。长时间保持身体前屈,易使脊柱肌群和棘上、棘间韧带疲劳,致核心区域肌肉协调性不足,导致 LDH[10]。核心区域肌力量是保持整个脊柱稳定,正常活动重要因素。通过核心肌肉训练伸展躯干部的软组织,缓解肌肉痉挛,减轻腰背肌疼痛;增强腰背肌肉力量,矫正肌力不均衡,纠正腰椎的代偿性侧弯畸形,改善腰椎节段;增强脊柱前纵韧带和后纵韧带柔韧性,保护椎体,促进椎体形态恢复,平衡脊柱应力,稳定小关节,增强腰椎稳定性,改善腰椎关节活动范围;促进椎间盘组织的血液循环,改善椎间盘的营养,促进局部肿胀吸收及神经肌肉活动功能恢复;改善神经根,改善神经系统对肌肉的调节功能,改善下肢运动功能[10]。本研究结果提示核心肌肉训练可以降低 LDH 术后下肢及腰背部疼痛,改善腰背部功能。
早期现代医学认为机械性压迫是导致腰背部及下肢疼痛的原因[15]。最新理念认为血液和腰椎组织中的炎症因子对神经系统有毒性作用,可刺激神经产生疼痛感,引起神经根疼痛[16-18]。神经疼痛产生和维持是多种炎症因素共同作用结果。IL-1 和IL-18 起着调节免疫反应和炎症反应作用,在于退变性椎间盘组织中高表达[19]。既往研究证实 IL-1 在风湿性关节炎中的表达可诱导软骨细胞周围基质降解,导致软骨细胞凋亡[20]。同样,近期研究也证实IL-18 可能参与酸敏感离子通道,参与骨性关节炎软骨细胞凋亡过程[21]。在对 LDH 病程的研究中发现,软骨细胞凋亡机制被认为是其最重要过程[22]。这些炎症因子发挥不同生化作用,刺激神经根和疼痛受体,导致神经根疼痛,增加神经根疼痛程度,反映疼痛变化[19,23]。经皮椎体成形术术后康复训练有利于降低细胞因子水平,利于术后腰背部功能恢复[24]。同样,康复训练对血液透析患者炎症生物标志物也具有一定抑制作用[25]。但是具体机制目前尚不清楚,需要进一步深入研究。至少在健康人群中观察到肌肉中的线粒体体积密度随着耐力训练而增加,降低 NADPH 氧化酶活性和表达,增加红细胞数量和激活骨骼肌中抗氧化系统[26-27]。这些都与机体炎症反应息息相关。
综上所述,核心肌肉训练可以降低 LDH 患者PETD 术后腰背部及下肢疼痛,改善腰背部功能,降低炎症因子水平。
