俯卧位通气联合肠内营养支持对食管癌术后呼吸窘迫综合征患者预后的影响
2020-09-22岳伟
岳伟
(安阳市肿瘤医院 监护室,河南 安阳 455000)
手术是治疗食管癌的主要手段,但术后易发生感染、呼吸窘迫等并发症。呼吸窘迫综合征(acute respira-tory distress syndrome,ARDS)多发生于出血、手术、创伤、感染等,该并发症在消化道肿瘤中有较高的发病率及病死率[1]。随着现代医疗水平的提升,食管癌术后相关并发症发生率呈下降趋势,但呼吸系统相关并发症仍是造成术后患者死亡的主要原因之一。由于术后会增加患者体内营养成分的消耗,引起营养不良,继而影响预后。因此,采取有效的营养支持有利于疾病恢复[2]。基于此,本研究旨在探讨俯卧位通气联合肠内营养支持对食管癌术后呼吸窘迫综合征患者预后的影响。
1 资料与方法
1.1 一般资料选取2016年11月至2019年11月安阳市肿瘤医院收治的81例食管癌术后ARDS患者,按照随机数表法分为对照组与观察组,各30例。对照组男16例,女14例;年龄40~77岁,平均(58.03±10.41)岁。观察组男17例,女13例;年龄39~77岁,平均(57.94±10.43)岁。两组性别、年龄比较,差异无统计学意义(均P>0.05)。本研究经安阳市肿瘤医院审批通过。
1.2 选取标准(1)纳入标准:①经手术病理确诊为食管癌,行食管癌切除术,于颈部、弓上、弓下行食管胃胸腔内吻合术;②符合《急性肺损伤/急性呼吸窘迫综合征诊断与治疗指南(2006)》[3]中ARDS标准;③患者、家属签署知情同意书。(2)排除标准:①中途要求更改治疗方案;②对相关研究禁忌;③表达障碍。
1.3 治疗方法
1.3.1对照组 接受俯卧位通气和肠外营养支持联合治疗。(1)术前清理患者呼吸道内分泌物,于肠内营养前关闭鼻饲1 h。协助患者更换体位为俯卧位,再将患者身体缓慢翻转至卧位,头部垫马蹄形枕,头偏至一侧;在患者肩部、盆骨、胸部、膝部下方分别放置软枕,悬空腹部,防止腹主动脉受压,影响静脉回流,后将患者手臂放于头两侧;注意俯卧位时气管导管、静脉导管及所有引流管需保证通畅;呼吸机选择同步间歇通气模式进行通气。(2)肠外营养支持:于术后第1天经静脉滴注,根据热量105.5 kJ·kg-1·d-1及氮0.15~0.2 g·kg-1·d-1给予患者营养支持,糖脂比例6∶4,热氮比150 kcal∶1 g(1 kcal=4 186.8 J),并将复方氨基酸400 mL、多种微量元素、100 g·L-1的葡萄糖800 mL等配置出的静脉营养液,参考患者体质量对其进行电解质及体液补充;连续滴注7 d,至患者恢复正常肠道蠕动,肛门排气后拔出胃管,从流质食物慢慢过渡至半流质食物。
1.3.2观察组 在对照组基础上接受肠内营养支持。术后给予患者肠外营养支持,同对照组方法一致,第2天经鼻肠管滴入100 mL生理盐水,若患者无任何不良反应,第3天开始可滴入250~500 mL肠内营养混悬液[纽迪希亚制药(无锡)有限公司,国药准字H20010284],并从500 mL逐渐加至2 000 mL,之后随患者自身状况于第3、4、5天灌注的速度逐日调整为50、75、100 mL·h-1,并同时减少肠外营养用量,若患者每日肠内营养无法满足自身需求量,则剩余营养由肠外营养支持补充。第6天可适当加入鱼汤、蔬菜汤等。输注时,营养液温度需维持38~40 ℃,输注完成后,进行管道冲洗,避免发生管道堵塞现象,并及时观察患者有无腹胀等不良反应发生。俯卧位通气同对照组。
1.4 评价指标(1)开始通气时及通气72 h后患者的白细胞介素-6(interleukin 6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平,取静脉血,应用化学发光免疫分析法对IL-6、TNF-α进行检测;(2)治疗前、治疗7 d后患者的血红蛋白、血清蛋白水平。

2 结果
2.1 炎症指标治疗前,两组IL-6、TNF-α水平比较,差异无统计学意义(均P>0.05);治疗72 h后,两组IL-6、TNF-α水平均下降,观察组IL-6、TNF-α水平均低于对照组,差异有统计学意义(均P<0.05)。见表1。
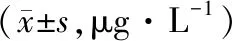
表1 两组治疗前后炎症指标比较
2.2 血红蛋白和血清蛋白水平治疗7 d后,观察组血红蛋白、血清蛋白水平均高于对照组,差异有统计学意义(均P<0.05)。见表2。

表2 两组治疗7 d后血红蛋白和血清蛋白水平比较
3 讨论
食管癌为常见恶性肿瘤,手术根治为其主要治疗手段。ARDS是在严重疾病过程中继发的急性渗透性肺水肿和进行性缺氧性呼吸衰竭,是食管癌术后严重的并发症之一,具有病死率高的特点。ARDS的主要发病原因与手术创伤、感染、肺部病变、术后营养等因素有一定关系。因此,积极帮助患者改善肺氧合功能,纠正低氧血症,有效实施营养支持,是治疗食管癌术后ARDS的有效手段,而治疗的关键在于如何提高氧气摄取及输送,保障细胞组织氧供。
本研究结果显示,观察组治疗72 h后IL-6、TNF-α水平均低于对照组,治疗7 d后血红蛋白、血清蛋白水平均高于对照组,表明肠内营养支持和俯卧位通气联合能够减轻患者炎症反应,降低肺损伤程度,改善营养状况。分析俯卧位通气机制为:(1)使肺内通气更均匀地分布,因肺自重,在生理情况下会造成肺较低位肺组织负压减小,常规体位通气,气体分布于该部分,俯卧位通气能促使实变肺组织压至上方,于重力作用下,患者肺组织于通气时重新张开,使该部分通气得到改善,肺内气体更加均匀地分布,进而改善低氧血症,让患者肺内气体进行重新分布;(2)改善膈肌运动,俯卧位时能减少背侧膈肌对肺底压力,实变肺组织复张,继而将此部位肺氧合功能得到有效改善;(3)降低心脏对肺部压力,俯卧位能将心脏对于肺部压力移至胸骨上,减少部分肺压力,改善肺组织通气功能及顺应性;(4)提高功能残气量,俯卧位时腹部及胸廓之间呼吸运动更协调,且肺重力依赖区塌陷肺泡重新开放,功能残气量提高,从而改善低氧血症[4]。肠外营养是指经静脉内为患者供给营养,临床一般作为手术前后及危重患者的营养支持,虽有一定效果,但若长时间应用易引起肠黏膜屏障的萎缩及其他并发症。肠内营养更加符合人体的生理需求,是通过肠胃道提供所需营养物质的方式,相比肠外营养,能够将营养素直接经肠吸收[5-6]。此外,肠内营养不仅能够供给患者营养需求,增强对蛋白质、能量及膳食纤维等营养物质的吸收,且肠内营养支持的营养剂为肠胃道黏膜提供营养,保护肠胃道屏障功能,减少细菌移位,减轻炎症反应[7-8]。
综上所述,俯卧位通气联合肠内营养支持能够有效减轻患者炎症反应,改善营养状况。
