男性高血压患者血尿酸与勃起功能障碍及血管内皮损伤的关系
2020-09-22夏大胜何强王丽毛大庆夏伟卢成志李超
夏大胜,何强,王丽,毛大庆,夏伟,卢成志,李超
流行病学研究表明高血压人群勃起功能障碍(ED)的患病率为36%~45%,是血压正常人群的2~3 倍[1-2]。尿酸(UA)是嘌呤代谢的终产物,高尿酸血症与高血压病发生发展及病死率密切相关[3-4]。临床小样本研究发现,高血压伴ED 患者血UA 水平高于勃起功能正常患者[5]。一氧化氮(NO)是内皮细胞产生的舒张血管因子,由内皮型一氧化氮合酶(eNOS)作用于 L- 精氨酸生成;内皮微粒(endothelial microparticle,EMP)是一种结构复杂的囊泡状物质,是内皮细胞受到刺激、损伤和凋亡过程中释放的产物。内皮功能障碍在ED 的发病过程中起着重要作用,NO、eNOS及EMP是内皮损伤的主要标志物[6]。本研究旨在探讨高血压病患者血清UA水平变化与ED、NO、eNOS及EMP的关系,为高血压伴ED的防治提供依据。
1 对象与方法
1.1 研究对象 选择2018年1月—2019年12月就诊于我院心内科门诊或住院新诊断的男性高血压患者,通过病史及ED 问卷,100 例诊断高血压伴ED 者(轻度31 例、中度 34 例、重度35 例)为ED 组,采用年龄配对(±2 岁)方法选择同期新诊断高血压无ED 者100 例作对照组,研究对象均为天津市汉族人群,未服用过降压药物,具有高中以上文化程度,自愿参加本研究项目,有稳定性伴侣,运动平板试验阴性。依据《中国高血压防治指南(2010 年修订版)》标准诊断高血压,非同日2 次以上测量收缩压≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg,入选对象均排除感染性疾病、肿瘤、慢性阻塞性肺部疾病、自身免疫性疾病、心功能不全、既往有泌尿生殖器手术、神经系统疾病影响性功能、服用影响UA 代谢药物者;并通过夜间阴茎勃起与硬度检测排除心理因素导致ED。
1.2 研究方法
1.2.1 一般资料 记录年龄、血压、吸烟史、糖尿病史、测量身高、体质量,计算体质量指数(BMI),糖尿病定义为任意时间血浆葡萄糖水平≥11.1 mmol/L 或空腹血糖(FBG)水平≥7.0 mmol/L 或口服葡萄糖耐量试验(OGTT)餐后2 h 血糖水 平≥11.1 mmol/L,采用德国COBAS MODULAR DPP全自动生化分析仪测定患者总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)及高密度脂蛋白胆固醇(HDL-C),血压测定以《中国高血压防治指南(2010年修订版)》为标准。
1.2.2 勃起功能评估及功能障碍诊断 采用勃起功能障碍国际指数问卷表-5(international index of erection function-5,IIEF-5)为ED 评估问卷[7],受试者根据过去6 个月内性行为情况,回答IIEF-5问卷中5个问题,将每个问题得分相加,计算出勃起功能得分。IIEF-5包括5个层面:勃起功能、性交满意度、达到性高潮能力、性欲、总体满意度;其中ED的诊断依靠勃起功能层面得分,这5 个问题包括勃起自信度、插入能力、维持勃起能力、完成性交能力及性满意度,每项0~5分,总分25分,0~7分为重度ED,8~11分为中度ED,12~21分为轻度ED,22分以上为正常。
1.2.3 血清UA、NO 及eNOS 测定 空腹采肘正中静脉血5 mL,血清UA、肌酐以尿酸酶法测定,按适合中国人改良MDRM 方程计算估算肾小球滤过率(estimated glomercular filtration rate,eGFR)。NO、eNOS 采用普通管,3 000 r/min 离心15 min,取血清在-80 ℃冰箱保存待测,以酶联免疫法检测,试剂盒购于美国ADL公司。
1.2.4 EMP 检测 空腹采肘正中静脉血5 mL,加入含1%EDTA抗凝试管中,采用流式细胞技术检测,1 200 r/min离心10 min,抽出上清液,1 500 r/min离心30 min,经2次离心后的上清液为贫血小板血浆,应用美国BD公司CD31、CD42两种荧光素标记的特异性样本,100 μL血浆样本加入CD31、CD42抗体各5 μL后,于室温下孵育20 min,加入3.8 μm标准计数微球、0.8 μm校准微球后,添加PBS缓冲液至500 μL。以美国BD公司FACSCalibur型流式细胞仪检测直径小于1 μm CD31+/CD42b-内皮微粒,收集3 μm乳胶微球10 000个绝对计数微球后停止计数,即获得CD31+/CD42b-微粒数/内皮微粒总数的百分含量。
1.3 统计学方法 采用SPSS 17.0软件进行统计分析。符合正态分布的计量资料以表示。2 组间比较采用t检验,多组间比较采用单因素方差分析,组间多重比较行SNK-q检验;计数资料以例(%)表示,采用χ2检验。指标间的相关性采用Pearson相关分析。影响因素分析采用多元Logistic回归分析法和多元逐步回归分析。绘制诊断试验四格表分别计算敏感度、特异度、阳性预测值、阴性预测值,采用受试者工作特征曲线(ROC)并计算曲线下面积(AUC),P<0.05 为差异有统计学意义。
2 结果
2.1 对照组与ED组基线特征比较 ED组舒张压、糖尿病比例、TG、LDL-C 及BMI 高于对照组(P<0.05 或P<0.01),而2 组收缩压、eGFR、吸烟率、TC、HDL-C比较差异无统计学意义,见表1。

Tab.1 Comparison of clinical characteristics between two groups表1 2组间一般临床资料比较 (n=100)
2.2 对照组与 ED 各组 UA、NO、eNOS 及 EMP 比较 轻、中、重度ED组与对照组比较,UA、NO、eNOS及EMP差异均有统计学意义,重度ED组UA和EMP高于其他各组,而NO 和eNOS 低于其他各组;中度ED 组 UA 和 EMP 高于轻度组及对照组,而 NO 和eNOS 低于轻度组及对照组,轻度组UA和EMP 高于对照组;而 NO 和 eNOS 低于对照组(P<0.05),见表2。
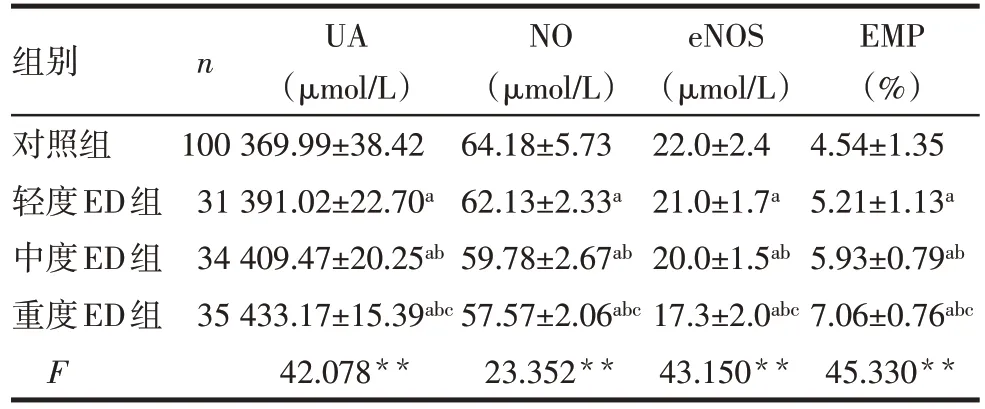
Tab.2 Comparison of the levels of UA,NO,eNOS and EMP between control group,mild ED group,moderate ED group and severe ED group表2 对照组与ED各组血UA、NO、eNOS及EMP比较
2.3 相关分析结果 将200例高血压患者作为整体进行 Pearson 相关分析,UA 与 NO、eNOS 呈负相关,与EMP 呈正相关(r分别为-0.589、-0.693、0.717,均P<0.01)。
2.4 高血压EMP 水平多元逐步回归分析 以高血压患者EMP为因变量,年龄、收缩压、舒张压、eGFR、TC、TG、LDL-C、HDL-C、BMI、糖尿病(是=1,否=0)、吸烟(是=1,否=0)及UA为自变量,进行多元逐步回归分析,结果显示UA、LDL-C、收缩压、糖尿病为EMP 的影响因素,回归方程复相关系数R=0.703,决定系数R2=0.495,F=47.723,P<0.01,见表3。

Tab.3 Multivariate stepwise analysis result of influence serum EMP level in ED patients with hypertension表3 影响高血压伴ED血EMP水平的多元逐步回归分析结果
2.5 高血压患者发生ED 影响因素的Logistic 回归分析 以高血压是否伴ED 为因变量(是=1,否=0),年龄、收缩压、舒张压、eGFR、TC、TG、LDL-C、HDLC、BMI、糖尿病(是=1,否=0)、吸烟(是=1,否=0)及UA为自变量,进行多元Logistic回归分析,结果显示UA、舒张压、BMI 及LDL-C 升高为高血压患者发生ED的独立危险因素,见表4。
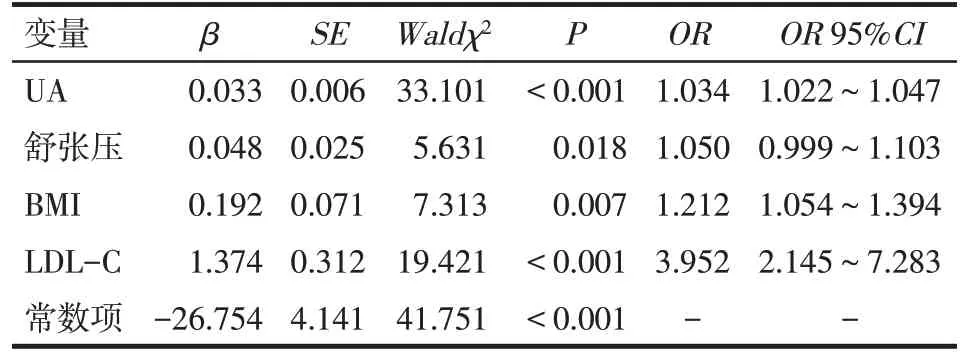
Tab.4 Multivariate Logistic regression analysis of hypertensive patients with ED表4 高血压伴ED的多元Logistc回归分析结果
2.6 ROC 分析 ROC 分析结果显示,血清 UA 预测高血压伴 ED 的 ROC 曲线下面积为 0.785(95%CI:0.717~0.852,P<0.01),见 图 1。 以 血 清 UA 384.5 μmol/L作为预测ED最佳阈值时,敏感度90%,特异度69%,阳性预测值74.8%,阴性预测值87.3%。
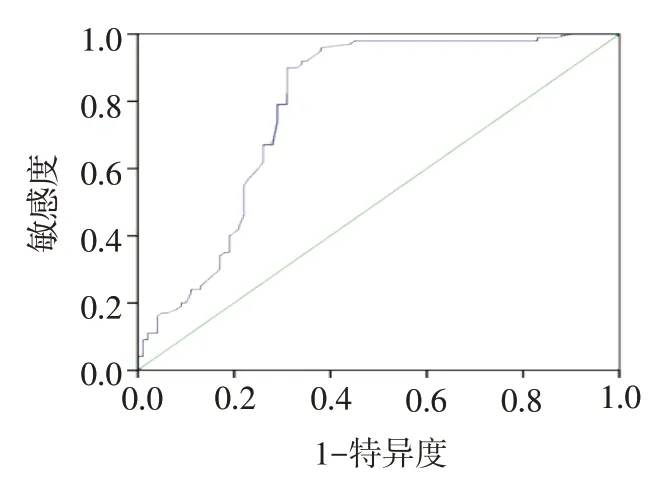
Fig.1 ROC curves of uric acid for predicting ED in hypertensive patents图1 血清UA预测高血压病ED患者的ROC曲线
3 讨论
高血压与ED的关系,已经获得较为广泛的研究证实[1-2,8]。血管内皮功能失调及动脉粥样硬化是ED主要的发病机制[9-10],某些降压药物也增加ED发生。阴茎海绵体是一种网状结构的动脉血管平滑肌,其内衬以内皮细胞层,其外包被坚韧的纤维白膜。阴茎海绵体血管窦与动脉血管联通。非肾上腺素非胆碱能神经兴奋时促使内皮细胞释放NO,NO经弥散与鸟苷酸环化酶中的铁离子结合,引起环化酶构象改变,细胞内cGMP增多,加速蛋白磷酸化过程,发挥NO 的平滑肌松弛作用,血液迅速充盈到阴茎海绵体内,阴茎勃起;同时纤维白膜压迫静脉血管,阻止血液回流,维持勃起状态,因此,NO 是阴茎勃起的关键介质[9]。高血压患者血管内皮功能紊乱,NO减少或NO利用率降低是高血压发生ED的病理基础。UA是食物中核酸、嘌呤在体内各种酶的作用下生成次黄嘌呤和黄嘌呤,在黄嘌呤氧化酶作用下产生的代谢产物。本文入选首次诊断高血压患者,排除降压药物影响,高血压合并ED 患者UA 水平增高,随ED 程度而增加;NO、eNOS 随ED 程度加重而降低,UA与NO、eNOS负相关,校正年龄、吸烟、糖尿病、BMI、血脂、eGFR、血压后,UA仍为高血压发生ED 的影响因素;随UA 水平增高,血管内皮损伤加重,内皮eNOS 减少致NO 不足,高血压患者发生ED 风险增高,其机制可能为UA 水平增高通过降低eNOS与钙调蛋白结合,减低eNOS活性,降低精氨酸向NO 转化速率,减少NO 生成,导致内皮功能障碍[11];高 UA 还可导致线粒体内 Ca2+超负荷,升高O2-,并通过miR-155下调eNOS蛋白表达,引起内皮功能障碍[12]。高尿酸血症患者体内氧化应激反应增强,氧自由基与NO 反应增强,NO 消耗增多导致NO含量下降[13]。UA 水平增高直接抑制阴茎海绵体平滑肌舒张功能,血管内皮源性舒张因子(EDRF)/NO与血管内皮素(ET)平衡失调,阴茎海绵体血管平滑肌细胞收缩不同步;高尿酸血症上调RhoA/Rho激酶活性,经Ca2+敏感性途径导致阴茎血管平滑肌收缩增强,海绵体储血障碍[14];高尿酸血症刺激炎性介质的生成,损伤血管内皮,促进血管内皮功能异常,导致ED。
EMP是激活或凋亡的内皮细胞释放出来的微小囊泡,携带有母体细胞的mRNA、受体、特殊蛋白质等物质。在内皮损伤时,EMP释放明显增加。目前,EMP 已被作为反映内皮损伤的指标[15]。EMP 既是内皮损伤的生物学标志物,同时,作为多种物质的载体具有生物活性,可通过使eNOS抑制位点磷酸化增加,eNOS解偶联,使其从产生NO的酶变为产生超氧化物的 NADPH 氧化酶,NO 生成减少,NOOO-、O2-和H2O2产生增加[6,16],血液 EMP 增高刺激内皮细胞表达炎症因子mRNA 及发生氧化应激反应,加重内皮功能障碍。本文结果显示男性高血压患者UA 水平与EMP 呈正相关,多元逐步回归分析显示UA 是EMP 的影响因素,提示高尿酸血症可能通过损伤血管内皮,导致内皮释放EMP 增加,引起男性高血压ED 的发生。UA 增高刺激体内内毒素生成,进而刺激产生肿瘤坏死因子-α(TNF-α)并激活其活性,TNF-α 的炎症作用严重损伤血管内皮细胞,加速内皮细胞凋亡,此外,血液UA 水平增高刺激血管紧张素Ⅱ(AngⅡ)活性增加[11],使血管内皮结构变异,促进内皮细胞调亡,使血管内皮减少,内皮修复障碍,致炎细胞因子及AngⅡ活性增加是内皮细胞凋亡释放EMP的主要诱发因素。
综上所述,男性高血压UA 水平增高,通过炎症及氧化应激机制,产生血管内皮功能障碍,EMP释放增加,eNOS 减少,NO 生成减少,导致血管内皮依赖的舒张功能障碍,促使男性高血压患者发生ED。
