低谷蛋白大米对Beagle犬血糖生成指数的影响
2020-09-21周少文汪少芸
陈 旭,陈 选,杨 炯,周少文,汪少芸
(1.福州大学石油化工学院,福建 福州 350108;2.福州大学生物科学与工程学院,福建 福州 350108;3.福州东泽健康食品有限公司,福建 福州 350002)
中国超过1 亿的糖尿病患者由于传统淀粉性主食习惯的原因,餐后常会出现较大幅度血糖波动[1-2]。为控制血糖,除药物治疗外,很多糖尿病患者选择粗杂粮和代餐食物作为长期主食,虽然对平稳餐后血糖有所帮助,但是粗杂粮、代餐食物会降低饮食口感,长期食用粗杂食物可能造成营养不良甚至肠胃疾病,从而影响糖尿病患者的生活质量[3-5]。
稻米是人类主食之一,全球超过一半人口以大米为主食[6-7],在水分相对含量14%的稻米中,淀粉相对含量为70%~80%、蛋白相对含量为8%~10%[8]、脂肪相对含量1%~2%[9]、膳食纤维相对含量2%~5%[10],其余为维生素[11]、灰分和矿物质等[12-13]。稻米中易被人体消化吸收的贮藏蛋白可提供人体所需的必需氨基酸,稻米贮藏蛋白主要由谷蛋白、醇溶蛋白和球蛋白构成,其中谷蛋白含量最高,约占大米总蛋白干质量的80%左右[14-16],其富含赖氨酸,且易被人体消化吸收;而醇溶蛋白因其结构致密,很难被人体消化吸收。另一方面,我国现有慢性肾脏病患者1.2亿,尿毒症患者150多万,每年还在以12~15万新增尿毒症患者的趋势增加。虽然提高谷蛋白含量有助于提高稻米的营养价值,但是对肾脏机能障碍或糖尿病患者来说,大米中谷蛋白的大量吸收可能导致病情恶化,该类患者不宜食用可溶性蛋白质量分数超过4%的大米[17-20]。因此,为满足肾脏病人及糖尿病人对低含量可吸收蛋白食品的特定需求,研制低谷蛋白大米已成为当前肾脏病患者和糖尿病人食用的特殊食品的一个重要方向。
本实验供试品W0868低谷蛋白大米是中国工程院院士万建民教授带领研究团队,从20世纪90年代后期开始研究,历经20 年,从10万 株水稻品种中选育获得的特殊营养功能大米品种[21]。与普通大米相比,低谷蛋白大米的显著区别是其可溶性谷蛋白质量分数低于4%,碳水化合物的消化吸收速率相对更低,可作为糖尿病和肾病患者的主食或食疗辅助食品[22-23]。但是缺少关于大米中低谷蛋白含量与碳水化合物消化吸收速率关系的研究,因此,本实验通过评价健康成年Beagle犬摄食W0868低谷蛋白大米和普通大米的相对血糖生成指数和胰岛素水平,以及对比和定量评价W0868低谷蛋白大米对餐后血糖的影响,为低谷蛋白大米的应用及后续实验提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
Beagle犬,实验动物使用许可证号:SYXK(川)2018-123,购自成都华西海圻医药科技有限公司。实验期内,实验动物选用体质量约6~10 kg的健康成年Beagle犬[24]。选用的Beagle犬健康状况良好,自主活动正常,皮肤被毛清洁,粪尿均未见明显异常反应,也未见与W0868低谷蛋白大米相关的其他毒性反应。
W0868低谷蛋白大米 福州东泽健康食品有限公司;犬维持饲料 北京科澳协力饲料有限公司;五常大米(空白大米) 中粮国际(北京)有限公司;胰岛素酶联免疫吸附检测试剂盒 北京尚柏生物医学技术有限公司;一水合葡萄糖 成都市科龙化工试剂厂。
1.2 仪器与设备
Cobas 6000 c501/Cobas c311全自动生化分析仪 瑞士罗氏公司;Molecular Image®ChemiDOCTMXRS+凝胶成像仪 美国Bio-Rad公司;KDN-102C凯氏定氮仪上海纤检仪器有限公司;AG246电子天平 瑞士Mettler Toledo公司;Fresco17高速冷冻离心机 美国Thermo Fisher公司;DB2双层不锈钢冲洗式犬笼(800 mm×1 000 mm×2 060 mm) 苏州市苏杭科技器材有限公司;EBI全新风中央空调自动控制系统美国Honeywell公司。
1.3 方法
1.3.1 W0868低谷蛋白大米中总蛋白及谷蛋白质量分数测定
总蛋白及谷蛋白质量分数测定:随机抽样,分单粒提取种子全蛋白。提取样品总蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE);蛋白凝胶采用Molecular Image®ChemiDOCTMXRS+凝胶成像仪成像;分析各泳道条带,并对各条带蛋白量进行定量,计算谷蛋白占总蛋白的比例,重复取平均值;利用凯氏定氮法测定稻米的总蛋白质量分数,根据谷蛋白占总蛋白的比例确定谷蛋白质量分数[25]。
1.3.2 动物分组
动物分组参照苏小建等[26]的方法,具体采用PRISTIMA 7.2.0版数据系统根据Beagle犬体质量分性别随机分成1组和2组;每组4 只,其中雌雄各2 只;具体分组信息见表1。
表 1 实验动物分组情况Table 1 Grouping of experimental animals
1.3.3 饲料配制
一水合葡萄糖:称取定量葡萄糖并加蒸馏水溶解,配制成浓度为0.2 g/mL的葡萄糖溶液。
五常大米(空白大米)米浆:将大米按质量比1∶1.7加水,混匀,不用洗米,不用延长时间浸泡,将加水的大米放入电饭煲中,煮成后焖10 min断电,待米饭冷却至室温后,将米饭加入少量灭菌注射用水匀浆,再加灭菌注射用水定容至终体积。
W0868低谷蛋白大米米浆:将W0868低谷蛋白大米按质量比1∶1.3加水,混匀,不用洗米,不用延长时间浸泡,将加水的大米放入电饭煲中,煮成后立即断电,待米饭冷却至室温后,将米饭加入少量灭菌注射用水匀浆,再加灭菌注射用水定容至终体积。
1.3.4 剂量设计
根据前期实验,米浆中米饭最大质量浓度为0.3 g/mL,按每只犬8 g葡萄糖给药,第一阶段葡萄糖组每只犬给予40 mL质量浓度为0.2 g/mL的葡萄糖溶液;W0868组和五常大米组将米饭做成米浆,给予相当于8 g葡萄糖量的米浆。具体剂量设计如表2所示。
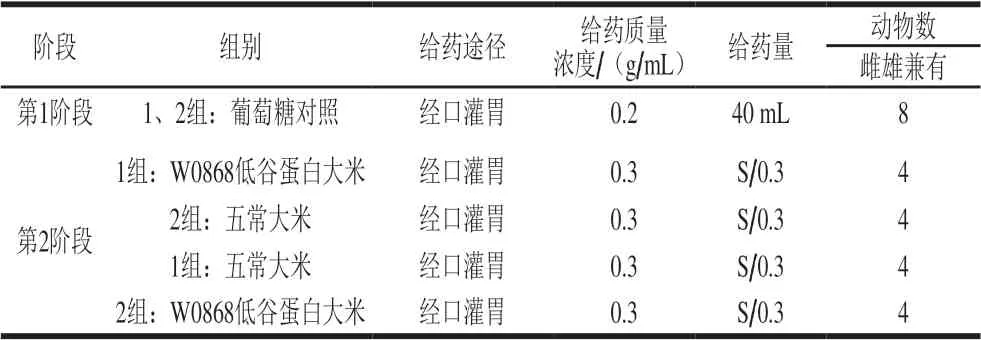
表 2 动物实验剂量设计Table 2 Doses used for animal experiments
1.3.5 给药设计
分两个阶段经口喂食给药:第1阶段给予葡萄糖按照剂量为8 g葡萄糖每只犬喂食,以确定实验动物糖耐量正常;第2阶段,给予对照食物五常大米(R2)和W0868低谷蛋白大米(T),给予剂量相当于每只犬8 g葡萄糖当量的米饭喂食,具体给药频率及周期情况见表3。
表 3 动物给药周期及频率Table 3 Time and frequency of animal administration
1.3.6 血浆葡萄糖浓度测定
血样采集:每次给药前(15±2)、(5±2)min及给药后(1 0±2)、(2 0±2)、(3 0±2)、(40±2)、(50±2)、(60±2)、(90±2)、(120±2)、(150±2)、(180±2)min进行定点血样采集,具体血样采集方法参照刘建高等[27]的方法。
血样检测:使用乙二胺四乙酸抗凝剂静脉血3 mL,血液样本离心前于冰盒中放置,于4 ℃、1 800×g离心10 min,通过全自动生化分析仪检测血浆葡萄糖浓度。
1.3.7 胰岛素浓度测定
使用酶联免疫吸附检测试剂盒测定血清胰岛素浓度[28]。
1.4 数据统计与分析
参考Wolever[29]的方法计算血浆葡萄糖浓度-时间曲线下面积(AUC0~180min)和零点校正后的AUC0~180min,血浆葡萄糖达峰浓度(cmax)和零点校正后的cmax。AUC0~180min和cmax经对数转换后进行方差分析,方差分析模型中顺序、食物、周期作为固定效应,动物个体作为随机效应。分别计算AUC0~180min和cmax的几何平均值比率(受试食物/对照食物)的90%置信区间,同时进行双单侧t-检验分析以及等效性评价。同时计算受试食物和对照食物AUC0~180min和cmax的个体内变异系数和个体间变异系数。
2 结果与分析
2.1 W0868低谷蛋白大米中蛋白质量分数
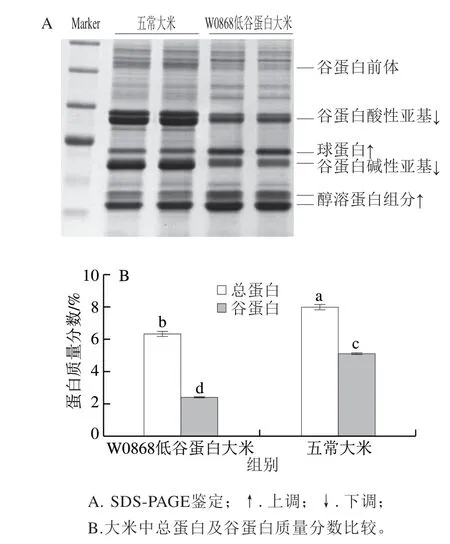
图 1 W0868低谷蛋白大米蛋白质量分数Fig. 1 Protein content of low gluten rice
通过SDS-PAGE验证W0868低谷蛋白大米种子是否具有低谷蛋白特征性谱带,其结果见图1,可以看出W0868中谷蛋白质量分数显著低于五常大米,球蛋白和醇溶蛋白组分显著增加。W0868低谷蛋白大米中总蛋白和谷蛋白质量分数均低于五常大米,且W0868低谷蛋白大米中谷蛋白占大米中总蛋白的32%,远低于五常大米中谷蛋白占大米总蛋白的80%。W0868低谷蛋白大米与五常大米相比可溶性谷蛋白质量分数降低60%以上,醇溶蛋白质量分数升高超过100%,且其蛋白质分布也有明显不同。
2.2 葡萄糖耐量实验结果
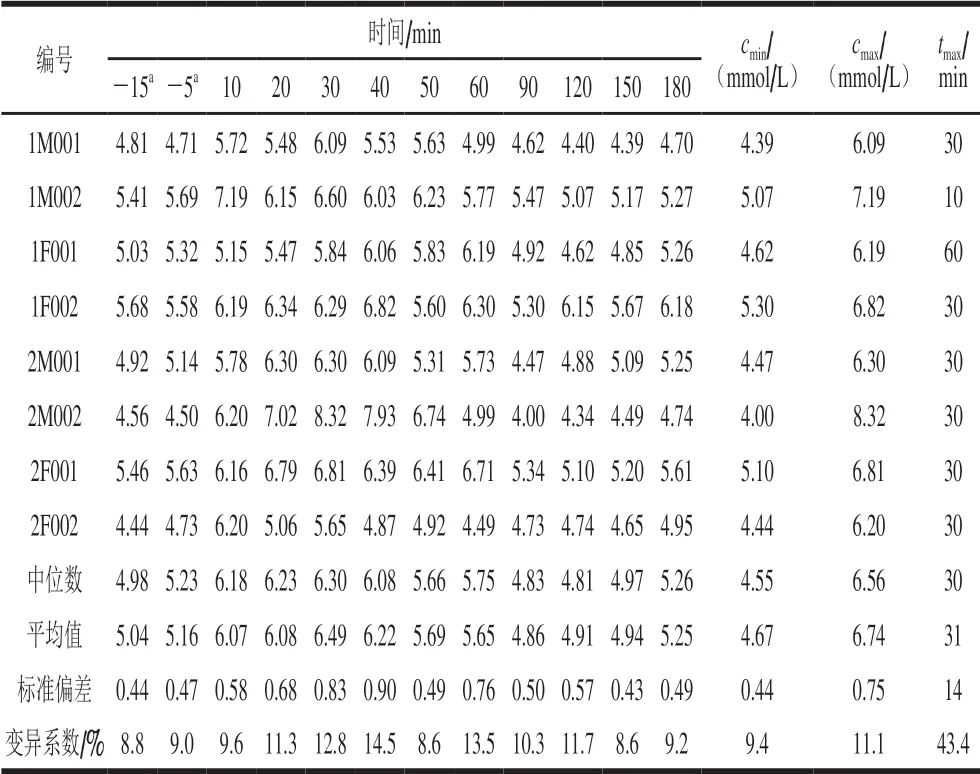
表 4 Beagle犬单次给予8 g葡萄糖后血浆葡萄糖浓度变化Table 4 Changes in plasma glucose concentrations in Beagle dogs after single administration of 8 g of glucose
8 只Beagle犬单次灌胃给予8 g葡萄糖,给药前和给药后180 min内的血浆葡萄糖浓度数据见表4,平均血浆葡萄糖浓度随时间变化曲线见图2。结果显示,8 只Beagle犬给予葡萄糖前后-15~180 min内的血浆葡萄糖峰浓度(cmax)为(6.74±0.75)mmol/L,谷浓度(cmin)为(4.67±0.44)mmol/L,达峰时间(tmax)为(31±14)min,符合正常Beagle犬葡萄糖耐量后的血糖代谢特征[30];各时间点血浆葡萄糖浓度水平的变异系数小于15%,表明本研究纳入的8 只实验犬具有正常一致的糖代谢基础水平。
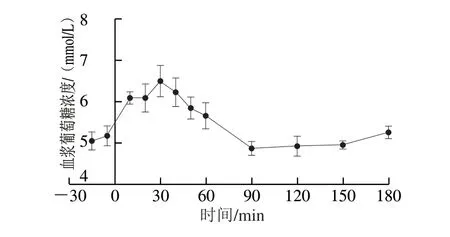
图 2 Beagle犬给予8 g葡萄糖后的血浆葡萄糖浓度随时间变化曲线Fig. 2 Time-course curve of plasma glucose concentration in Beagle dogs after administration of 8 g of glucose
2.3 W0868低谷蛋白大米和五常大米的相对血糖生成指数
2.3.1 血浆葡萄糖浓度变化
采用双交叉试验设计,将8 只Beagle犬随机等分为2 组,在2 个连续的实验周期先后单次给予等量碳水化合物的W0868低谷蛋白大米(T)和五常大米(R2),干预前和干预后180 min内的平均血浆葡萄糖浓度经时变化曲线见图3,每只Beagle犬在两个实验周期分别给予W0868低谷蛋白大米和五常大米后的血浆葡萄糖浓度经时变化曲线见图4。8 只Beagle犬在两个周期分别喂食W0868低谷蛋白大米和五常大米后,与五常大米相比W0868低谷蛋白大米血浆葡萄糖浓度的达峰时间、0~90、0~120、0~150 min和0~180 min血浆葡萄糖浓度曲线下面积均显著降低。
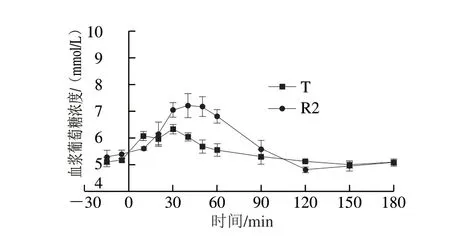
图 3 Beagle犬单次给予T和R2后的平均血浆葡萄糖浓度随时间变化曲线Fig. 3 Time-course curve of average plasma glucose concentration in Beagle dogs after single administration of WB0868 or control diet
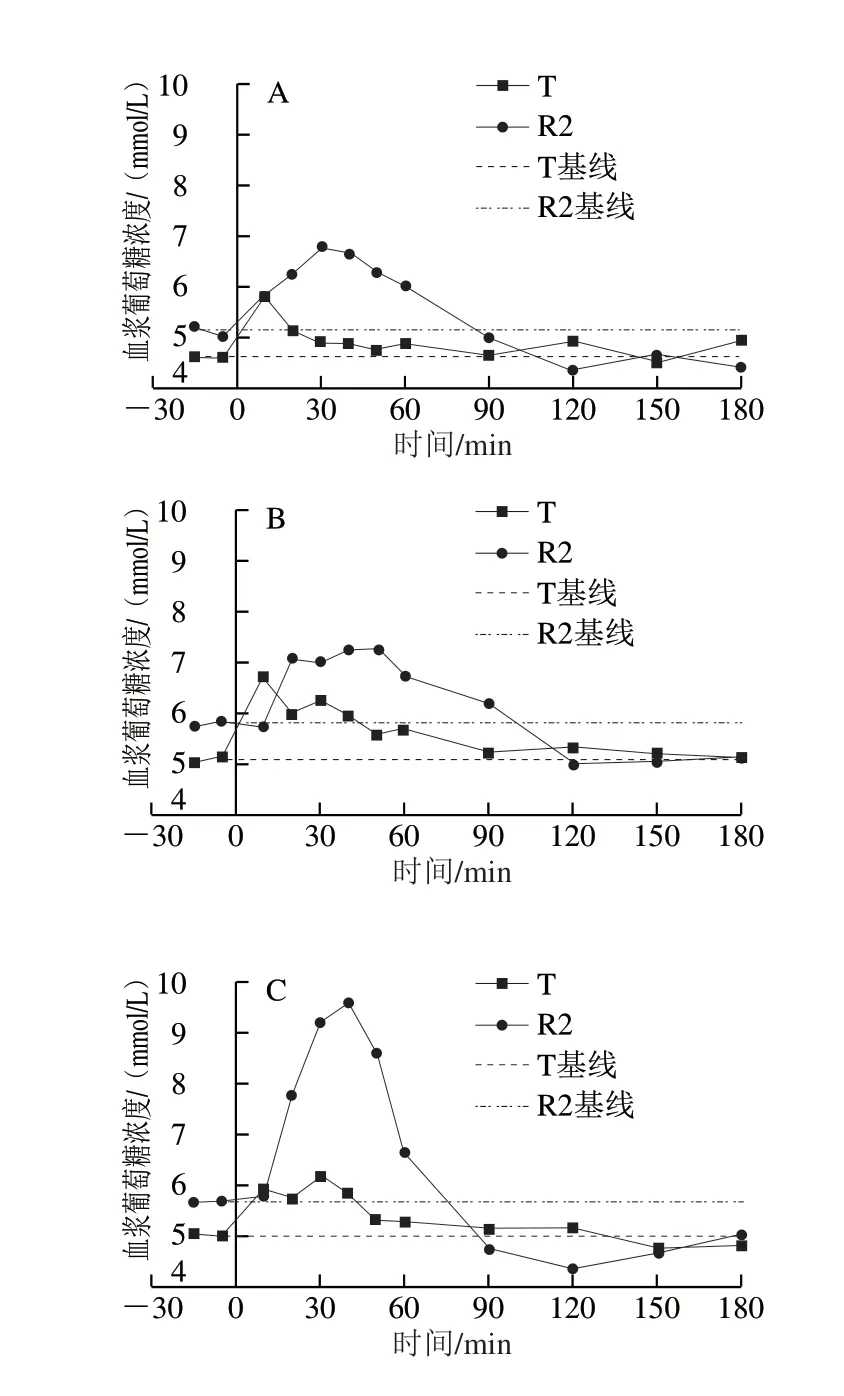
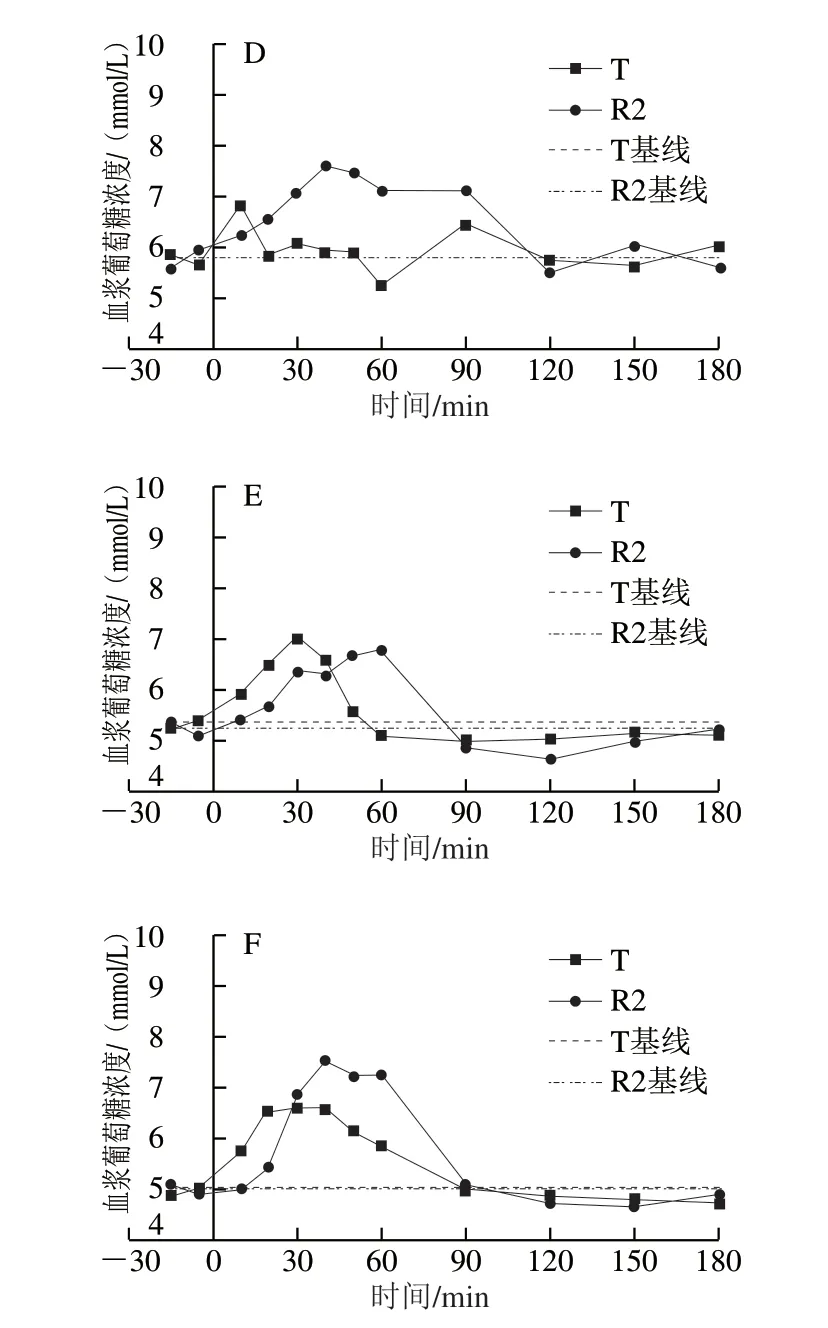
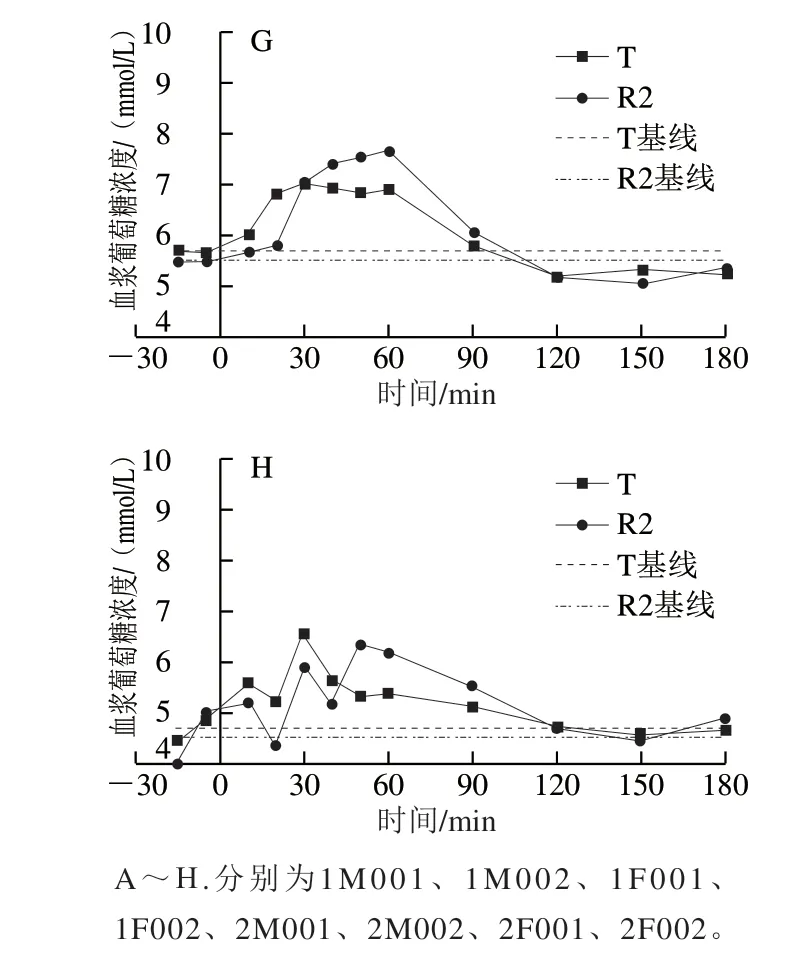
图 4 每只Beagle犬在两个实验周期分别给予T和R2后的血浆葡萄糖浓度随时间变化曲线Fig. 4 Time-course curves of plasma glucose concentration in Beagle dogs after administration of WB0868 or control diet during two test periods
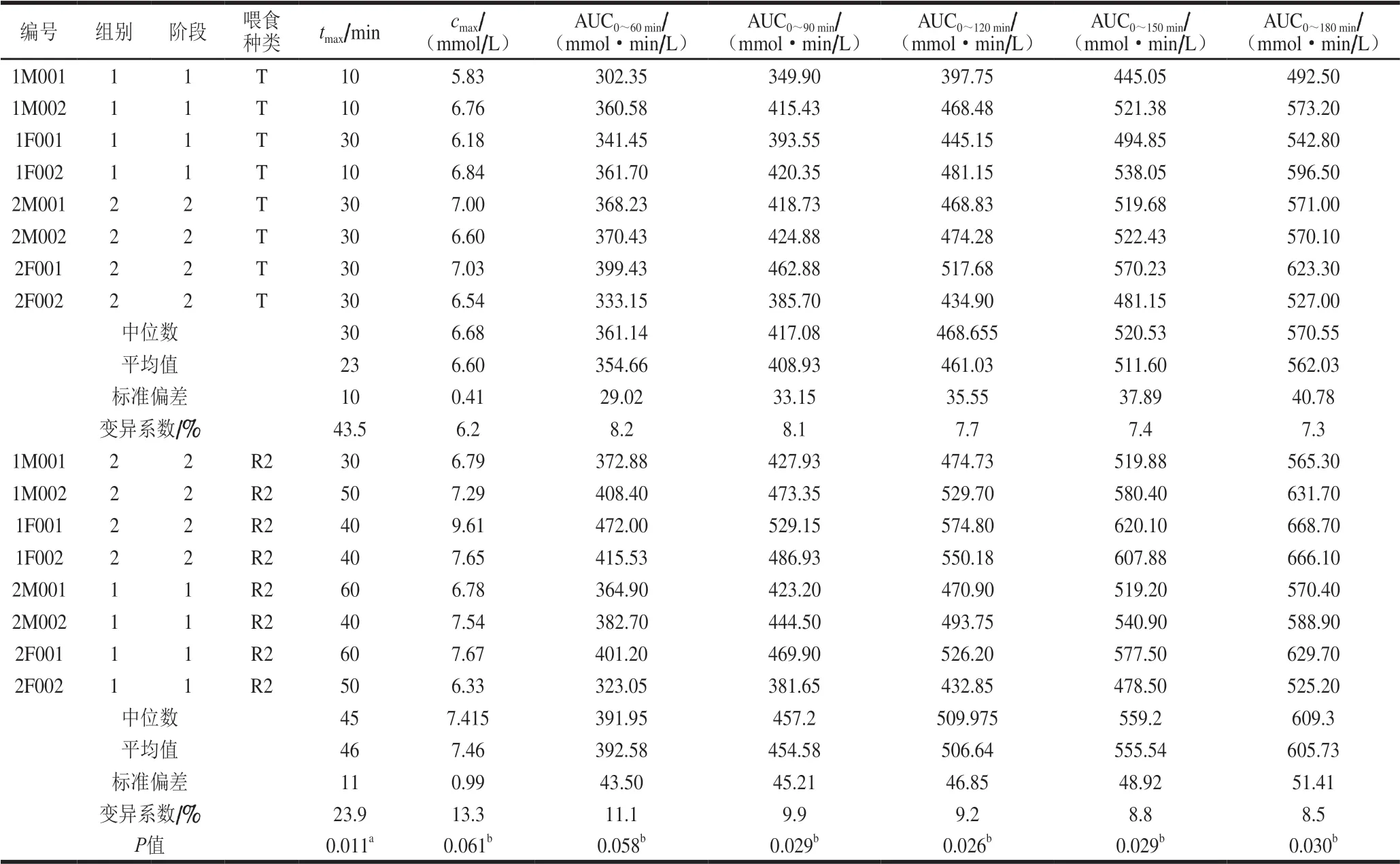
表 5 Beagle犬单次给予W0868低谷蛋白大米和五常大米后主要血浆葡萄糖参数及其统计分析结果Table 5 Statistical analysis of main plasma glucose parameters in Beagle dogs after single administration of WB0868 or control diet
2.3.2 餐后血浆葡萄糖升高程度
根据非房室模型计算各只Beagle犬单次给予W0868低谷蛋白大米和五常大米后的血浆葡萄糖升高速率和程度的参数,包括tmax、cmax、AUC0~60min、AUC0~90min、AUC0~120min、AUC0~150min、AUC0~180min;tmax经Wilcoxon秩和检验,cmax、AUC0~60min、AUC0~90min、AUC0~120min、AUC0~150min和AUC0~180min经自然对数转换后进行配对t检验,数据及其统计分析结果见表5。
统计分析结果表明,与五常大米相比,8 只Beagle犬经W0868低谷蛋白大米干预后血浆葡萄糖浓度的tmax、AUC0~90min、AUC0~120min、AUC0~150min、和AUC0~180min均显著降低,差异具有统计学意义(P<0.05);cmax和AUC0~60min存在一定的差异,但无统计学意义(P>0.05)。
2.3.3 基线校正血浆葡萄糖浓度数据及血糖生成指数
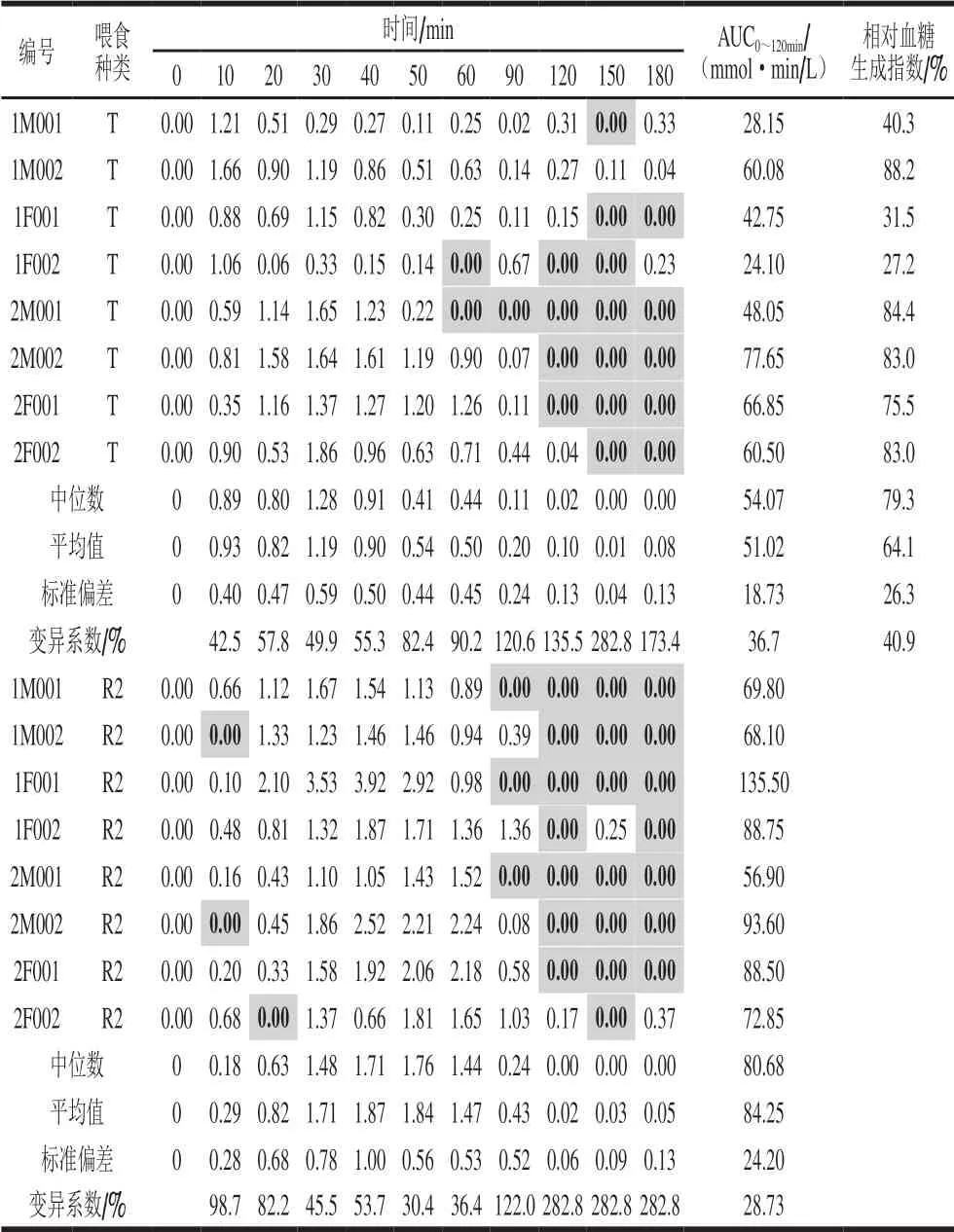
表 6 Beagle犬单次给予T和R2后的基线校正血浆葡萄糖浓度数据及相对血糖生成指数Table 6 Baseline corrected plasma glucose concentration data and relative glycemic index in Beagle dogs after single administration of WB0868 or control diet
以干预前5 min和15 min的平均血浆葡萄糖浓度作为基线值,以干预后的血浆葡萄糖浓度减去基线值,分别对每条血糖曲线进行基线校正,负值计为0。8 只Beagle犬单次给予W0868低谷蛋白大米和五常大米后基线校正的血浆葡萄糖浓度数据见表6。根据校正后的血浆葡萄糖浓度数据计算0~120 min血浆葡萄糖曲线下面积AUC0~120min,分别以每只Beagle犬给予W0868低谷蛋白大米后的基线校正后的AUC0~120min除以给予五常大米组后的基线校正后的AUC0~120min,计算W0868低谷蛋白大米和五常大米的相对血糖生成指数,结果见表6。8 只Beagle犬单次给与W0868低谷蛋白大米后AUC0~120min均显著低于给与五常大米组的Beagle犬,且相对血糖生成指数显著降低。
2.3.4 相对血糖生成指数统计分析结果
将基线校正后的AUC0~120min经对数转换后计算几何平均值比率(W0868低谷蛋白大米/五常大米)的90%置信区间,同时进行双单侧t-检验分析,统计分析结果见表7。按照血糖生成指数的定义,采用基线校正后的0~120 min血浆葡萄糖曲线下面积,计算W0868低谷蛋白大米和五常大米相比的相对血糖生成指数的几何平均值为59.33%,90%置信区间为42.56%~82.72%。因此可以认为,以相同标准单次定量喂食Beagle犬,W0868低谷蛋白大米升高Beagle犬血糖的速率和程度比五常大米低40.67%。

表 7 基线校正后AUC0~120min的相对血糖生成指数统计分析结果(n=8)Table 7 Statistical analysis of relative glycemic index calculated from baseline corrected AUC0-120min (n= 8)
2.4 W0868低谷蛋白大米对餐后Beagle犬胰岛素分泌情况
采用双交叉试验设计,8 只Beagle犬随机等分为两组,在两个连续的实验周期先后单次给予等量碳水化合物的W0868低谷蛋白大米和五常大米,干预前5 min和干预后30、60、90 min的血清胰岛素浓度数据,平均血清胰岛素浓度随时间变化曲线见图5。统计分析结果表明,与对照大米相比,Beagle犬喂食W0868低谷蛋白大米后30 min和60 min的血清胰岛素浓度存在一定降低的现象,该现象与血糖生成指数实验结果一致;由于存在个体差异且样本数较小,两组血清胰岛素浓度的差异尚未达到统计学意义(P=0.09)。
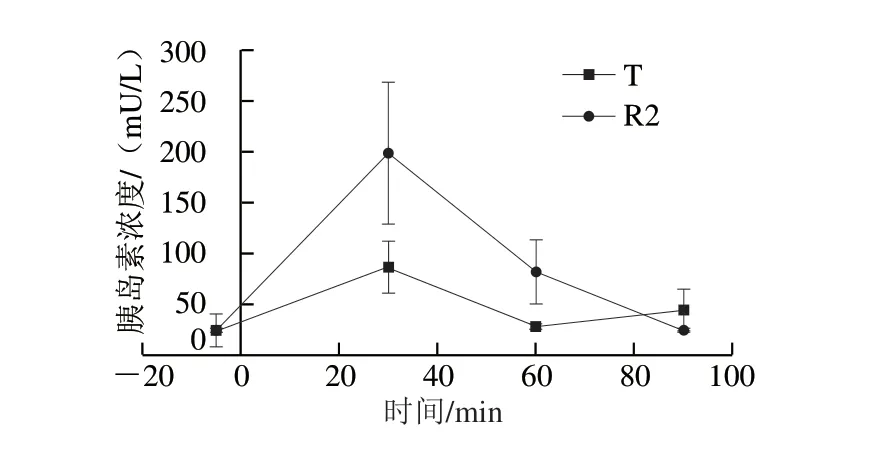
图 5 Beagle犬单次给予T和R2后的平均血清胰岛素浓度随时间变化曲线Fig. 5 Time-course curves of mean serum insulin concentrations in Beagle dogs after single administration of WB0868 or control diet
3 结 论
以相同标准单次定量喂食时,与W0868低谷蛋白大米相比,对照食物五常大米在30~60 min具有更高的升糖效应,同时在约90 min后出现血浆葡萄糖浓度低于基线值的情况;血清胰岛素检测结果证实,对照食物五常大米干预后30 min和60 min的血清胰岛素浓度在一定程度上高于W0868低谷蛋白大米,该现象与血糖生成指数实验结果完全一致。根据本实验结果可以认为,以相同标准单次定量喂食,W0868低谷蛋白大米升高Beagle犬血糖的速率和程度比对照食物五常大米低40.67%,并在一定程度上降低了Beagle犬的代偿性胰岛素分泌。因此可以推测,与对照食物五常大米相比,W0868低谷蛋白大米可能在一定程度上具有减缓胰岛素抵抗进展的作用,该作用或存在对2型糖尿病人的临床意义。
