细叶小檗果小檗碱抑菌性能及机理
2020-09-21包怡红张俊顺张海婷
包怡红,张俊顺,符 群,张海婷
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.黑龙江省森林食品资源利用重点实验室,黑龙江 哈尔滨 150040)
细叶小檗(Berberis poiretii)为小檗科小檗属浆果,别名针雀、三颗针等。小檗属是小檗科中大属之一,植物多为常绿或落叶灌木,很少为乔木。本属约有植物500余种,主要分布于亚洲东部、中部以及拉丁美洲,少数分布于欧洲、北美洲和非洲北部。我国小檗属植物资源丰富,有250余种,约占世界的一半,全国各地均有分布,主要分布在西南、西北地区[1]。小檗属果实主要含有甾醇、萜类化合物、花青素、酚酸类化合物,还有生物碱、有机酸、微量元素等物质[2]。细叶小檗含有的生物碱有小檗碱、小檗胺、巴马汀、哥伦胺和苦参碱[3-4],其中小檗碱含量高并且具有较强的生物活性[5-6],如消炎、抗氧化、抗肿瘤、降血糖、降血压、保护心血管和神经系统等[7-11]。
近年来,随着对小檗碱活性成分及药理作用的研究深入,细叶小檗在临床方面获得广泛的应用,传统和现代研究大多集中在小檗属植物的根、茎以及茎皮部位,然而该属果实在研究利用方面有着巨大开发潜力[12],刘萍[13]、徐媛[14]、符群[15]等对细叶小檗果实中小檗碱的提取工艺与抑菌活性进行研究,但对其抑菌机理的研究很少,基于此,本实验将对小檗碱在抑菌机理方面进行补充。
如今,食源性病菌引起的食物污染严重威胁着人们的健康,食品腐败变质现象普遍存在,因此抑制食源性腐败菌的生长以延长食品货架期变得尤为重要,本实验主要研究了细叶小檗果实中的小檗碱对食品中常见的枯草芽孢杆菌、大肠杆菌、沙门氏菌和金黄色葡萄球菌4 种供试菌的抑菌活性,并对抑菌机理进行了初步的探究,为其在天然食品防腐剂中的开发应用提供理论依据。
1 材料与方法
1.1 材料、菌株与试剂
细叶小檗果实采于黑龙江省鹤岗市。
供试菌:大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、沙门氏菌(Salmonella)和金黄色葡萄球菌(Staphylococcus aureus)均由东北林业大学微生物实验室提供。
Y 3 1 J 9 H 6 7 0 2 4 小檗碱标准品(纯度>9 8%)上海源叶生物科技有限公司;牛肉膏、蛋白胨、MH(B)培养基、琼脂粉 北京奥博星生物技术有限责任公司;乙醇、氢氧化钠、氯化钠、戊二醛、叔丁醇、丙烯酰胺、十二烷基硫酸钠、过硫酸铵、四甲基乙二胺、巯基乙醇、溴酚蓝、甘油、甘氨酸(均为分析纯)天津市恒兴化学试剂制造有限公司。
1.2 仪器与设备
KQ-300DE型数控超声波清洗器 昆山市超声仪器有限公司;FW100高速万能粉碎机 天津市泰斯特仪器有限公司;HZQ-F恒温振荡培养箱 哈尔滨市东联电子技术开发有限公司;FD-1A-80冷冻干燥机上海比朗仪器有限公司;BCD-215KS冰箱 青岛海尔股份有限公司;TGL-16G台式离心机 上海安亭科学仪器厂;DDS-307电导率仪 上海精密科学仪器有限公司;Spetramax 2e全波长酶标仪 美国伯腾仪器有限公司;UV-5500紫外-可见分光光度计 上海元析仪器有限公司。
1.3 方法
1.3.1 小檗碱含量测定标准曲线的绘制
取5 mg小檗碱标准品,用无水乙醇溶解并定容于50 mL的容量瓶中。准确吸取1、2、3、4、5 mL于50 mL容量瓶中,无水乙醇定容。在345 nm波长处测量吸光度[16],以小檗碱标准溶液的质量浓度(mg/mL)为横坐标,吸光度为纵坐标,得到标准曲线方程:y=0.032 7x+0.126 1(R2=0.999 6)。
1.3.2 小檗碱的提取
将细叶小檗的果实在烘箱中干燥至恒质量,用高速粉碎机粉碎,过100 目筛,得到细叶小檗果实粉末,称取10 g粉末,按照液料比32∶1加入体积分数27%的乙醇溶液,分装至烧杯中,调节pH值依次为2.2、7.6和8.5,在功率为300 W的超声波中分别提取50、25 min和25 min,而后抽滤得到小檗碱提取液,将小檗碱提取液在旋转蒸发仪中蒸发浓缩,在345 nm波长处测定浓缩后提取液的吸光度,代入标准曲线计算小檗碱的质量浓度。
1.3.3 抑菌性能的测定
1.3.3.1 抑菌活性的测定
采用滤纸片法测定小檗碱对4 种细菌的抑菌活性,参照樊梓鸾等[17]的方法,用打孔器制得直径为6 mm的滤纸片,高温灭菌备用。在无菌条件下,将培养基倒入无菌平板,冷却凝固,取100 μL菌悬液于培养基上涂布均匀,取4 片灭菌后的滤纸片(直径6 mm)置于含菌平板上,其中3 片滴加10 μL质量浓度为4.10 mg/mL的小檗碱,另外一片以10 μL无菌水作为对照,细菌置于37 ℃培养箱中培养12 h,用交叉法测得抑菌圈的直径大小。
1.3.3.2 最低抑菌浓度的测定
试管灭菌、编号,用二倍稀释法将提取液稀释,配制8 个梯度浓度,小檗碱的质量浓度分别为0.039、0.078、0.156、0.313、0.625、1.250、2.500、5.000 mg/mL,分别编号为1~8。96 孔板灭菌后,向每个孔内滴加20 μL(107CFU/mL)菌液,90 μL液体培养基,90 μL不同梯度浓度的提取液。以无菌水为对照,37 ℃培养12 h,每孔取100 μL涂布平板,培养12 h,观察4 种细菌的生长情况,以第一个出现单菌落平板的样品浓度为最低抑菌浓度(minimum inhibitory concentration,MIC)[18]。
1.3.4 生长曲线的测定
参考Liu Guorong等[19]的方法并略作修改。将枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌和沙门氏菌的浓度稀释为1×107CFU/mL后,加入质量浓度为一倍MIC(1 MIC)的小檗碱,对照组不加入小檗碱,向96 孔板中加入20 μL 4 种供试菌悬液,放置于37 ℃、200 r/min的恒温振荡培养箱,培养期间每隔2 h取样,用酶标仪在660 nm波长处测定吸光度。
1.3.5 抑菌机理分析
1.3.5.1 菌体形态的观察
将金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌和沙门氏菌接种于液体培养基中,37 ℃恒温振荡培养至对数生长期,并稀释菌液为107CFU/mL。各取3 mL菌液加入1 MIC小檗碱,对照组不加入小檗碱,在37 ℃、200 r/min摇床中培养4 h后,5 000 r/min、15 min离心收集菌体,磷酸盐缓冲溶液(pH 7.0,下同)清洗3 次,加入戊二醛溶液,于4 ℃环境下放置4 h进行固定。依次使用体积分数为30%、50%、70%、90%的乙醇溶液和无水乙醇进行脱水。-40 ℃下真空冷冻干燥24 h后,离子喷金,随后进行扫描电子显微镜观察[20]。
1.3.5.2 电导率的测定
将供试菌种接种于灭菌的液体培养基中,37 ℃恒温振荡培养至对数生长期(107CFU/mL),5 000 r/min离心15 min,收集菌体,用磷酸盐缓冲液清洗3 次,离心,重悬于磷酸盐缓冲液中,加入各菌种1 MIC的小檗碱,对照组用磷酸盐缓冲溶液进行校正,放于37 ℃摇床中培养6 h,每隔1 h取出测电导率[21]。
1.3.5.3 核酸含量的测定
分别将供试菌种接种至100 mL的液体培养基中培养至对数生长期,取10 mL菌液,5 000 r/min离心15 min收集菌体,磷酸盐缓冲溶液冲洗3 次,重新定容至10 mL,加入1 MIC的小檗碱,37 ℃恒温摇床培养3 h。3 h后取3 mL样品溶液于离心管中,5 000 r/min离心5 min,取其上清液在260 nm波长处测定吸光度[22],对照组用磷酸缓冲溶液进行校正。
1.3.5.4 小檗碱对细菌蛋白质合成的影响
将1 M I C 的小檗碱加入到培养至对数生长期(107CFU/mL)的4 种供试菌的菌悬液中,对照组用磷酸缓冲溶液进行校正,37 ℃恒温振荡培养12 h,5 000 r/min离心15 min,弃去上清液,用磷酸盐缓冲溶液清洗3 次,加入20 μL上样缓冲溶液,沸水浴5 min,离心取上清液,根据电泳样品制备步骤进行聚丙烯酰胺凝胶电泳[23]。
1.3.5.5 细胞膜Na+/K+-ATP酶活力的测定
将金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌和沙门氏菌接种于灭菌的液体培养基中,37 ℃恒温振荡培养至对数生长期(107CFU/mL),离心,弃上清液,用磷酸盐缓冲溶液清洗3 次,制成菌悬液,加入1 MIC的小檗碱,对照组用磷酸盐缓冲溶液进行校正,37 ℃恒温振荡培养6 h,8 000 r/min离心15 min,磷酸盐缓冲溶液清洗3 次,超声破碎细胞(破碎条件:工作5 s、间歇15 s、共10 min,功率400 W),采用考马斯亮蓝法测定蛋白质含量,以牛血清白蛋白作为标准品。用ATP酶试剂盒测定4 种供试菌中Na+/K+-ATP酶的活力,每个样品3 次平行[24]。
1.4 数据统计与分析
采用Excel 2010与SPSS 20软件进行数据统计与分析,Duncan’s多重比较分析检验显著性,以P<0.05表示差异显著,数据处理结果表示为平均值±标准差。
2 结果与分析
2.1 小檗碱的抑菌性能
2.1.1 小檗碱的抑菌活性及MIC
小檗碱质量浓度为4.10 mg/mL时,测定其对4 种供试菌的抑菌活性,以无菌水作对照,如表1所示。对照组无抑菌圈出现,加入小檗碱的实验组均有抑菌圈出现,说明小檗碱对4 种供试菌均有抑制作用。大肠杆菌的MIC最小,为2.40 mg/mL,并且小檗碱对大肠杆菌的抑菌圈直径最大,为(11.60±0.11)mm,依次是金黄色葡萄球菌>枯草芽孢杆菌>沙门氏菌。总体来看,小檗碱对大肠杆菌的抑菌效果更好,原因可能是大肠杆菌为革兰氏阴性菌,而革兰氏阳性菌的细胞壁较厚,结构较为致密,阻碍了小檗碱的进入。

表 1 小檗碱对4 种供试菌种的抑菌活性及MICTable 1 MICs and antimicrobial activities of berberine against 4 tested microbes
2.1.2 小檗碱对4 种供试菌生长曲线的影响
从图1可以看出,对照组供试菌的生长曲线均为典型的S型,细菌生长稳定,均有对数生长期和稳定生长期。而加入1 MIC的小檗碱后,实验组的4 种供试菌的生长速率均明显降低,延滞期明显延长,对数生长期延后,枯草芽孢杆菌无明显对数生长期,而金黄色葡萄球菌对数生长期延后约8 h;最大生物量与对照组相比也明显降低,基本在16 h后进入稳定期,生长曲线趋于平缓甚至有所下降。由此可见小檗碱对4 种供试菌的生长繁殖均有抑制作用,延缓其生长期,降低最高生物量,在稳定期也可抑制生长甚至导致衰亡期提前。

图 1 小檗碱对4 种供试菌生长曲线的影响Fig. 1 Effect of berberine on growth curves of 4 tested bacteria
2.2 小檗碱的抑菌机理
2.2.1 小檗碱对菌体形态的影响

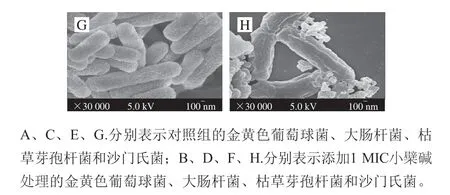
图 2 小檗碱对4 种供试菌菌体形态的影响Fig. 2 Effect of berberine on cell morphology of 4 tested bacteria
由图2可知,未添加小檗碱的4 种供试菌的菌体完整,细胞膜表面有轻微皱缩,比加入小檗碱的菌体更为圆润饱满,细胞膜完整,没有破裂。当加入1 MIC的小檗碱时,4 种供试菌的菌体产生较大程度的皱缩,菌体扭曲变形,细胞膜褶皱,大肠杆菌和金黄色葡萄菌菌体细胞膜明显破裂,导致细胞质外泄,菌体裂解死亡[25]。说明小檗碱作用于细胞膜结构,使细菌菌体受损,结构不完整从而发挥抑菌作用。
2.2.2 小檗碱对菌悬液电导率的影响
由图3可以看出,对照组电导率增长平缓,有轻微的增长趋势,是由于菌体细胞的自然衰亡与溶解[26];加入小檗碱后4 种供试菌菌悬液的电导率开始增大,明显高于对照组,电导率反映了小檗碱对菌体细胞膜通透性的影响。K+、Na+、H+等可以通过菌体细胞膜进入细胞,这些离子在维持细胞膜电位以及菌体细胞的正常代谢等方面有着重要作用,从而保障细胞的正常功能[27]。而小檗碱能使菌体细胞破裂,使菌体细胞内的离子稳态遭到破坏,细胞内电解质外泄,菌体代谢无法进行,最终导致菌体死亡。


图 3 小檗碱对4 种菌电导率的影响Fig. 3 Effect of berberine on conductivity of 4 test bacteria
2.2.3 小檗碱对受试菌核酸溶出的影响

图 4 小檗碱对4 种菌核酸溶出的影响Fig. 4 Effect of berberine on nucleic acid release from 4 test bacteria
如图4所示,加入1 MIC小檗碱的实验组菌种在260 nm波长处的吸光度与对照组相比均明显增加。表明菌体中核酸的释放量增大,小檗碱破坏了细胞膜的完整性,核酸等大分子物质外泄,导致细胞代谢受损,细胞失去保护,最终菌体死亡[28],这与扫描电子显微镜所示的细胞受损破裂及菌悬液电导率升高的结果一致。
2.2.4 小檗碱对菌体蛋白合成的影响

图 5 小檗碱对菌体蛋白合成的影响Fig. 5 Effect of berberine on bacterial protein synthesis
如图5所示,加入小檗碱的实验组与未加入小檗碱的对照组条带有显著差异。4 个对照组的条带数量比实验组多,并且清晰明显。与对照组相比,实验组的金黄色葡萄球菌条带在44.3 kDa处的条带明显变浅;大肠杆菌在116、66.4 kDa和44.3 kDa处的条带消失且条带数量均减少;沙门氏菌在44.3 kDa与200 kDa之间的条带变浅;枯草芽孢杆菌在44.3 kDa附近处的条带变浅、较不明显。说明小檗碱抑制了4 种供试菌细胞内蛋白的表达,对蛋白的合成具有一定的抑制作用。
2.2.5 小檗碱对细胞膜Na+/K+-ATP酶活力的影响

图 6 小檗碱对4 种菌NaTP酶活力的影响Fig. 6 Effect of berberine on cell membrane Na+/K+-ATPase activity of 4 test bacteria
如图6所示,加入1 MIC小檗碱的4 种供试菌的Na+/K+-ATP酶活力与对照组相比明显降低。沙门氏菌与金黄色葡萄球菌Na+/K+-ATP酶活力下降幅度较小,1 MIC小檗碱对枯草芽孢杆菌的Na+/K+-ATP酶活力抑制效果最好,Na+/K+-ATP酶活力由(35.00±1.80)U/mg降至(4.50±0.19)U/mg。原因可能是小檗碱对蛋白有抑制作用,进而抑制了酶的活力,因此小檗碱对Na+/K+-ATP酶活力具有抑制作用[29]。
3 结 论
食品防腐剂是应用于食品工业的重要食品添加剂,主要分为天然防腐剂和化学合成防腐剂,现阶段主要以化学合成防腐剂为主,其对人体健康具有潜在的危害性,因而天然食品防腐剂越来越受到人们的重视[30]。细叶小檗果中的小檗碱作为一种天然抑菌物质,可以抑制食品中常见的金黄色葡萄球菌、大肠杆菌、沙门氏菌以及枯草芽孢杆菌。由本实验可知,小檗碱对这4 种供试菌均有抑菌圈出现,金黄色葡萄球菌、大肠杆菌、沙门氏菌以及枯草芽孢杆菌的抑菌圈直径分别为(10.20±0.14)、(11.60±0.11)、(9.80±0.14)mm和(10.10±0.18)mm,MIC分别为3.30、2.40、3.95 mg/mL和3.60 mg/mL,对大肠杆菌的抑菌直径最大并且具有最小的MIC,表明小檗碱对大肠杆菌的抑菌效果更好。小檗碱处理后的细菌生长曲线较平缓,对数生长期延后,阻碍了细菌的正常生长繁殖。小檗碱破坏菌体的形态,使菌体细胞破裂,胞内离子外流。同时,小檗碱能干扰菌体内蛋白的合成,抑制细胞膜Na+/K+-ATP酶的活力,影响菌体内蛋白质的积累,酶的功能受损,使其无法进行正常代谢,最终导致细菌衰亡。此外,有研究表明,一些抑菌剂如百里香酚、氯氰菊酯和氟尿嘧啶,可以与DNA结合,并可能诱导DNA二级结构和形态的变化[31]。黎芳靖[32]研究发现小檗碱能影响植物水稻细菌性条斑病菌的能量代谢,基于这些研究结果,今后有待开展小檗碱对DNA及能量代谢等方面的研究。
