不同主产国别椰子水成分及预处理方式对细菌纤维素合成的影响
2020-09-21罗佳茜傅美娟吴毓炜王哲魁李从发刘四新
罗佳茜,傅美娟,赵 波,吴毓炜,王哲魁,邓 健,李从发,刘四新,,*
(1.海南大学食品科学与工程学院,海南 海口 570228;2.海南椰树集团有限公司,海南 海口 570103;3.海南省产品质量监督检验所,海南 海口 570203;4.海南大学理学院,海南 海口 570228)
椰子水是细菌纤维素(bacterial cellulose,BC)生产中最常用且商业利用最成功的原料。BC是一种微生物合成的高聚多糖,因其具有独特的高纯度、高韧性强度、高持水性、生物相容性[1-2]等优良特性而成为国内外的研究热点,其应用领域广泛,尤其是在医药领域。BC在中国主要作为食品配料,商品名为椰子果。但BC生产效率低、价格昂贵、原料品质受产地环境限制等问题制约了其应用的广度和深度。一些以提高BC产量为目的的研究主要集中在选育优良的BC生产菌种、优化培养条件和发酵方式等方面,同时也有学者在不断寻找和挖掘价格低廉但BC产量高的原料培养基,包括水果和蔬菜下脚料[3]、废料甘油[4]、糖蜜[5]或乳清[6]、农产品[7]及其残渣[8]、工业副产物[9]等。Kurosumi等[10]以新鲜桔子、苹果、葡萄等为原料发酵生产BC,产量为0.3~1.8 g/L。杨光等[11]以腐烂水果液为单一营养源合成BC,产量为0.53~2.23 g/L,而以葡萄糖为单一营养源时则不产生BC。腐烂水果液中富含除糖以外的维生素、氨基酸、微量元素等多种营养成分,某些成分可能对BC合成起到重要作用。这些研究的BC产量较低,原料需要经过取汁或除杂等多次处理,不利于投产。椰子水作为椰子的液体胚乳,不仅天然液态、无需榨汁、取用便捷,还是固体胚乳——椰子肉利用工业中的废弃物,因剩余椰子水极易发酵变质,故作为工业废物其价格低廉,因此是我国和东南亚国家工业化生产BC最常用和应用最成功的原料。本团队在同类研究中首次报道椰子水经过自然放置发酵后生产BC,其产量更高且品质更好。王艳梅等[12]提出椰子水在加工厂区预发酵1 d即可使BC产量增加,为新鲜椰子水的25 倍,达到14.5 g/L。Gayathry等[13]比较了Hestrin Schramn(HS)培养基和改良的椰子水培养基用于生产BC的差异,表明改良椰子水培养基中BC的生物合成产率更高,但改良操作并非涉及对其进行“发酵处理”。对于针对性地将椰子水进行预发酵处理后再用于BC发酵生产的研究鲜见其他报道,仅同团队杨一冲[14]、Zhang Jiachao[15]、邓健[16]等有过相关报道。
然而,同样以椰子水为原料,不同国家、地区所产椰子水经过预发酵后进行BC生产的效率和产量仍然差异较大[12],如从我国和东南亚国家生产BC的工厂实际情况看,东南亚国家的产品效率高、品质好,而海南地区生产BC常存在产量不稳定、产率偏低、BC膜有时软塌(实际是BC干质量率偏低)等问题,这可能是不同国别地区的气候条件、生长环境和椰子品种的不同,导致椰子水的化学成分也不尽相同,而椰子水原料成分的差异有可能是引起BC合成效率差异的主要原因之一。为此,本研究选取东南亚代表性的椰子出产国、椰纤果主产国(越南现为中国最大的椰纤果进口国,印度尼西亚(以下简称印尼)为中国最大的椰子进口国)和海南的椰子取水进行成分研究,并同时进行“预发酵”的处理,然后比较其对BC合成影响的差异,为椰子水应用于BC生产必须进行“预发酵”处理的观点提供进一步完善的理论依据,并为进一步解析预发酵过程在菌相变化方面的规律、以代谢组学研究揭示调控BC合成的关键化合物等方面的研究提供参考。
1 材料与方法
1.1 菌株、材料与试剂
Y 1 9:椰冻驹形氏杆菌(Komagataeibacternataicola),为本实验室分离保藏[17];YU:驹形氏杆菌(Komagataeibactersp.),为越南槟椥地区BC工厂的生产菌种。
海南椰果采购于本地市场;越南和印尼椰果采购于海南椰树集团有限公司。海南新鲜椰子水(HNC)、越南新鲜椰子水(YNC)和印尼新鲜椰子水(INC):取3 个产地的椰果,破壳过滤取水后分别装入洁净贮存桶,-20 ℃冻存备用。
实验室环境下自然预发酵的海南预发酵椰子水(HFC-L)、越南预发酵椰子水(YFC-L)和印尼预发酵椰子水(IFC-L):3 种新鲜椰子水在实验室室温下自然预发酵,分别取样装于储存瓶,-20 ℃冻存备用。
海南工厂环境预发酵椰子水(HFC-F)、越南工厂环境预发酵椰子水(YFC-F):海南文昌工厂和越南槟椥工厂的自然预发酵椰子水分别取样,-20 ℃冻存备用。
蔗糖、氢氧化钠、硫酸铵、硫酸镁、磷酸二氢钾、乙酸、3,5-二硝基水杨酸、硝酸、过氧化氢(均为分析纯) 广州化学试剂公司;AccQ·Tag化学组件包(均为色谱纯) 沃特世科技(上海)有限公司;28 种元素储备液(均为色谱纯) 中国标准物质中心。
1.2 仪器与设备
X Series(X7)电感耦合等离子体质谱仪 美国赛默飞世尔公司;1100型液相色谱仪 美国安捷伦公司;Esquire HCT质谱仪 美国布鲁克公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;Delta320-S pH计 瑞士梅特勒-托利多仪器有限公司;G154D自动压力蒸汽灭菌锅 厦门致微仪器有限公司;SPX智能生化培养箱 宁波江南仪器厂。
1.3 方法
预处理是使新鲜椰子水直接暴露在自然环境下发酵(分为工厂环境和实验室环境)一定时间,分别将不同产地新鲜椰子水、预发酵处理后的椰子水配制成培养基接种BC生产菌株(Y19、YU)发酵生产BC膜,以膜干质量为评价指标比较BC合成效率。
1.3.1 矿物质元素质量浓度测定
3 种新鲜椰子水各取5 m L 于消解罐内,加入3 mL HNO3和2 mL H2O2溶液,于165 ℃的恒温加热板上加热4 h,赶酸0.5 h后转入25 mL容量瓶中定容待测。用电感耦合等离子体质谱仪分析测定[18-19],质谱仪所用分析标准溶液为国家标准样品GSB 04-1767-2004 Al、As、B、Ba、Be、Bi、Cd、Co、Cr、Cu、Fe、Ga、Li、Mg、Mn、Ni、Pb、Sb、Sn、Sr、Ti、Tl、V、Zn混合标准溶液,Na、K、Ca、Se元素标准储备液[20-21]。
1.3.2 氨基酸含量测定
采用AccQ·Tag柱前衍生反相-高效液相色谱法[22-23]测定椰子水的氨基酸组分。使用AccQ·Tag化学组件包,包括AccQ·Fluor试剂盒、氨基酸水解标样(17 种水解氨基酸)。紫外检测器定量检测椰子水衍生产物。色谱条件如下:色谱柱为TC-C18柱(150 mm×4.6 mm,5 μm);柱温:37 ℃;进样体积10 μL;洗脱液A为AccQ·Tag洗脱液A用超纯水11 倍稀释而成,洗脱液B为60%色谱纯乙腈。梯度洗脱按如下程序进行:洗脱液B初始比例为0%,在0.5 min内升至1%,在16.5 min内升至7%,4 min升至10%,9 min再升至33%,1 min升至100%,保持3 min,最后于1 min内降到0%,并维持12 min;洗脱时间为50 min。
1.3.3 还原糖和总糖质量分数测定
采用3,5-二硝基水杨酸比色法测定椰子水中还原糖和总糖质量分数[24-25]。
1.3.4 pH值和总酸质量浓度测定
采用pH计法测定pH值;采用滴定法测定总酸质量浓度[26]。
1.3.5 培养基的制备
Y 1 9/Y U 种子液培养基:(N H4)2S O43 g/L、MgSO4·7H2O 0.3 g/L、KH2PO40.3 g/L、预发酵7 d的椰子水70%(体积分数,后同)、蒸馏水30%,pH 5.0,调糖度至6 °Brix,121 ℃灭菌15 min。
B C 发 酵 培 养 基: ( N H4)2S O43 g / L 、MgSO4·7H2O 0.3 g/L、KH2PO40.3 g/L、新鲜/预发酵1~7 d的椰子水50%、蒸馏水50%,pH 5.0,调糖度至6 °Brix,121 ℃灭菌15 min。
1.3.6 BC的发酵及膜干质量测定
以2%的接种量将种子液接种至BC发酵培养基,30 ℃静置培养7 d,收获BC膜。
收获的BC膜浸泡在0.1 mol/L NaOH溶液中,80 ℃水浴至膜呈乳白半透明状后取出,0.5%乙酸溶液中浸泡中和,用蒸馏水冲洗BC膜至中性。最后于80 ℃烘箱脱水至恒质量,称其干质量,按下式计算BC产量。

1.4 数据统计与分析
采用Excel 2013软件和GraphPad Prism 6软件进行数据处理和作图,并使用SPSS 21.0软件中Duncan’s多重比较法进行显著性差异分析。实验结果以平均值±标准偏差表示,P<0.05表示差异显著。
2 结果与分析
2.1 不同国别产地新鲜椰子水成分的测定结果
质谱仪测定结果显示HNC和YNC中均检出19 种矿物质,而INC检出18 种(表1)。3 种椰子水中质量浓度均较高且具有显著性差异的常量元素有K、Ca、Na、Mg(图1),HNC的K元素质量浓度显著高于YNC和INC;INC中Na和Mg含量显著高于HNC(P<0.05)。YNC中微量元素Fe、Mn以及重金属元素Ni、Cd、Cu等质量浓度均较高。3 种椰子水矿物质质量浓度的差异可能受土壤、气候及椰子品系等的影响较大。

表 1 3 种椰子水矿物质质量浓度Table 1 Mineral contents of three freshcoconut waters

图 1 3 种椰子水主要常量元素质量浓度比较Fig. 1 Comparison of the contents of major macro elements in three fresh coconut water
表2为3 种新鲜椰子水氨基酸组成及含量。3 种椰子水均检出16 种氨基酸,HNC中各类氨基酸含量除丝氨酸和甘氨酸外均显著高于YNC和INC,其总氨基酸含量分别是YNC和INC的2.7 倍和2 倍,INC各类氨基酸含量均高于YNC(天冬氨酸除外)。
3 种椰子水总糖和还原糖质量分数如图2所示,HNC的总糖质量分数显著高于YNC和INC(P<0.05),还原糖质量分数与Y N C 和I N C 相比无显著性差异(P>0.05)。3 种椰子水pH值和总酸质量浓度测定结果(表3)显示H N C 的p H 值最低,其总酸质量浓度(0.482 g/L)显著高于YNC和INC(P<0.05)。

表 2 3 种椰子水氨基酸含量Table 2 Amino acid contents of three fresh coconut waters

图 2 3 种椰子水还原糖和总糖质量分数Fig. 2 Comparison of reducing sugar and total sugar contents in three fresh coconut waters

表 3 3 种椰子水pH值和总酸质量浓度Table 3 pH and total acid concentrations of three fresh coconut waters
成分的测定结果显示不同国别椰子水的化学成分如矿物质、氨基酸、总糖、总酸水平均具有显著性差异,HNC的氨基酸、常量元素、总糖和总酸含量丰富,显著高于YNC(P<0.05),INC的氨基酸和总酸含量高于YNC。因此,HNC在供给微生物生长所需的氮源、生长因子种类等方面的能力最强,YNC相对较差。
2.2 不同BC菌种对原料椰子水的适应性及合成BC产量的差异
为考察不同国别使用的菌种对发酵原料的适应性和稳定性情况,将越南工厂的BC生产菌种YU和实验室菌种Y19分别接种至预发酵1~7 d的HNC中(以未发酵的新鲜椰子水为对照),如图3所示,以新鲜椰子水合成BC时,接种不同菌种获得的BC产量没有显著性差异,但预发酵不同时间后的椰子水接种不同菌种其合成的BC产量差异程度各异。菌种YU发酵生产BC最高产量可达5 g/L左右,但是BC产量波动极大。虽然菌种Y19最高产量明显低于菌种YU,但菌种Y19 BC产量比较稳定且在预发酵时间内未见明显减少。说明菌种与原料之间呈现匹配性和相关性,且未发酵过的新鲜椰子水无论是接种实验室纯种还是生产菌种来生产BC都可能不适于投产,这侧面说明预发酵的必要性和重要性。

图 3 不同菌种对不同预发酵时间椰子水合成BC的适应性Fig. 3 Applicability of different strains to BC biosynthesis from coconut water with different pre-fermentation times
2.3 不同国别产地新鲜椰子水对BC产量的影响
为确切比较不同产地新鲜椰子水对BC合成的影响,以3 种新鲜椰子水为原料接种实验室纯种Y19进行实验。如图4所示,BC产量均较低,不足1 g/L,且呈现显著差异(P<0.05),这与原料成分测定结果的差异性呈正相关关系,HNC的BC产量(0.95 g/L)最高,分别是INC和YNC的2 倍和3 倍,可能正是HNC相较于其他两种椰子水有更高含量的氨基酸、常量无机元素、有机酸类的化学成分,从而更加促进微生物的生长和BC的合成代谢[27-28]。氨基酸作为生长因子容易透过生物膜被微生物直接吸收,从而促进微生物生长、参与或调节代谢反应等[29]。Matsuoka等[30]表明甲硫氨酸可以缩短BC合成的延迟期、加速细胞生长从而提高产量。YNC的氨基酸含量最低可能是BC产量低的原因之一。新鲜椰子水在不添加任何增效因子时成分的差异可能导致BC产量差异在2~3 倍左右。
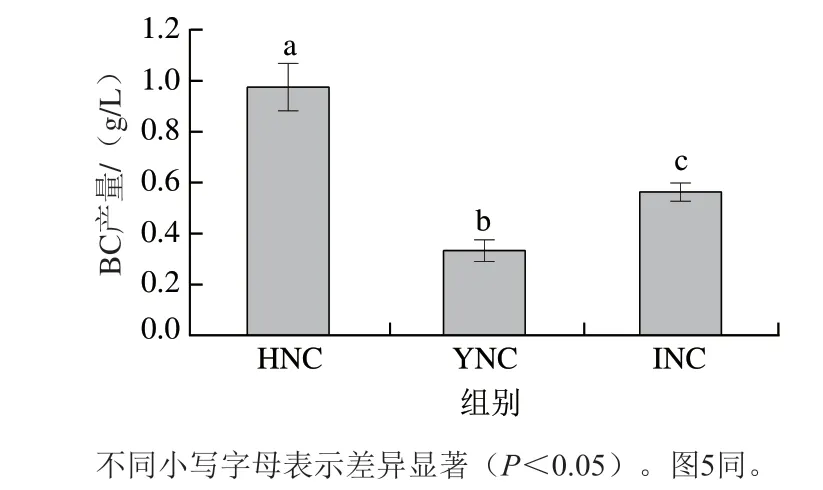
图 4 3 种新鲜椰子水BC产量Fig. 4 BC yield of three fresh coconut waters
2.4 不同预发酵处理方式对BC产量的影响
为了探讨椰子水经历预发酵后是否还能与成分差异呈现某种关联,故选取化学成分差异最大的HNC和YNC进行预发酵处理,以比较不同预发酵处理方式和原料本身化学成分对BC合成的影响。
2.4.1 不同预发酵环境对BC产量的影响
以工厂和实验室环境预发酵6 d的椰子水为样品,对比不同环境预发酵处理后的椰子水对BC合成的促进作用(图5)。原本BC产量较低的YNC经越南工厂环境预发酵处理后,YFC-F发酵生产BC的产量达到17.6 g/L,是YNC的52 倍,是HFC-F的3 倍左右,而HFC-F产量相比于HNC提高了5 倍。这说明新鲜椰子水的BC合成产量随着原料预发酵处理后发生了极大改变,新鲜椰子水化学成分差异对BC产量的影响远不及椰子水预发酵处理对BC产量的影响。同时,YFC-F的产量是YFC-L的32 倍,HFC-F的产量是HFC-L的2 倍,表明工厂和实验室两种环境下预发酵的椰子水生产BC的产量存在显著差异(P<0.05)。

图 5 不同预发酵环境对BC产量的影响Fig. 5 Effects of different pre-fermentation environments on BC yield
2.4.2 不同预发酵时间对BC产量的影响
研究不同预发酵时间处理对椰子水发酵生产BC的影响,对实验室预发酵的椰子水接种实验室纯种Y19(图6A),对工厂预发酵椰子水接种工厂生产用菌种YU(图6B)。图6A中,3 种椰子水的BC产量差异基本与新鲜椰子水化学成分差异相对应、YFC-L的产量始终最低;而图6B却显示YFC-F的BC产量最高,达10 g/L以上,说明不同环境的预发酵效果差异显著。这可能与工厂环境的微生物区系复杂,发酵后影响椰子水成分的变化,从而覆盖了原料成分的差异性影响有关,在此过程中,椰子水原料本身化学成分差异在影响BC产量方面可以忽略不计。
从不同预发酵时间点来看,不同预发酵环境(实验室和工厂)和不同BC合成菌种(Y19和YU)发酵生产BC均呈现类似规律,即预发酵前期(1~3 d)产量不同程度上升,中期相对稳定,6~7 d后基本呈现下降趋势,可能与椰子水中微生物多样性、菌群结构的变化密切相关。王艳梅等[12]在研究国内不同产地(海南、云南)椰子水的预处理时间影响时也发现类似变化规律;王志国等[31]比较了以预发酵10~40 d的椰子水为原料生产BC的产量的变化,发现椰子水预发酵时间超过20 d的BC产量下降了24%~50%。说明不同预发酵时间处理对合成BC的影响也较大,但波动幅度不会超过43%。
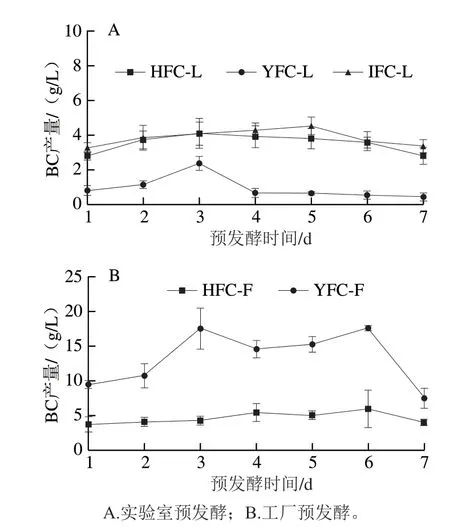
图 6 不同预发酵时间对BC产量的影响Fig. 6 Effect of different pre-fermentation time on BC yield
3 结 论
本研究基于不同产地原料化学成分的差异性对椰子水进行不同方式的预发酵处理,比较原料成分和不同预发酵处理方式对BC合成的影响。结果表明:HNC的相关常量元素、氨基酸、糖类和酸类物质含量最高,YNC相关化学成分含量最低;3 种新鲜椰子水的BC产量均很低但差异显著(P<0.05),HNC最高、YNC最低,呈现与椰子水本身成分差异的正相关关系。对椰子水进行预发酵不同时间处理后发现YFC-F生产BC的产量显著高于HFC-F,说明不同环境预发酵处理对BC增产的影响显著高于原料椰子水化学成分差异造成的影响,在经历预发酵过程后,椰子水天然成分差异不再是造成BC产量差异显著的主要因素。从预发酵时间比较发现BC产量呈现前期(1~3 d)上升、中期相对稳定,至后期(6~7 d)又下降的变化规律。这说明椰子水预发酵处理过程中所发生的生物学变化过程研究具有重要意义。新鲜椰子水本身成分显著影响其生产BC的产量,但是此规律被预发酵过程显著改变,椰子水的预发酵过程才是影响BC合成效率的最重要的影响环节。未来将明确可以高产BC的预发酵椰子水对应的预发酵时间点,将该时间点下处理的椰子水进行菌相动态变化的深入分析、并进一步研究探讨高效促进BC合成的关键性小分子代谢物,为深入阐释BC的合成调控机制提供依据。
