基于DNA定向固定化技术构建毛细管固定化酶微反应器的研究进展
2020-09-18宋佳一李梦琦周梓昕贺雯婷
宋佳一, 李梦琦, 沈 昊, 周梓昕, 贺雯婷, 苏 萍, 杨 屹
(北京化工大学化学学院, 北京 100029)
酶广泛分布于生命体内,影响着物质代谢和质能转换等许多生命活动[1]。生物体内某些酶的活性变化会导致疾病的发生,例如,神经间隙中乙酰胆碱酯酶活性过高会导致阿尔茨海默症,α-葡萄糖苷酶的活性升高与糖尿病密切相关,丙酮酸脱氢酶活性缺失会导致乳酸中毒等[2,3]。因此,发展新型的酶分析方法对酶活性和酶动力学等性能进行研究,对深刻理解生物代谢过程、疾病诊断和药物研发具有重要意义。毛细管电泳(CE)具有样品消耗量少、分析速度快、操作简便以及可以与多种检测手段联用等优点,已经发展成酶分析的重要工具[4]。
采用CE进行酶分析主要包括两种方式:离线模式和在线模式[5]。离线模式下,酶和底物在管外孵育后,再将酶反应液导入毛细管进行分析,CE仅作为分离工具;在线模式下,毛细管不仅作为分离通道,还作为酶反应场所,从而实现在一根毛细管内连续完成酶反应、分离、检测的分析步骤。在线模式又发展出均相分析方法-电泳中介微分析(electrophoretically mediated microanalysis, EMMA)和异相分析方法-固定化酶微反应器(immobilized enzyme microreactor, IMER)[4]。IMER将天然酶固定在毛细管内,不仅显著提高了酶稳定性和重复使用性,而且可以实现纳升规模溶液的自动化酶分析,进而显著降低了酶分析成本[6,7]。因此,近年来基于IMER的CE酶分析(CE-IMER)已经成为主流的酶分析方法[8]。在CE-IMER酶分析中,如何构建性能良好、可再生使用、酶固载量大、自动化程度高的IMER一直是该领域重点研究的问题。随着纳米技术和材料科学等领域的不断发展,各种性能优异的新型材料和固定化技术被用于IMER的构建,显著提高了CE-IMER在各个领域的分析性能[9-11]。本文将从DNA定向固定化技术的特点出发,着重阐述基于DNA定向固定化技术构建IMER,并应用于CE酶分析的现状和未来发展。
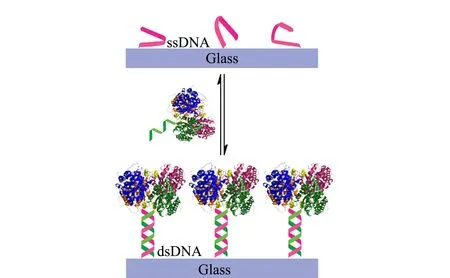
图 1 DNA定向固定化流程图[17]Fig. 1 Schematic representation of DNA-directed immobilization (DDI)[17]
1 DNA定向固定化技术的发展和特点
20世纪80年代人类基因组计划的出现促进了DNA微阵列技术的发展,随后又衍生出复杂的DNA微阵列,成为当今基础和应用生物医学研究中基因分型和基因组分析的常规工具[12]。此外,由于DNA分子具有较好的稳定性,基于DNA微阵列还实现了多达数百万种不同寡核苷酸参与的大规模工业生产过程[13]。然而,DNA相关技术的应用远远超出了基因组学和转录组学的应用范围。20世纪90年代初出现的DNA定向固定化(DNA-directed immobilization, DDI)技术[14]基于DNA微阵列的发展,通过载体表面DNA的有序排列实现了DNA芯片的研发,为蛋白质和其他非核酸分子的分析开辟了新的途径[15,16]。DDI利用载体表面结合的单链寡核苷酸片段,通过碱基互补配对原则(A-T, C-G),选择性地结合带有互补单链寡核苷酸标记的蛋白质[16]。通过DNA杂交固定化的过程与蛋白质的表面功能化过程分开进行,因此不会损害蛋白质敏感的三级和四级结构;同时,DDI可以通过简单变性过程再生DNA表面[17](见图1)。
近20多年来,DDI相关技术在蛋白质阵列分析、纳米材料自组装以及细胞生物学研究等领域发挥了重要作用[16]。例如,通过DDI将目标蛋白质固定在载体基质上制备蛋白质阵列,可广泛应用于检测小分子[18]、电化学酶分析[19]、蛋白质组学研究[20]以及蛋白质和金属之间的电子转移过程研究[21];通过将DDI技术与纳米材料相结合,研究者开创性地自组装金纳米粒子,衍生出了一整套用于检测核酸和蛋白质的生物分析方法[22-24];通过方式多样的温和化学方法,短链DNA寡核苷酸可以直接与活细胞膜结合,使细胞选择性地附着在DNA表面,可用于细胞黏附[16,25]等。这些研究均表明DDI具有广阔的应用前景。
2 DNA定向固定化技术用于IMER的制备与应用
DDI可以充分利用DNA分子的碱基互补配对(A-T, C-G),在温和的生理条件下特异性固定生物大分子[26]。由于短链双螺旋DNA分子具有较强的机械刚性和物理化学稳定性,因此通过DDI将酶固定在载体表面,可以形成酶微阵列,还可以充分暴露酶的活性位点,有利于降低传质阻力,提高酶与底物的接触能力[27,28]。另一方面,酶与载体之间的相互作用极易导致酶活性结构的改变,最终导致酶活性损失,因此选择合适的固定方法和策略对制备高稳定性和高活性的固定化酶体系至关重要[29,30]。采用机械强度好的短链DNA,通过DDI技术将酶固定在毛细管内壁,一方面有望降低酶与毛细管管壁的直接相互作用,提高稳定性,另一方面有望提高酶与底物的接触能力进而提高IMER的催化能力。
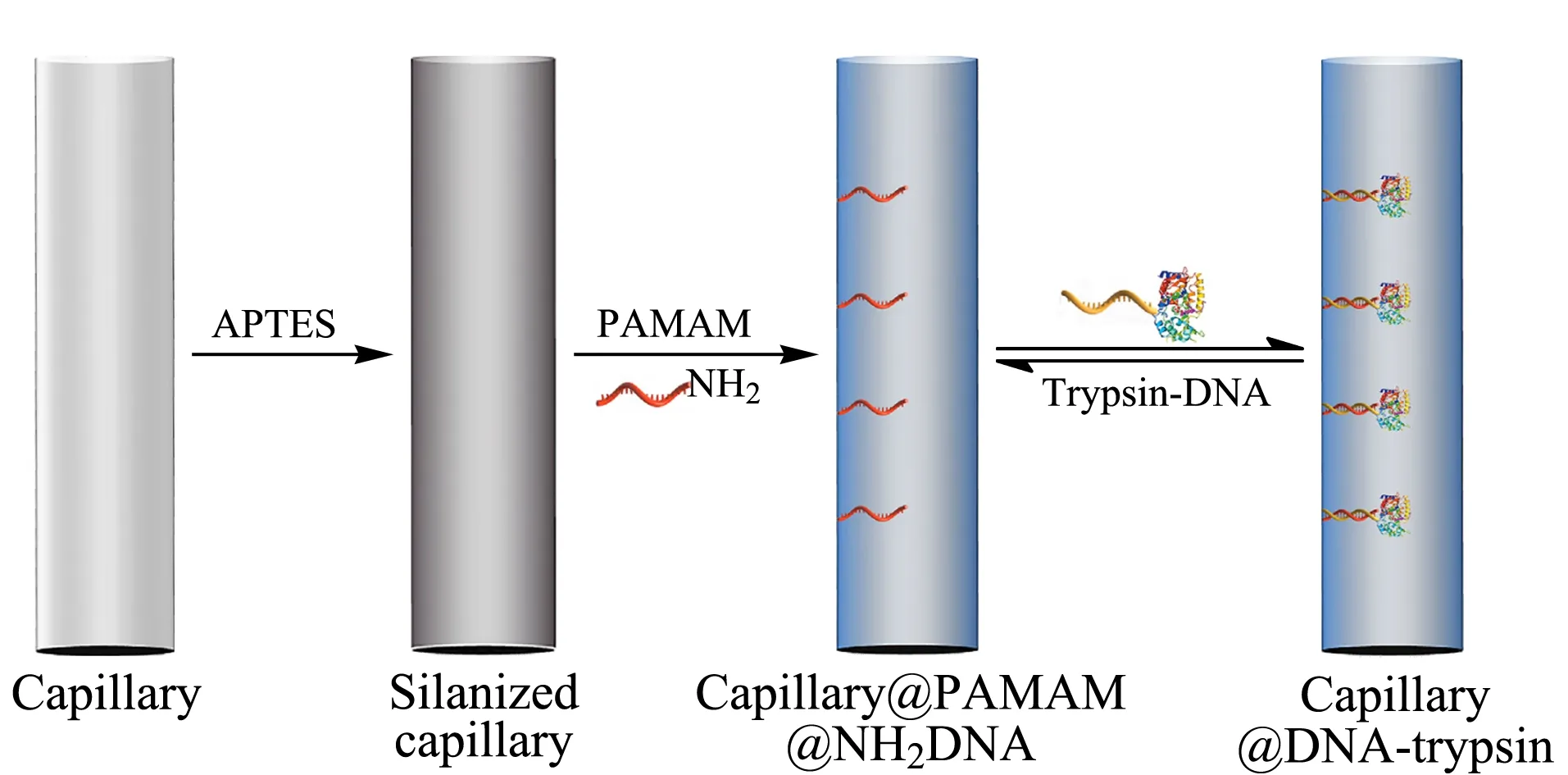
图 2 DNA定向固定化胰蛋白酶IMER流程图[31]Fig. 2 Schematic of the process for trypsin IMER by DNA direct immobilization[31] APTES: 3-aminopropyltriethoxysilane; PAMAM: poly(amidoamine).
本课题组在利用DDI技术制备IMER方面进行了初步的研究探索工作。Yang等[31]在硅烷化的石英毛细管内壁键合聚酰胺-胺树枝状大分子用于提供大量端氨基,采用戊二醛将单链DNA(ssDNA)修饰在毛细管内壁,随后将与ssDNA互补配对的DNA-胰蛋白酶复合物通过DDI技术固定在毛细管内,制备了离线模式和在线模式的胰蛋白酶IMER(见图2)。实验发现,制备的IMER具有较好的稳定性和重复使用性,在4 ℃保存30天,仍可以保留70.16%的酶促活性,连续进行11次酶解反应,考察其重复使用性,RSD值仅为2.91%。通过DNA杂交和去杂交实现DNA-胰蛋白酶复合物在毛细管内壁的固定和移除,可以达到ssDNA功能化毛细管基体的多次再利用,显著降低IMER制备的经济和时间成本,提高了酶分析效率。将制备的胰蛋白酶IMER应用于细胞色素C的酶切,与游离酶相比,在较短的酶切时间内展现出较好的酶切效果。

图 3 DNA定向固定化GOx和HRP双酶IMER流程图[32]Fig. 3 Schematic of the process for GOx and HRP IMER by DNA direct immobilization[32]
自然界中存在的大多数酶促反应体系都需要两种以上酶的共同参与,因此多酶反应体系的构建更能反映IMER在实际酶分析中的应用潜力。目前大部分基于毛细管柱的IMER局限于单酶固定,在一定程度上限制了其广泛应用。Yang等[32]通过设计DNA碱基序列,采用两条互相不配对的ssDNA对毛细管内壁进行修饰改性,随后将与ssDNA互补配对的DNA-葡萄糖氧化酶(GOx)和DNA-辣根过氧化物酶(HRP)复合物通过DDI固定在毛细管内,制备双酶IMER(见图3)。研究表明,制备的毛细管双酶IMER具有较好的双酶级联酶促活性和突出的底物亲和性。利用DDI可控制备酶阵列的优势,通过调节两条ssDNA的比例,在毛细管内实现GOx和HRP比例的调控,进而实现高效率级联反应体系的构建。制备的双酶IMER同样通过DNA去杂交实现了DNA-酶的释放和ssDNA功能化毛细管的再利用。研究表明,制备的双酶IMER具有较好的稳定性和重复使用性,且均优于通过非特异性吸附制备的双酶IMER。将制备的IMER用于葡萄糖的灵敏性分析检测,展现出较好的酶促分析性能,在生命分析等领域具有广阔的应用前景。
3 总结与展望
与传统的吸附、交联、封装和共价连接固定化酶方法相比,DDI可以在温和的生理条件下进行酶固定化,显著降低固定化过程对酶活性构象和稳定性的影响;同时,DDI的可逆固定化过程可以再生载体表面,显著降低IMER制备的经济和时间成本。因此,DDI是制备IMER的理想方法。
目前,基于DDI等DNA纳米技术制备新型IMER的研究处于起步阶段,还有很大的发展和研究空间。在前期研究基础上,可以着重发展以下方面:(1)基于DDI在毛细管内分区域固定目标酶,构建更加高效催化的IMER级联反应体系;(2)针对目前IMER制备过程中存在的稳定性、酶促活性以及酶固载量有待提高等问题,充分利用DNA的结构和官能团优势,并与纳米材料的发展相结合,制备新型IMER,进一步推进CE-IMER在酶分析中的广泛应用。
