毛细管电泳序列分析技术用于在线酶分析研究进展
2020-09-18田苗苗
田苗苗, 杨 丽
(1. 吉林工程技术师范学院, 化学与工业生物工程交叉学科研究院, 吉林 长春 130052; 2. 东北师范大学化学学院, 吉林 长春 130024)
毛细管电泳技术(capillary electrophoresis, CE)具有分离效率高、操作简单、样品和试剂消耗少、分析速度快以及可与多种检测器联用等优势,已经发展成为酶分析研究领域的强有力工具[1-3]。目前,基于CE技术的酶分析方法主要有两种操作模式,即离线酶分析(又称柱前酶分析法)和在线酶分析(又称柱上酶分析法)。离线酶分析是指将底物、酶和其他一些反应组分加入到一个单独的反应瓶中发生酶反应,反应生成的产物和剩余底物通过CE技术分离分析。离线模式操作和方法相对较简单,由于酶促反应的发生和CE的分离检测是相对独立的步骤,因此两者均可在其最佳条件下进行,彼此不产生干扰。但是,离线酶分析存在试剂消耗量大、步骤操作烦琐、酶稳定性差等缺点,限制了其在酶分析中的应用。在线酶分析中,毛细管兼具酶促反应场所和底物/产物的分离通道,在线酶分析将进样、酶促反应的启动和终止、分离及检测集成于一次运行中。与离线酶分析相比,在线酶分析具有准确、快速、易于自动化、酶消耗量少等优势,逐渐成为CE酶分析的主流发展趋势,在酶分析的各个方面得到广泛应用。电泳媒介微分析法(electrophoretically mediated microanalysis, EMMA)和固定化酶微反应器(immobilized enzyme microreactor, IMER)是CE酶分析中常用的在线分析方法。EMMA是在电场作用下利用酶、底物在缓冲溶液中的迁移速率差异来实现反应物的柱内混合,从而引发酶促反应,随后在电场作用下实现反应底物和产物的分离检测[1]。IMER是指将酶分子通过物理吸附、交联、共价键合等方法固定于毛细管内壁或毛细管内特定的载体上,酶反应器通常位于毛细管的一端,毛细管的其余部分用作CE分离检测[4]。底物流经酶反应器时发生酶催化反应,进而实现底物和产物的在线分离和检测。与自由酶溶液相比,固定化酶具有更高的酶/底物比、催化活性好、可重复使用、稳定性高等独特优势。EMMA和IMER已经广泛应用于酶活性和酶动力学、抑制剂筛选和底物测定等方面。目前,已有一些综述文章[5-8]对于这两种CE在线酶分析的研究进展进行了很好的总结和分析。

表 1 基于序列进样的CE技术在线酶分析实例
近年来,基于快速序列进样的CE序列分析技术已成为在线酶分析的另一种有力手段。传统的CE分析技术常用的进样方式为压力进样和电动进样。这两种进样方式都需要在每次进样后将毛细管进样端从样品溶液移入电泳缓冲溶液中,无法实现无干扰序列进样分析。因此基于压力进样和电动进样的CE在线酶分析(EMMA或者IMER)都很难实现高时间分辨和高通量在线检测。然而,对酶反应动力学过程的高时间分辨精确检测,可以实现对反应全程监测,即从反应开始到完全结束对反应物和产物的实时测量,因此可以更准确地获得反应机制和反应速率常数,监测酶活性随反应历程的变化,有助于更好地了解酶反应机制,从而更好地认识酶在生物代谢中的功能,对于酶抑制类药物的研发以及疾病的临床诊断具有重要意义。另一方面,基于序列进样的CE在线酶分析技术亦可以实现高通量的分析检测,这对于酶反应和酶抑制反应分析是非常重要的,尤其是准确、快速、高通量的酶抑制筛选方法的发展对加快新药的研发具有重要意义。
本文介绍了CE序列分析技术在线酶分析的最新研究进展,并着重介绍了基于光快门进样(optical-gated photobleaching injection, OGPB)、流动门进样(flow-gated injection)、毛细管对接的二维扩散进样(two-dimension diffusion injection)、流动注射进样(flow injection, FI)、液滴微流控进样(droplet microfluidics)等技术的CE在线酶反应和酶抑制反应的研究。表1总结了基于序列进样技术的高时间分辨酶分析和高通量酶抑制分析研究。
1 基于OGPB的CE在线酶分析
光快门进样是由Jorgenson课题组[25]于1991年首次提出的。该方法利用分束镜将激光分裂为两束,一束激光通过一个光快门后聚焦于毛细管上游位置作为漂白光,另一束激光位于下游作为激光诱导荧光检测的检测光。进样的具体过程为:首先在毛细管内连续引入具有荧光的样品溶液,同时打开光快门使漂白光持续照射样品,由于光漂白作用,经过的样品被分解为无荧光的物质。当需要进样时,关闭光快门一定的时间,使经过的一小段样品不被漂白即完成进样。这一小段样品区带经CE分离后在毛细管下游的检测点进行激光诱导荧光检测。OGPB最早应用于毛细管电泳分离体系中,以提高分离效率。文献[25-27]中已报道利用该进样技术,实现了荧光标记的氨基酸、多肽、寡核苷酸和其他小分子的高速(分离时间小于1 s)和高分离效率(塔板数106/m)的分析检测。光快门进样的进样量是由高精度光快门的开闭时间(通常为ms级)决定的,可低至数十至数百pL。因此,该进样方法可获得非常狭窄的进样区带,进而获得高的分离效率。光快门进样法不仅可以实现高准确的少量进样,而且还能实现高重现性的多次自动序列进样,因此该进样技术非常适合包括酶反应在内的化学反应动力学的在线连续监测。
Xu等[9]首次将光快门进样技术与微芯片电泳法结合,应用于在线酶分析,研究测定了β-半乳糖苷酶的酶活性和竞争性酶抑制反应。在分析过程中,底物和酶先在离心管中混合,然后转移到芯片上的储液槽中。在反应过程中,将样品连续引入微芯片的分离通道中,通过光快门实现序列进样,进而实现底物和产物的分离和检测。利用该系统,在一次CE分析中实现了对β-半乳糖苷酶酶促反应全程30 s高时间分辨的自动在线检测。为了提高分析通量,Xu等[10]进一步将光快门进样技术与多通道微芯片电泳法联用,采用相同的操作步骤测定了β-半乳糖苷酶的酶活性和酶抑制反应。在一次CE分析中,可以同时实现不同酶反应过程(如不同底物浓度的酶反应、无抑制剂/添加抑制剂酶反应)30 s高时间分辨的自动在线检测,大大提高了酶反应的分析通量。从上述分析过程可以看出,作者采用的是离线反应模式,对于反应速度非常快的酶促反应很难从反应开始就实现检测,而且由于进样过程中酶分子随着底物和产物一同进入分离通道,因此无法及时终止酶反应,导致在分离过程中酶反应仍可能继续进行,影响最后分析的准确性。
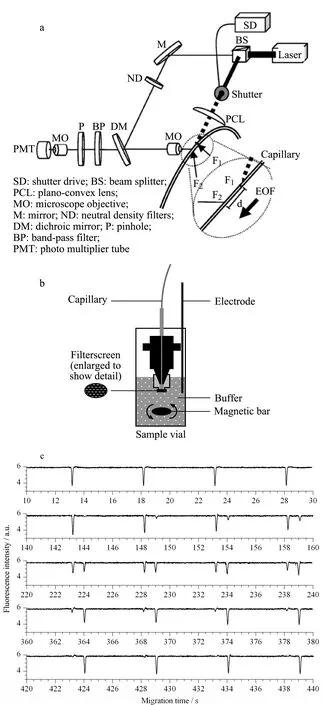
图 1 (a)OGPB-LIF毛细管电泳序列分析装置、(b)毛细管 进样端示意图和(c)固定化胰蛋白酶酶催化反应中底物、产物峰随酶催化反应时间的变化图[11] Fig. 1 Schematic diagram of (a) the OGPB-LIF instrument for sequential CE analysis, (b) the loading end of the capillary and (c) evolution of the substrate and product peaks as a function of time in study of immobilized trypsin cleavage reaction[11] The inset of Fig. 1a shows an enlarged view of the optically gated vacancy capillary electrophoresis (OGVCE) region, the distance between the photobleachingposition (F1) and the detection position (F2) on the capillary is the effective separation distance. OGPB: optical-gated photobleaching injection.

图 2 (a)OGPB-UV-Vis毛细管电泳序列分析装置图,(b)Asn和 Asp标准混合溶液20次连续进样电泳谱图和(c)L-天冬酰胺酶催化酶反应中底物、产物峰随酶催化时间的变化图[12] Fig. 2 (a) Schematic diagram of the OGPB-UV-Vis setup for sequential CE analysis, (b) electropherogram for the 20 sequential analysis of Asn and Asp standard mixture and (c) evolution of the substrate and product peaks as a function of reaction time in the study of L- asparaginase-catalyzed reaction[12] The inset of Fig. 2c shows the measured Michaelis-Menten diagram obtained from the sequential CE enzyme assay.
为了克服上述问题,Chen等[11]提出了一种基于光快门进样技术和自制的固定化酶隔离装置联用的在线酶分析系统(见图1a和图1b),实现了高时间分辨进样的同时避免了酶反应由于无法及时停止而影响检测结果的问题。实验中为了防止固定酶进入毛细管而影响分析结果的准确性,在毛细管进样端安装了一个孔径为1 μm的不锈钢网状薄膜(见图1b)。网状薄膜可阻止酶分子进入毛细管,实现底物和酶溶液的分离进而终止酶反应。因此每次光快门进样都对应于一个酶催化反应的时间点。利用该分析系统以荧光标记的血管紧张肽为底物,建立了胰蛋白酶酶切反应和酶抑制反应的高时间分辨在线测定平台,在一次CE分析中实现了对酶促反应全程5 s高时间分辨的自动在线检测。根据底物和产物的消耗和产生,测定了胰蛋白酶的酶促反应动力学常数(见图1c),测定结果与线外反应测定结果一致,证明了该方法用于在线酶分析的准确性和可靠性。
OGPB通常与LIF检测联用,以实现高准确性的少量进样和高重复性的序列进样分析。为进一步拓展OGPB在CE在线酶分析中的应用,Liu等[12]提出了一种OGPB进样技术与商品化的紫外-可见(UV-Vis)检测器相结合的CE序列分析方法(见图2a)。该装置由氨基酸在线衍生、光门进样、CE分离、UV-Vis检测器等部分构成。在该系统中激发光只是作为漂白光实现序列进样,因此无须复杂的分光操作。光漂白作用可以使生色团化学结构发生变化,进而导致分析物的紫外吸收降低,因此漂白后的样品可利用UV-Vis进行检测。利用该系统,以天冬酰胺(Asn)和天冬氨酸(Asp)的标准混合物测试了该方法的分析性能,序列进样20次,氨基酸的峰高、峰面积和迁移时间的RSD分别为2.23%、2.57%和0.70%(见图2b),表明该方法具有良好的重复性。在L-天冬酰胺酶催化反应全程在线监测的研究中,时间分辨率可达12 s,通过同时检测底物的消耗和产物的生成,测定了L-天冬酰胺酶的米氏常数(0.25 mmol/L)(见图2c),实验结果与离线测定结果一致,表明基于OGPB-UV-Vis序列分析法可实现准确的序列进样和酶反应全程的在线监测。该方法的提出也证明了OGPB可与多种检测手段联用,拓展了OGPB进样法的适用范围。
2 基于流动门进样的CE在线酶分析
1993年,Lemmo和Jorgenson研究组[28]提出了流动门进样技术。该进样方法是将两根相距一小段间隙的毛细管同轴对齐,其中一根毛细管为引样毛细管,另一根为分离毛细管,在两根对接毛细管的垂直方向上连接一个流动泵,流动泵打开时,缓冲溶液被不断引入两根毛细管间隙,流动的缓冲溶液会将从引样毛细管中流出的样品冲走,使样品无法进入分离毛细管。进样时,关闭流动泵,让样品从引样毛细管中流出并充满两毛细管的间隙,然后以电进样方式使一小段样品进入分离毛细管;接着打开流动泵将间隙内剩余样品冲走。该技术首先被应用于二维分离系统作为进样接口,将一维分离体系的分离组分引入到二维分离系统进行电泳分离,以提高复杂样品的分离效率[29,30]。流动门进样也被应用于高速毛细管电泳中,实现pL级的进样量,以提高分离效率[31-34]。在线微渗析取样-高速毛细管电泳体系是流动门进样的另一重要研究领域[35-37],微渗析取样可实现在线、实时、连续的活体取样,流动门进样技术可将其不断引入毛细管中进行高速分离,因此该方法可实现生物体内生命过程的在线连续监测。
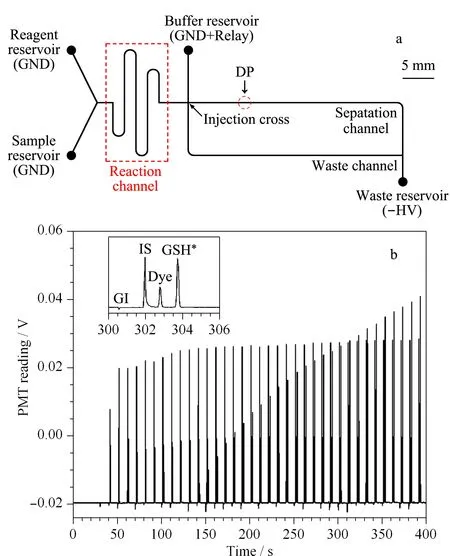
图 3 (a)流动门进样与芯片毛细管电泳联用用于在线酶分析 示意图和(b)谷胱甘肽还原酶催化酶反应中产物GSH*随酶催化反应时间的变化图[15] Fig. 3 (a) Schematic diagram of the flow-gated injection coupled to microchip electrophoresis for sequential CE analysis and (b) evolution of GSH* peaks as a function of time in the study of a glutathione reductase-catalyzed enzymatic reaction[15] GSH*: ThioGlo-1-GSH adduct; GND: ground; DP: detection point.
Wu等[15]首次将流动门进样法与芯片电泳联用(见图3 a),在线研究了谷胱甘肽还原酶的酶动力学和酶抑制动力学。该系统主要由柱前衍生、流动门进样、CE分离和LIF检测系统组成。谷胱甘肽还原酶在辅酶烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NADH)的存在下可以将氧化型谷胱甘肽(oxidized glutathione, GSSH)催化反应成还原型谷胱甘肽(reduced glutathione, GSH),实验中通过连续监测GSH浓度的变化,测定了谷胱甘肽还原酶的酶动力学和酶抑制动力学。分析开始前,先在试剂池中加入衍生试剂ThioGlo-1,在样品池中加入底物和辅酶,然后向样品池中加入一定浓度的谷胱甘肽还原酶,启动酶反应,随后酶反应溶液和衍生试剂连续的进入反应通道发生衍生反应,生成含有荧光的产物(ThioGlo-1-GSH adduct, GSH*),荧光产物通过流动门进样方法连续的引入分离通道,进行CE分离和LIF检测。利用该系统,实现了对谷胱甘肽还原酶酶反应全程10 s高时间分辨的自动在线检测,获得了谷胱甘肽还原酶的酶动力学参数(见图3b),测定结果与其他文献[38,39]报道结果一致,表明了流动门序列进样技术可用于连续监测酶反应。
3 基于二维扩散进样的CE在线酶分析
Chen等[16]在2012年提出了一种基于扩散进样实现CE序列分析的方法(见图4a)。该装置是将两根一端磨平的毛细管同轴固定于一个样品池中,毛细管间隔距离在1.5 μm左右。CE分析时,通过周期性地控制高压电源的开(样品分离)、关(扩散进样),实现准确的在线序列进样和连续CE分析。当电压开启时,样品溶液不会进入到毛细管中;当电压关闭时,由于样品池中溶液和毛细管间隙的缓冲溶液之间存在浓度梯度,因此样品各组分通过扩散作用充满毛细管间隙,待扩散一定时间后,打开电压,在电渗流作用下毛细管间隙中的样品进入毛细管中并进行分离和检测。利用该系统,以丙氨酸(Ala)和谷氨酸(Glu)的标准混合物测试了该方法的分析性能。序列进样20次,氨基酸的峰高、峰面积和迁移时间的RSD分别为1.01%、1.25%和0.80%(见图4b),表明该连续扩散进样方法具有良好的重复性。
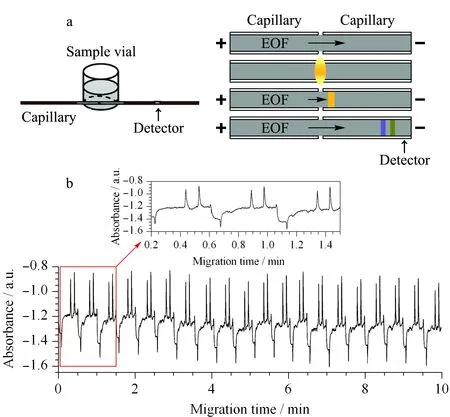
图 4 (a)二维扩散进样毛细管电泳在线连续分析装置图和(b)Ala和Glu标准混合溶液20次连续进样的电泳谱图[16] Fig. 4 (a) Scheme diagram for on-line sequential analysis by capillary electrophoresis based on two-dimension diffusion injection and (b) electropherogram for the 20 sequential analysis of Ala and Glu standard mixture[16]
Liu等[17]对上述连续扩散进样(sequential diffusion injection, SDI)的机制进行了分析。基于二维扩散进样的理论模型,在菲克第二定律的基础上,推导出绝对进样量Ainj与初始浓度C0、进样时间t和狭缝宽度d成正比。实验中采用NADH作为分析物,针对所建立的理论模型分别对影响进样量的3个因素进行了验证。实验结果表明,进样量与C0、t和d均成正比,与理论预测相一致,证明所建立的CE-SDI体系为二维扩散体系。CE中传统的扩散进样是沿着毛细管纵向的一维扩散,其进样量与进样时间平方根成正比。与之相反,在SDI体系中是沿着毛细管横向和纵向的二维扩散,其进样量与时间成正比,因此与一维扩散进样相比,SDI体系大大增加了扩散效率。
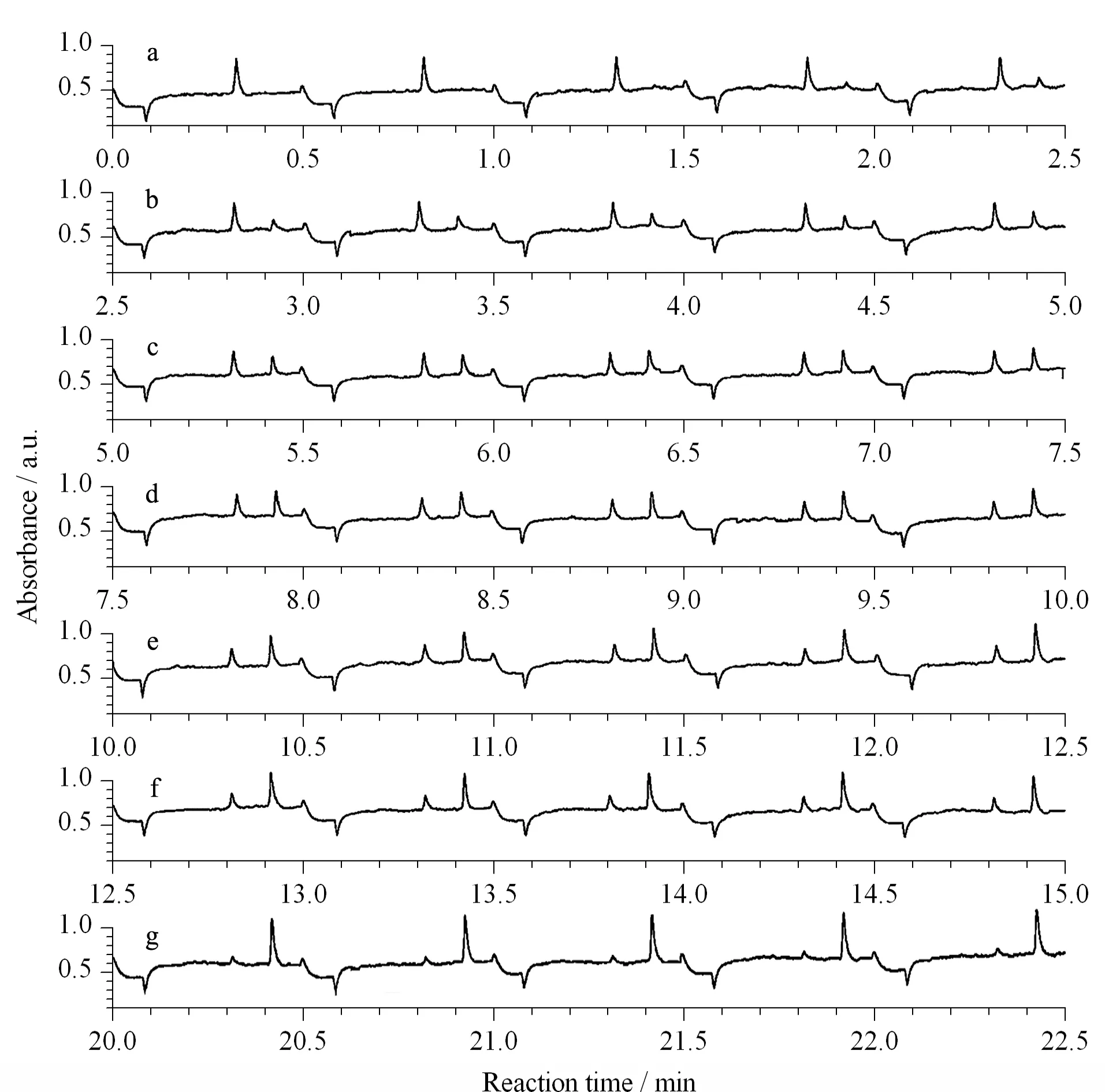
图 5 谷氨酸转氨酶催化酶反应中底物、产物峰随酶催化反应时间的变化图[16]Fig. 5 Evolution of Ala and Glu peaks as a function of time in the study of a glutamate pyruvate transaminase-catalyzed enzymatic reaction[16] Electrophoretogram of substrate and product corresponding to different enzymatic reaction time: a. 0-2.5 min; b. 2.5-5.0 min; c. 5.0-7.5 min; d. 7.5 min-10.0 min; e. 10.0-12.5 min; f. 12.5-15.0 min; g. 20.0-22.5 min.
Chen等[16]将二维SDI方法应用于谷氨酸转氨酶(glutamate pyruvate transaminase, GPT)酶反应全程的连续在线监测。分析开始前,样品池中先加入底物(Ala)和α-酮戊二酸,在毛细管中充满包含有衍生试剂(邻苯二甲醛/2-巯基乙醇)的硼砂缓冲溶液。然后,在样品池中加入GPT溶液启动酶反应,通过关闭电压一段时间(10 s),酶反应底物(Ala)和产物谷氨酸(Glu)在二维扩散作用下,进入两根毛细管的间隙,与缓冲溶液中的衍生试剂快速发生衍生反应,打开电压后,衍生后的底物和产物在电渗流的作用下进入分离毛细管中,随着电泳的进行,0.5 min内实现Ala和Glu的基线分离。通过该方法,实现了对谷氨酸转氨酶酶反应全程30 s高时间分辨的自动在线检测,获得了GPT的酶动力学参数(见图5),与传统线外反应测得数值相一致,表明二维序列进样方法可用于在线连续监测酶反应。
二维SDI还被应用于葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase, G6PDH)酶催化反应的全程连续监测[17]。实验中,固定进样时间为10 s,分析周期为40 s,连续在线检测了酶反应产物NADH的生成量随酶反应时间的变化,进而获得了其酶反应动力学常数Km,且与线外结果有很好的一致性。
在酶抑制研究方面,Liu等[18]将二维SDI应用于丙氨酸转氨酶(alanine amino transferase, ALT)催化反应酶抑制动力学的研究,研究了一种有机酸(琥珀酸)和两种传统中药(清开灵注射液和甘草酸二铵注射液)对ALT酶反应的抑制作用,得到了3种抑制剂的抑制机制和抑制动力学常数,与线外反应测得结果一致,表明该二维SDI对于在线检测酶抑制作用具有很好的可行性和准确性。
4 基于FI的CE在线酶分析
流动注射分析(flow injection analysis, FIA)是由Ruzicka和Hansen首次提出的一种新型的连续流动分析技术[40]。该技术是把一定体积的试样溶液注入一个流动的、非空气间隔的试剂溶液(或水)载流中,被注入的试样溶液流入反应盘管,形成一个区域,并与载流中的试剂混合、反应,再进入流通检测器进行测定分析及记录。FI分析系统避免了手动引入样品和试剂,因此具有进样频率高、准确度高、重线性好、可自动控制等优势。FIA自建立以来已经迅速发展为分析化学研究领域一种高效率进样及在线溶液处理手段[41,42]。FIA最初作为序列进样技术被应用于毛细管电泳分离体系中,以提高CE的进样频率和进样速度[43,44]。在FI-CE操作过程,样品先注入FI部分,然后传递到FI-CE界面,最后引入分离毛细管。进样过程可在无须移动毛细管和中断高压的情况下连续操作。一次分析过程可完成多次进样,有效提高了CE的分析速度和分析结果的准确性。由于FI-CE具有样品在线处理和序列进样分离测定的独特优势,已经被成功应用于在线反应、化学动力学参数以及食品、环境分析等多个研究领域[45]。
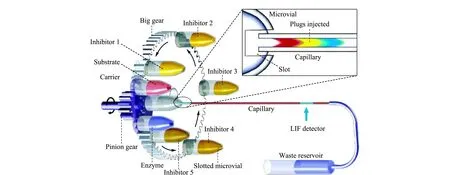
图 6 流动注射分析与CE联用系统用于酶抑制剂高通量筛选[20]Fig. 6 Schematic diagram of CE combined with flow injection system[20]
Du等[20]首次将流动注射分析与CE联用,实现了酶抑制剂的高通量筛选(见图6)。该系统包含一根6 cm长的石英毛细管,转盘式缺口试样阵列和激光诱导荧光检测系统。当毛细管尖端快速穿过试剂瓶槽口时,样品在重力作用下进入到毛细管中实现进样。转盘式缺口试样阵列上固定装有不同试剂的样品瓶,通过旋转缺口试样阵列,可以使毛细管穿过不同的试剂瓶,实现不同样品的自动序列进样。该方法具有高通量、低样品消耗、自动转换进样等优势。该系统成功应用于β-半乳糖苷酶酶抑制分析,每次测定试样和试剂消耗仅为4.2 nL,分析通量可达300 sample/h。
5 基于液滴微流控系统的CE在线酶分析
液滴微流控系统是由Quake研究组[46]于2001年提出的,该系统也被称作非连续流微流控系统,是一种由互不相溶的两相在其交界处形成相互间隔的液滴(droplet),作为反应、分析和检测的单元。在该系统中,通常采用油水间隔的方式,试样和试剂被不互溶的油相分隔在pL~nL级的液滴中。相对于连续流系统,液滴具有体积小、低扩散、无交叉污染等特点,并且具有高通量分析的独特优势。该技术已在化学合成、单细胞分析、生化检测和分离分析等方面得到了应用[47-49]。Edgar等[50]首次将液滴微流控系统与CE联用,实现了液滴中多组分的分离分析。他们采用T型通道生成油相间隔的pL级水相液滴,然后直接将其注入电泳分离通道中进行分离。采用上述系统,成功实现了异硫氰酸荧光素(FITC)标记的氨基酸混合物的分离和LIF检测。研究结果证明了液滴微流控系统与CE分离系统联用的可行性。液滴微流控系统最早在分离科学中主要被应用于两个方面:(1)作为二维分离系统的接口,以提高多维分离系统的分辨率[51,52]; (2)与在线微渗析-毛细管电泳分离系统联用实现生物体内化学过程动态监测,以提高检测的时间分辨率[53,54]。由于水相液滴内的样品被不互溶的油相分隔,液滴之间不存在分子扩散或者对流,因此液滴在长时间传输和储存过程中不会产生扩散引起的稀释问题和交叉污染问题,可真实记录样本的初始状态信息。因此,液滴系统作为接口与二维分离体系联用时,利用液滴技术可将一维分离的样品进行分集和封装,最大限度保留上一维的分辨率,然后以液滴的形式进入分离通道进行二维分离,可大大提高复杂样品的分辨率。同样的,当液滴微流控系统与微透析取样探针联用时,可将以渗析采样得到的样品以液滴间隔开,经过长时间的传输,不会发生稀释和分散,进而可显著提高微渗析分析的时间分辨率。将液滴技术应用于CE分离体系中,可实现多个样品的连续引入,可以提高CE系统的分析通量。
Pei等[21]首次将液滴技术与微芯片毛细管电泳分离系统联用,实现了酶反应的高通量分析。该芯片装置由3个分离通道和三个“K型”通道的样品进样界面组成。油相间隔的液滴连续流过疏水性主通道,两个支通道则不间断流过水相缓冲溶液,当液滴流经交叉界面时,水相样品会自动转移到连续水相缓冲溶液中,进行电泳分离。利用该分析系统,实现了GTPase酶催化反应的高通量分析。实验中,将3个酶反应时间点(0、15、30 min)的溶液预先以油相间隔的液滴形式分别封装于3根毛细管中,每个时间点的酶反应溶液形成40个体积为9 nL的液滴,然后将3根毛细管分别与芯片上3个独立的K型通道相连,实现样品进样和CE的分离检测,并在10 min内完成了120个样品的分离分析。该实验结果初步证明了液滴技术与微芯片毛细管电泳系统联用,可实现高通量的酶分析,有望进一步应用于高通量酶抑制剂筛选。
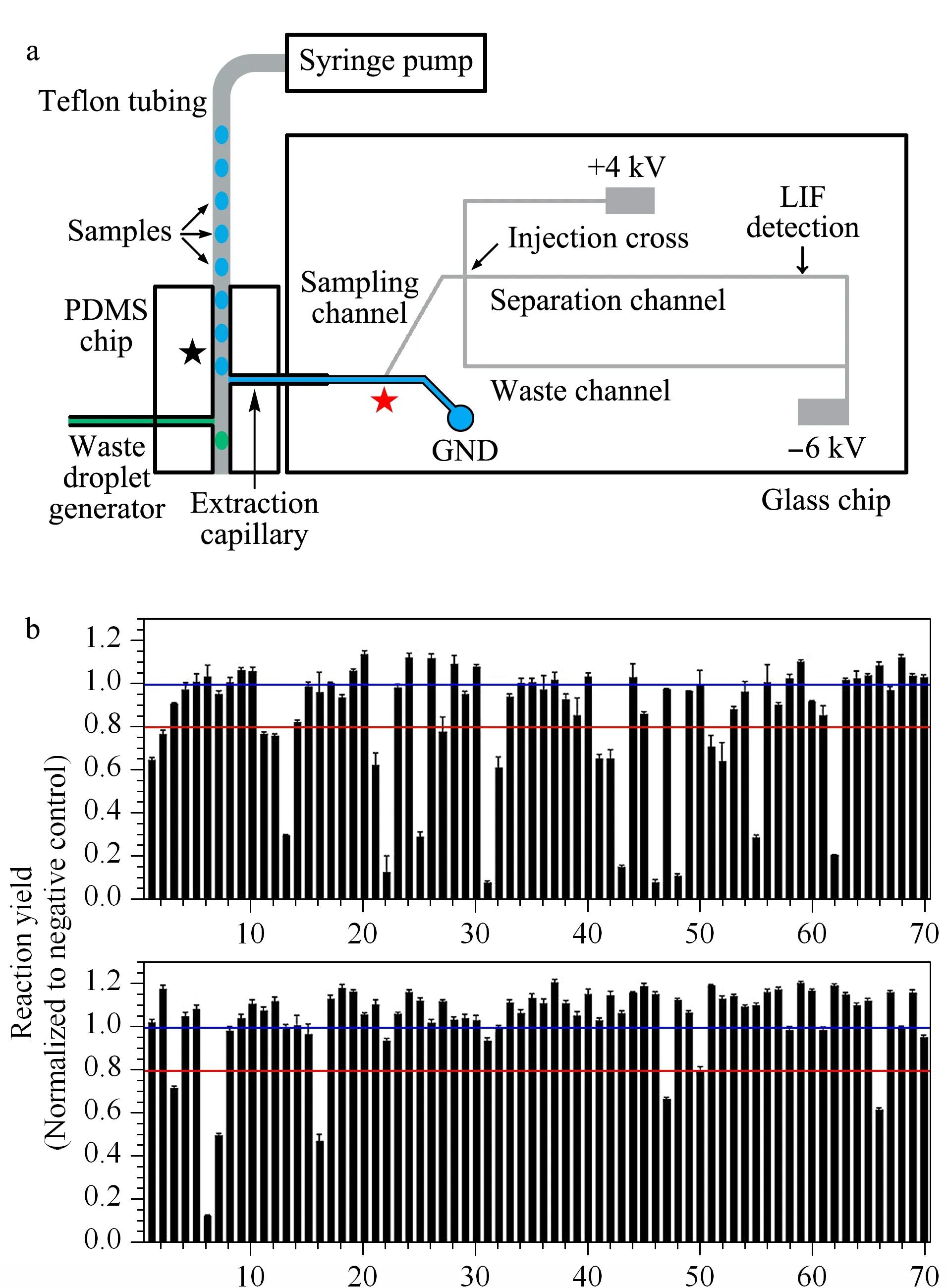
图 7 (a)聚二甲硅氧烷/玻璃复合芯片电泳装置分析液滴的示意图和(b)140种化合物对蛋白质激酶的抑制效力[22]Fig. 7 (a) Schematic of polydimethylsiloxane(PDMS)-glass hybrid microfluidic device for analysis of segmented flow samples and (b) inhibitory effect of 140 small molecules against protein kinase A[22]
2015年,Guetschow等[22]将液滴微流控系统与聚二甲硅氧烷(polydimethylsiloxane, PDMS)/玻璃复合微芯电泳联用(见图7a),实现了酶抑制剂的高通量筛选。首先将96孔板中包含有不同抑制剂的酶反应溶液以油相间隔的液滴(体积为8 nL)装载于一根聚四氟乙烯(teflon)毛细管中,然后将其与PDMS/玻璃复合芯片相连,在注射泵的驱动下,液滴顺次进入PDMS通道,其中PDMS通道与芯片分离装置上的亲水性取样毛细管正交相连,当液滴经过取样毛细管口时,水相样品被萃取,进入样品通道,而油相样品则沿疏水通道流出。样品通道内的样品再以流动门电进样方式进入分离通道实现酶底物和产物的CE分离检测。酶反应产物和底物在1 s内即可实现基线分离。该系统被应用于蛋白质激酶酶抑制剂的高通量筛选,在一次分析中测试了160种化合物(140个测试化合物、10个阳性对照和10个阴性对照)对蛋白质激酶的抑制作用,其分析通量为8 sample/min。图7b显示了140种化合物对蛋白质激酶的抑制效力,其中25种化合物对蛋白激酶有抑制作用。此外,基于液滴技术与芯片毛细管电泳联用系统也被成功应用于去乙酰化酶(sirtuin 5)酶抑制剂的高通量筛选[23,24]。
液滴微流控系统与CE分离体系联用,可实现高通量的酶分析和酶抑制剂的筛选,但是在这些研究体系中酶反应均以线外反应模式进行,酶反应完成后再将不同的样品以液滴的形式进行封装,实现了高通量分析。在以后的研究中,若能将在线酶反应与液滴生成技术及CE在线分离检测联用,有望进一步提高酶分析的分析通量。
6 序列进样CE在线酶分析的其他应用
序列进样CE在线酶分析还被应用于多肽C端测序、手性氨基酸分离和与胶束电动色谱技术联用的手性分析等方面。Tian等[13]建立了基于光快门漂白进样-激光诱导荧光检测(OGVCE-LIF)的短毛细管快速毛细管电泳装置,全程自动化在线测定了多肽羧基端的序列。利用羧肽酶Y水解法,对水解多肽释放的氨基酸进行了高时间分辨的在线序列分析,根据释放氨基酸的顺序不同得到多肽C端序列。以两个合成的N端封闭的多肽为例,利用该技术在一次CE分析中,对羧肽酶Y水解全程中所释放的氨基酸实现了时间分辨为50 s的在线测定,进而获得了多肽中的氨基酸序列。测定结果与多肽已知序列相一致,证明了该方法的准确性和可靠性。
Zhang等[14]将OGVCE-LIF分析技术用于手性氨基酸的分离并实现了D型氨基酸氧化酶(DAAO)酶动力学及抑制动力学的高时间分辨在线测定。利用OGVCE-LIF系统,实现了5对衍生的氨基酸对映体的高效快速手性分离。通过在线高时间分辨测定D型氨基酸在酶反应前后的峰高变化,不仅实现了5种手性氨基酸单独与DAAO反应时的酶分析,而且分析了多种手性氨基酸同时存在时对DAAO酶活性的影响。利用该技术,不仅检测了单一手性DAAO的酶反应动力学,同时首次研究了多种手性底物存在时的DAAO酶反应动力学。研究结果表明,OGVCE-LIF技术对于复杂的生物样品研究具有潜在的应用价值。
Fu等[19]将二维SDI与胶束电动色谱技术联用,实现了丙氨酸外消旋酶反应的全程高时间分辨在线检测。在该方法中,一方面通过周期性的关闭电压,实现了准确的在线序列进样和分离检测;另一方面,利用胶束电动色谱实现了手性丙氨酸对映体(酶反应的底物和产物)的高效分离和灵敏检测。在酶反应过程中,通过一次CE分析实现了丙氨酸外消旋酶反应时间分辨为40 s的全程连续在线检测。利用该方法,测定了D型丙氨酸→L型丙氨酸和L型丙氨酸→D型丙氨酸的酶反应动力学常数,且测定结果与传统线外酶分析测定结果一致。
7 结论和展望
毛细管电泳具有微量、快速、高效、分离模式多、可与多种检测方法联用等特点,已逐渐发展为在线酶分析的有力平台。基于序列进样技术的毛细管电泳在线酶分析,既可以实现酶反应全程的高时间分辨检测又可以实现酶抑制剂的高通量筛选,已成为了在线酶分析中的一种强有力技术手段。快速、连续、自动化的试样引入系统是基于序列进样毛细管电泳在线酶分析的重要组成部分。光快门进样、流动门进样、毛细管对接的二维扩散进样、流动注射分析或液滴微流体进样都已经成功应用于酶反应全程的在线监测或酶抑制剂的高通量筛选,大大提高了在线酶分析的分析准确性和分析通量。然而,各个序列进样技术也存在其本身的局限性,比如光快门进样对分析目标物的荧光性质的要求,流动门进样和液滴微流体进样在操作和设计的复杂性,毛细管对接的二维扩散进样对应样品扩散能力的限制等。因此仍需要开发更为简单、易操作、高精准的CE序列分析技术,进一步拓展CE技术在在线酶分析领域中的应用。此外,如何实现多酶协同反应和级联反应的高通量分析以及酶抑制剂筛选,同时兼顾各个酶反应的最适反应条件,亦是CE序列分析技术面临的挑战。这方面的研究将有望进一步拓展CE技术在酶分析和抑制反应中的应用,帮助我们更深入的了解酶活性和酶反应动力学机制,以及实现酶抑制剂的高通量筛选。
