球形红细菌降解PNP 的不同因素影响及代谢机理
2020-09-17白红娟孙慧敏
白红娟,孙慧敏,张 晴
(中北大学环境与安全工程学院,山西 太原 030051)
1 引言
对硝基酚(p⁃nitrophenol,PNP)作为重要的工业原料广泛应用于制造炸药、染料、杀虫剂、药物和合成材料等领域[1]。研究报到了有关PNP 对人、动物和真菌会产生毒性,使人和动物血液中的高铁血红蛋白含量升高,导致血液携带氧气能力下降[2];在酿酒发酵过程中酵母受PNP 诱导,会引起基因重组或进行有丝分裂[3]。美国环保署已将PNP 归为优先控制有毒污染物[4]。
目前研究报道的微生物降解PNP 的代谢途径主要有两条,一条途径是将PNP转化为4‑硝基儿茶酚再进行开环,该降解途径为偏苯三酚代谢途径(1,2,4‑Benzene‑triol,BT);另一条途径是将PNP 转化为对苯二醌,再通过对苯二酚(Hydroquinone,HQ)开环,该降解途径为对苯二酚代谢途径。已报道的Moraxella sp.[5]、Pseu⁃domonas sp.1‑7[6]和Pseudomonas sp.WBC‑3[7]菌 属均利用HQ 途径代谢,而Pseudomonas putida.[8]和Ar⁃throbacter sp.JS443[9]菌 株 利 用BT 途 径 代 谢。不 同 的微生物降解PNP 时所生成的代谢产物不同,因此,其降解途径也不同。研究具有较好环境适应性的降解菌能够为生物降解及环境修复等相关生物技术提供重要的菌种资源。
光合细菌能在厌氧光照条件下进行不放氧光合作用,特别是紫色非硫细菌如球形红细菌(Rhodobacter sphaeroides)不仅能在厌氧光照的条件下进行光能异养生长,而且能在好氧黑暗条件下进行好氧异养生长。光合细菌这种随着生存环境而灵活地改变代谢类型的特性,使其较其它微生物材料具有优越性。本课题 组 前 期 研 究 表 明[10],球 形 红 细 菌(Rhodobacter sphaeroides)H 菌 株 能 在168 h 降 解PNP 达 到91.1%,具有高效降解PNP 的作用,由于尚未系统开展该菌株对PNP 降解特性的研究,不能完全揭示其对PNP 的降解途径,同时,不同菌株降解酚类的能力与碳源[11]、金属离 子[12]和NaCl 浓度[13]等营养因素有很大关系,为此,本研究对影响球形红细菌H 菌株降解PNP 的营养因素及降解PNP 的中间产物进行研究,为完善PNP 的降解途径及其在环境中对PNP 的降解应用提供数据参考。
2 材料与实验
2.1 试剂及仪器
试 剂:对 硝 基 苯 酚(p⁃nitrophenol,PNP,纯 度98%),购自天津市凯通化学试剂公司;苹果酸、酵母膏、(NH4)2SO4均为分析纯,购自天津市科密欧化学试剂开发中心;实验用水为二次去离子水。
主要仪器:人工气候箱(KRQ‑300 型,上海德州市昊诚实验仪器有限公司);可见分光光度计(UV2100型,上海龙尼柯仪器有限公司);超声波细胞破碎仪(JY92‑II 型,宁波新芝科学器材研究所);Heal Force 高速冷冻离心机(Neofuge 15R 型,上海力申科学设备有限公司);电泳仪(DYCZ‑24A 型,北京六一生物科技有限公司);紫外分光光度计(UV2902PC 型,上海亚津电子科技有限公司);岛津高效液相质谱仪(HPLC/MS‑QP5050A 型,上海泽百机电设备有限公司)。
2.2 菌种及培养
菌 株:球 形 红 细 菌(Rhodobacter sphaeroides)H 菌株系紫色非硫菌群红细菌属光合细菌,由山西大学光合细菌研究室分离、鉴定并保存[10]。
基础培养基:苹果酸2.5 g、酵母膏1.0 g、(NH4)2SO41.25 g、MgSO40.2 g、CaCl20.07 g、K2HPO40.9 g、KH2PO40.6 g、蒸馏水1000 mL。
H 菌株驯化培养:将15%原始菌液接入PNP 含量为80 mg·L-1的驯化培养基,在30 ℃、2500 lx 人工气候箱中厌氧驯化培养10 d 作为驯化菌种。
2.3 实验方法
2.3.1 H 菌株生长及PNP 降解特性实验
(1)H 菌株降解PNP 生长动力学实验
在 含 不 同 浓 度PNP(50、80、100 mg·L-1和130 mg·L-1)的液体培养基[14],接种一定量的指数生长期的菌体培养液(OD590nm为0.182),置于光照强度为2500 lx,温度为30 ℃人工气候箱中培养,每隔24 h取样,离心10 min(8000 rpm),弃上清液,将细胞沉淀重悬于5 mL 去离子水中,在OD590nm测定生物量。
(2)不同营养因素对H 菌株降解PNP 的影响实验
a. 不同种类碳源、金属离子和NaCl 浓度对PNP降解的影响实验
在PNP 浓度为80 mg·L-1的基础培养基中接种H 菌株(OD590nm为0.182),分别考察不同碳源(蔗糖、乳糖、葡萄糖和麦芽糖)、NaCl 浓度(0、10、20、30、40 g·L-1和50 g·L-1)和 金 属 离 子(CaCl2、CuSO4、FeSO4、MnSO4、ZnSO4和KCl)对PNP 的去除及菌株生长的影响。规定条件为:碳源为苹果酸、不加NaCl 和金属离子CaCl2,实验过程中,改变1 个影响因素,固定其它2 个条件,进而确定最适的生长与降解条件。在30 ℃人工气候箱培养,7 d 后取样5 mL,在8000 rpm下离心10 min,用可见分光光度计(UV2100 型)测定上清液中残留的PNP 含量OD400nm,将细胞沉淀重悬于5 mL 蒸馏水,测H 菌株生物量OD590nm[15]。
b. 不同因素对H 菌株产生酶蛋白的影响实验
依据上节中所得结果,选取对PNP 降解率影响较大的因素,将培养好的H 菌株制备成粗酶液进行SDS‑PAGE 实验。分别在以下8 种不同的培养基中培养H 菌 株:不 添 加PNP、添 加80 mg·L‑1PNP、添 加0.07 g·L-1的FeSO4、MnSO4、ZnSO4和KCl、添 加20 mg·L‑1的NaCl、添 加2.5 g·L-1的 蔗 糖,生 物 量OD590nm约2.0 时取样。参照文献[16]的方法,制备粗酶液。将样品在8000 rpm 下离心10 min 收集H 菌株细 胞,用0.1 mol·L-1pH 7.5 的Tris‑HCl 缓 冲 液 洗 涤2 次,将其重悬于1 mL 缓冲液,在冰浴条件下超声破碎细胞,时间20 min(每次间隔3 s 破碎1 s),之后在高速冷冻离心机中10000 rpm 离心10 min,弃沉淀,上清液即为细胞粗酶液,于-20 ℃保存备用。
参照文献[17]的方法,对粗酶液中酶蛋白含量进行研究。其中实验条件为在垂直电泳装置中,加入质量浓度为12%的分离胶和质量浓度为4%的浓缩胶,在点样孔加入样品30 μL(15 µL 的样品,15 µL 的SDS上样缓冲液,煮沸2 min)。先恒压100 V 样品通过浓缩胶后再恒压120 V,电泳结束后进行考马斯亮蓝G‑250 染色,染色1 h 后,进行脱色,直到背景变清晰后进行拍照。
(3)不同酚类混合物对PNP 降解的影响实验
为研究不同酚类混合物对H 菌株降解PNP 的影响,实验选用邻苯二酚(A)、甲苯酚(B)、苯酚(C)、对苯二酚(D)进行研究,设置四个水平0、10、25和50 mg·L-1,使用SPSS 软件[18]设计L16(44)正交实验,实验方案如表1 所示,在含PNP 浓度为80 mg·L-1的基础培养基中依次添加不同酚类物质,接种一定量的指数生长期的菌体培养液(OD590nm为0.182)测定PNP 降解率。
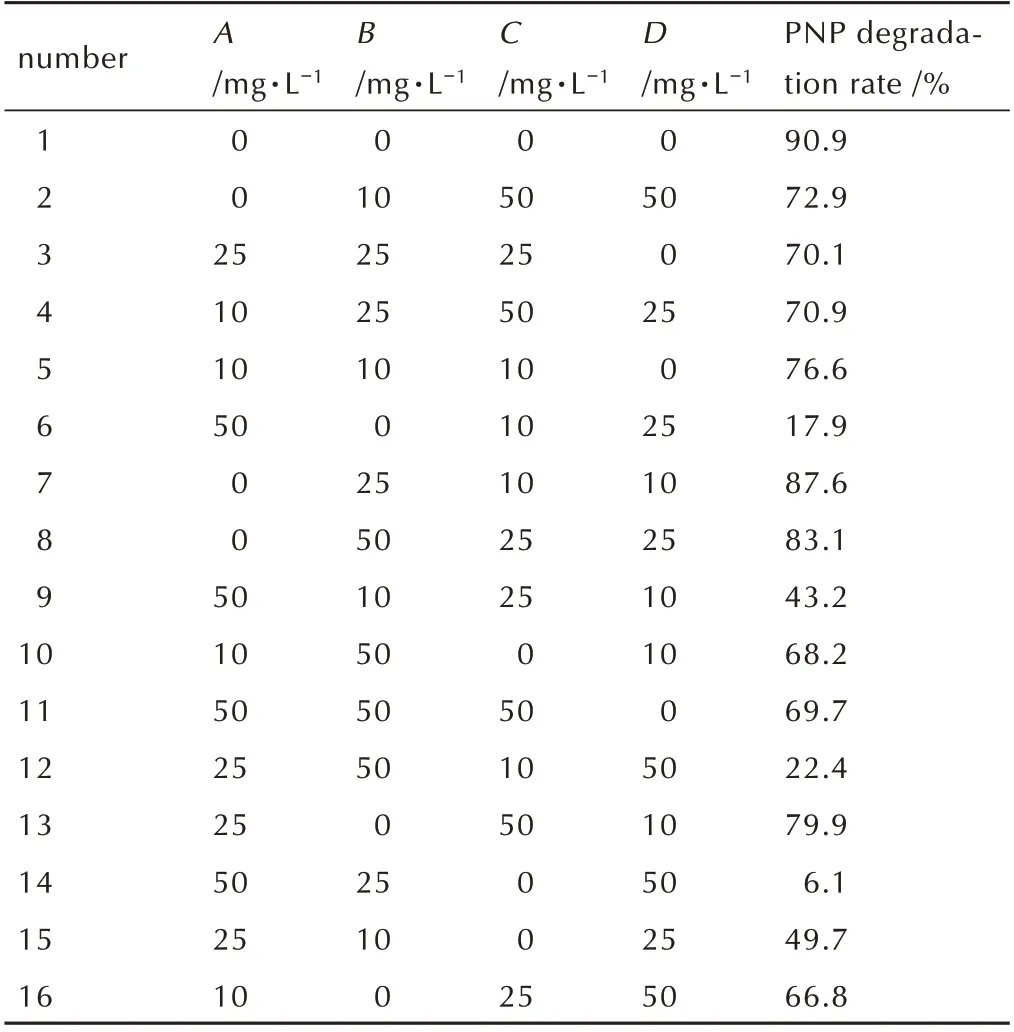
表1 不同酚类混合物对H 菌株降解PNP 影响的L16(44)正交实验设计及结果Table 1 L16(44)orthogonal experimental design and results of different phenolic mixtures on degradation of PNP by H Strain
2.3.2 H 菌株降解PNP 中间产物及酶活性测定实验
(1)H 菌株降解PNP 中间产物分离
在PNP 浓度为80 mg·L‑1的基础培养基中接种H菌株(OD590nm为0.182),在30 ℃、2500 Lx 人工气候箱中培养。H 菌株生长到对数期(OD590nm约为0.6)后,每隔24 h 取样,离心10 min(8000 rpm),取上清液倒入分液漏斗,用等体积乙酸乙酯进行多次萃取,待分层后取上层有机相,将其旋转蒸发至近干,用甲醇定容至5 mL,过0.22 μm 滤膜,利用高效液相色谱‑质谱联用仪(HPLC‑MS)检测。
(2)酶活性测定实验
在PNP 浓度为80 mg·L-1的基础培养基中接种H 菌株(OD590nm为0.182),培养至生物量OD590nm约2.0 时取样,按照2.3.1(2)b 中的方法制备粗酶液。
a. 粗酶液活性分析
反应体系中含有110 μM PNP,1.5 mM 还原性辅酶(NADH),50 mM Tris‑HCl 缓冲液(pH 值为7.0),200 µL 粗 酶 液,终 体 积 为2 mL[19]。反 应 从 加 入NADH 后开始,在30℃下反应30 min,之后在90 ℃下加热10 min 终止反应。将样品在10000 rpm 下离心10 min,利用UV2902PC 型紫外分光光度计扫描320~500 nm。
b. 对苯二酚1,2‑双加氧酶活性分析
反应体系中含有10 μL HQ 二甲基甲酰胺(DMF)溶液(50 mM),100 μL 粗酶液(预先在10 mM 的FeSO4溶液中培养1 min),50 mM 的磷酸盐缓冲溶液(pH 为7.0),终体积为1 mL[20]。反应从加入粗酶液开始,在30 ℃下反应60 min,之后在90 ℃下加热10 min 终止反应。将样品在10000 rpm 下离心10 min,利用UV2902PC 型紫外分光光度计扫描260~350 nm。
2.4 分析方法
PNP 浓度的测定:
用UV2100 型可见分光光度计测定PNP 的残留量[13]。PNP 降解率的计算公式如下:

式中,η为降解率,%;C0为初始浓度,mg·L-1;C为剩余浓度,mg·L-1。
PNP 降解中间产物检测:利用HPLC‑MS 对样品进行检测,质谱配置电喷雾电离源(ESI),以100%甲醇作为流动相,流速0.2 mL·min-1,采用直接注射进样1 μL,负离子模式进行电击,毛细管电压为3.5 kV,载气(325 ℃)为高纯氮气(99.999%),流速为8 L·min-1,产生的负离子通过扫描模式进行检测,通过Mass hunter(vA.02.00)对数据进行收集及分析[8]。
3 结果与分析
3.1 H 菌株生长及PNP 降解特性研究
3.1.1 H 菌株降解PNP 生长动力学
在不同PNP浓度(50、80、100 mg·L-1和130 mg·L-1)下,测得H 菌株生长量随时间变化如图1 所示。由图1 可知,随着底物PNP 浓度的增加,H 菌株的生长趋势逐渐变缓。

图1 不同PNP 浓度下H 菌株的生长曲线Fig.1 Growth curve of H strain under the different PNP con‑centration
建立生长动力学模型对H 菌株的理论研究和实际应用都有重要意义。参照文献[15]的方法采用Haldane 模型[21],分析PNP 浓度对H 菌株生长量的抑制作用。首先利用式(2)计算出不同浓度下对应的比生长速率,然后通过Haldane 生长抑制模型式(3),模拟H 菌株在不同初始PNP 浓度下的生长动力学过程。方程如下所示:

式 中,μ为 比 生 长 速 率,h-1;μmax为 最 大 比 生 长 速 率,h-1;S为底物饱和浓度,mg·L-1;Ks为饱和常数;Ki为抑制常数。
通过origin 8.0 软件[22]利用非线性最小二乘法对实验数据进行拟合,拟合结果如图2 所示。由图2 可以看出,随着PNP 浓度的升高,比生长速率先上升后下降,H 菌株为典型的抑制生长模式。PNP 浓度为80 mg·L-1时,比生长速率达到最大0.043 h-1;PNP 浓度大于100 mg·L-1后,比生长速率开始下降。分析原因,由于培养基中PNP 浓度过高以及代谢过程中产生有毒物质的积累,导致H 菌株的生长量递减,底物PNP 的抑制作用递增。结果表明,PNP 浓度高于100 mg·L-1,对H 菌株生长产生明显抑制作用[23]。
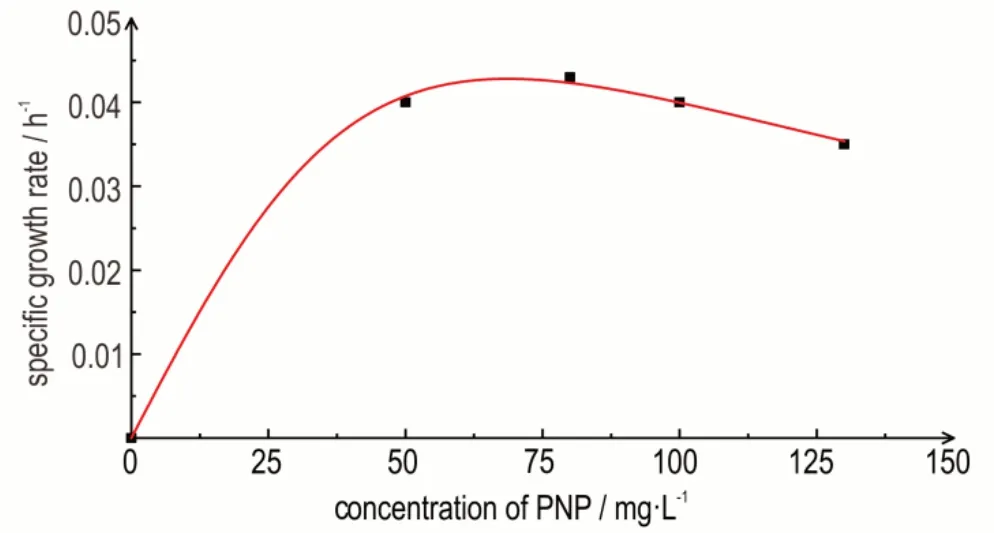
图2 PNP 为底物H 菌株比生长速率与Haldane 模型拟合曲线Fig.2 Fitting curve between specific growth rate of H strain with PNP as substrate and Haldane model
H 菌株降解PNP 过程中的细胞生长动力学参数为:最 大 比 生 长 速 率μmax为0.189,抑 制 常 数Ki为125.09 mg·L-1,半 饱 和 常 数Ks为41.56 mg·L-1,拟 合参数R2为0.999 表明Haldane 动力学模型的拟合度良好。因此,生长动力学方程为:
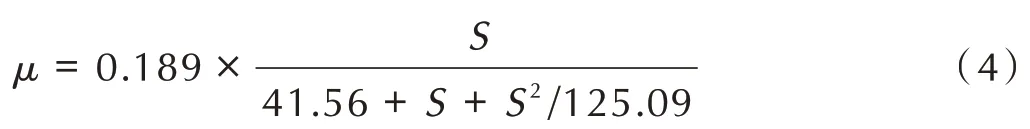
3.1.2 不同营养因素对H 菌株生长量及PNP 降解的影响
(1)不同种类碳源的影响
PNP 有毒性且苯环上存在硝基而不易被微生物降解,需要补充营养物质促进H 菌株生长和PNP 降解。为此,选用苹果酸、乳糖、葡萄糖、麦芽糖和蔗糖5种营养物质作为碳源,研究不同种类碳源对H 菌株生长和PNP 降解的影响,见图3。由图3 可以看出,添加苹果酸H 菌株降解率为91.0%,生长量OD590nm为2.151。添加不同种类碳源对PNP 降解的影响依次是:苹果酸>乳糖>葡萄糖>麦芽糖>蔗糖,降解率分别为91.0%、60.0%、31.8%、24.4%和10.6%,H 菌株生长量OD590nm分别为1.255、0.932、1.074 和1.059。表明,碳源对H 菌株生长和PNP 降解影响较大,其中蔗糖对H 菌株降解PNP 的抑制作用最强,添加苹果酸效果最佳能提高H 菌株对PNP 降解能力,提供H 菌株生长所需碳源和能源[24]。

图3 5 种碳源对H 菌株生长和PNP 降解的影响Fig.3 Effects of five nutrition factors on the degradation rate of PNP
(2)不同浓度NaCl 的影响
图4 为不同浓度的NaCl 对H 菌株生长和PNP 降解的影响,由图4 可以看出,培养基中不添加NaCl 菌株生长和降解率最好;当NaCl 浓度为10 mg·L-1和20 mg·L-1时,PNP 降解率为88.2%和60.0%,生长量OD590nm为 2.142 和 0.704;NaCl 浓 度 升 高 到20 mg·L-1后,随着浓度升高PNP 降解率逐渐下降,而生长量基本保持不变。结果表明,NaCl 浓度在10 mg·L-1以 内 对H 菌 株 影 响 较 小,NaCl 浓 度 达 到20 mg·L-1以后,降解率与NaCl 浓度呈负相关,而生长量能够维持在一定水平。因此,NaCl 浓度升至20 mg·L-1后,由于NaCl 浓度升高导致H 菌株的细胞脱水,引起蛋白质变性失活、酶蛋白减少[25],进而降低PNP 降解率。

图4 不同浓度的NaCl 对H 菌株生长和PNP 降解的影响Fig.4 Effects of different concentrations of NaCl on the growth of H strain and PNP degradation
(3)不同金属离子对H 菌株降解PNP 的影响
图5 为不同金属离子对H 菌株生长和降解PNP 的影响,由图5 可以看出,不添加金属离子的空白对照实验中,PNP 降解率为82.3%,生长量OD590nm为2.195;添加Ca2+、K+和Fe2+时,降解率分别为91.0%、88.0%和87.6%,生长量OD590nm为2.201、2.170 和2.082;与对照实验相比这几种离子不同程度促进H 菌株生长代谢。添加Mn2+时,PNP 降解率为77.4%,生长量OD590nm为1.960,比对照实验结果略低。添加Zn2+和Cu2+时,PNP 降解率分别为60.3%和15.9%,生长量OD590nm为1.422 和0.410,与对照实验相比均抑制H菌株生长代谢,并且Cu2+抑制作用更强。结果表明,不同种类金属离子对PNP 降解和H 菌株生长影响程度不同,其中Ca2+、Fe2+离子促进作用明显,与Young Gyun Cho 等人[26]研究结论一致,由于Ca2+可以提高脱氢酶活性,促进了降解中4‑HS 转变为MA,Fe2+可以提高双加氧酶活性,促进降解中HQ 转变成4‑HS,从而提高H 菌株生长和PNP 降解;Cu2+对菌株产生抑制作用明显,这与文献[27]的结果相同。
3.1.3 不同因素对H 菌株产生酶蛋白的影响
依据以上实验分别选取:碳源中对降解率抑制性最强的蔗糖,NaCl 浓度上升为20 mg·L-1降解率明显开始受到抑制,除Cu2+外的不同种类金属离子(Cu2+抑制H 菌株生长无法制备粗酶液),研究这些因素对H菌株产生酶蛋白含量的影响。图6 为不同因素下H 菌株全细胞蛋白电泳,其中M 为标准蛋白质分子量条带。由图6 可以看出,各个泳道的蛋白分子量主要分布在26~120 KD,并且条带之间存在一定差异。泳道1、5、6、7 和8 蛋白条带清晰且颜色较深,说明酶蛋白含量较高,此处与图5 中PNP 降解结果一致;泳道2、3、4 和9 蛋白条带颜色较浅,说明蛋白含量相对较少,此处与图3、4 和5 中PNP 降解结果一致。因此,不同因素会影响H 菌 株酶蛋白产量[28],进而 影响PNP 降解率。
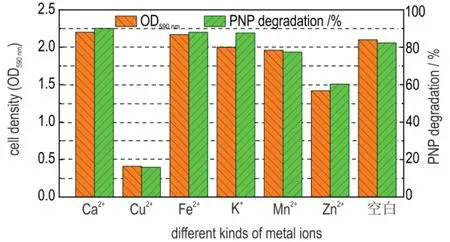
图5 不同金属离子对H 菌株生长和降解PNP 的影响Fig.5 Growth of H strain by different metal ions effect of PNP degradation
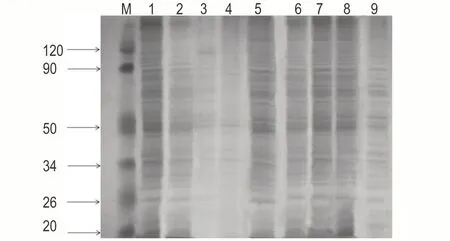
图6 不同因素下H 菌株全细胞蛋白电泳Fig.6 Whole cell protein electrophoresis of H strain underdifferent factors
应 用Image J 软 件[19]分 析 泳 道 中 分 子 质 量 为90 KD 蛋白条带的灰度值,结果如下表2 所示,泳道3和4 中灰度值(gray value)分别为6620 和2952,蛋白含量明显较少;结果表明,添加20 mg·L-1的NaCl 和蔗糖均会抑制90 KD 酶蛋白产生。

表2 不同因素下H 菌株蛋白条带灰度值比较Table 2 Comparison of gray value of protein bands of strain H under different factors
3.1.4 不同酚类混合物对H 菌株降解PNP 的影响
分析不同酚类物质对H 菌株降解PNP 的影响,选取四种酚类物质进行研究,并参考文献[29]中细菌能降解这四种物质。利用SPSS 软件[18]对正交实验结果进行分析,表3 中R2为0.993 调整后为0.982,表示实验数据与模型的拟合程度良好。概率P值(sig.)小于0.05 时说明影响显著,P值大于0.05 时说明无显著影响。因 素A、B、C和D的 概 率P值 分 别 为:0.025、0.197、0.153 和0.058,说明只有A对降解率造成了显著影响,B、C和D对降解率无显著影响。四种酚类物质对PNP 降解效率影响强弱:A>D>C>B,即邻苯二酚对PNP 降解影响显著。

表3 不同酚类混合物对H 菌株降解PNP 影响的L16(44)正交实验的方差分析Table 3 Variance analysis of L16(44) orthogonal experi‑ment on effect of nitrophenol mixture on degradation of PNP by H strain
3.2 H 菌株降解PNP 酶活性分析及代谢途径推测
3.2.1 HPLC⁃MS 检测中间产物
对H 菌株降解PNP 的样品进行HPLC‑MS 检测,得到H 菌株降解PNP 过程中产生的中间产物种类,结果见图7a。通过查阅相关文献[30-31]和化学专业数据库(Chemistry Database),根据质荷比确定中间产物种类。由图7a 可以看出,中间产物包含:对硝基苯酚(PNP)吸收峰(m/z=138.0)、对苯二酚(HQ)吸收峰(m/z=111.2)、4‑羟基粘糠酸半醛(4‑HS)吸收峰(m/z=143.0)和马来酰胺乙酸(MA)吸收峰(m/z=157.8)。图7b 为H 菌株降解PNP 的可能代谢途径(括号中的物质未检测出),由图7b 可以看出,PNP 在酶催化作用下先脱硝基生成对苯二醌,然后在还原酶的作用下对苯二醌生成HQ,HQ 在双加氧酶的作用下生成4‑HS,最后,在脱氢酶的作用下4‑HS 生成MA,最终进入TCA循环,即对苯二酚代谢途径[6]。

图7 H 菌株降解PNP 中间产物检测和可能的代谢途径分析Fig.7 Detection and metabolic pathway analysis of PNP in‑termediate degradation by H strain
3.2.2 酶活性分析
为了进一步确认H 菌株利用对苯二酚代谢途径,在以上中间产物检测分析的基础上,测定代谢过程中产生酶的活性,即:粗酶液和对苯二酚1,2‑双加氧酶活性。
(1)粗酶液酶活性分析
图8a为对照实验H 菌株未经PNP 诱导产生的粗酶液活性,由图8a可以看出,反应30 min后在400 nm 处,吸收峰值下降0.0572。图8b 为经过PNP 诱导H 菌株产生粗酶液活性测定,由图8b 可以看出,在400 nm 处吸收峰值下降0.5859。结果表明,经过PNP 诱导H 菌株产生的粗酶液可以降解PNP,粗酶液具有活性。

图8 H 菌株粗酶液活性测定Fig.8 Determination of crude enzyme activity of strain H
(2)对苯二酚1,2‑双加氧酶活性分析
进一步研究粗酶液中HQ 1,2‑双加氧酶的活性。参考文献[32]分别在0、30、60 min 检测得到如图9 结果,HQ 的最大特征吸收峰在289 nm 处,4‑HS 的最大特征吸收峰为320 nm。图9a 为对照实验未经过PNP诱导H 菌株产生的粗酶液降解HQ,由图9a 可以看出,吸收峰基本没有变化(图9a 中检测的三条曲线基本重合)。图9b 为H 菌株经PNP 诱导后产生的粗酶液降解HQ,由图9b 可以看出,随着反应的进行HQ 在289 nm 处的吸收峰逐渐向320 nm 偏移,由于反应中4‑HS 积累引起320 nm 处曲线上移,表明在对苯二酚1,2‑双加氧酶作用下HQ 转化为4‑HS。

图9 H 菌株粗酶液中HQ1,2‑双加氧酶活性Fig.9 Hydroquinone 1,2‑dioxygenase activity in crude en‑zyme solution of strain H
根据以上HPLC‑MS 测定中间产物和酶活性分析,结合相关文献报道[8]:细菌降解PNP 代谢途径可以按照革兰氏阳性菌和阴性菌进行划分,革兰氏阴性菌中多存在对苯二酚代谢途径,本研究选用的H 菌株属于革兰氏阴性菌。因此,推测H 菌株降解PNP 利用对苯二酚代谢途径。
4 结论
(1)PNP 抑制H 菌株的生长动力学符合Haldane方程(R2为0.9990),最大比生长速率μmax为0.189,抑制常数Ki为125.09 mg·L-1。
(2)不同营养因素(碳源、金属离子和NaCl 浓度)对H 菌株降解PNP 影响实验表明,苹果酸为最适碳源,Ca2+促进作用明显,NaCl 浓度高于20 mg·L-1降解率开始下降;通过SDS‑PAGE 分析酶蛋白含量,发现培养基中添加20 mg·L-1NaCl 及碳源蔗糖时,均抑制H 菌株产生90 KD 的酶蛋白。此外,四种酚类物质对PNP 降解效率影响强弱顺序为:邻苯二酚>对苯二酚>苯酚>甲苯酚,即:邻苯二酚对PNP 降解影响较显著。
(3)通过HPLC‑MS 检测出的主要代谢中间产物为:对苯二酚(HQ)、4‑羟基粘糠酸半醛(4‑HS)和马来酰胺乙酸(MA),同时,酶活性分析表明HQ 在对苯二酚1,2‑双加氧酶作用下生成4‑HS,由此推测H 菌株按照革兰氏阴性菌途径降解PNP,即:对苯二酚代谢途径。
