CL⁃20/1,4⁃DNI 共晶形成的热力学
2020-09-17董海燕龙义强周婷婷段晓惠
董海燕,龙义强,周婷婷,伍 波,段晓惠
(1. 西南科技大学环境友好能源材料国家重点实验室,四川 绵阳621010;2. 四川临港五洲工程设计有限公司,四川 泸州646003)
1 引言
含能共晶的形成对单质炸药的能量、感度、热稳定性等有显著调控作用,已成为近十年含能材料领域的研究热点。目前已报道的含能共晶有近60 种,主要包括2,4,6‑三硝基甲苯(TNT)、苯并三氧化呋咱(BTF)、六硝基六氮杂异戊兹烷(CL‑20)以及奥克托今(HMX)等系列的含能共晶,其中CL‑20 系列的含能共晶研究最为广泛。CL‑20 除了与非含能组分形成的含能‑非含能共晶[1-5]外,与含能组分形成的含能‑含能共晶就有 十 几 种[6-10],比 如CL‑20/TNT[6]、CL‑20/HMX[7]、CL‑20/BTF[8]以 及 CL‑20/1,4‑二 硝 基 咪 唑(1,4‑DNI)[9]等。目前国内外关于含能共晶的研究主要集中在共晶组分和制备方法筛选、结构表征与性能测试、分子设计以及结构与性能关系研究,对共晶形成的热力学则研究较少,从而导致对二者能否形成共晶缺乏热力学判据,无法为制备方法和工艺参数的选择及优化提供理论依据,极大限制了含能共晶的应用和发展。而从共晶的热力学研究还可得知,由共晶组分及溶剂构成的复杂体系,在不同条件下最稳定的组成及相态,从本质上阐明不同固态形式的稳定性及其相互转换关系,确立影响共晶形成及稳定存在的主要因素,比如体系的初始组成、溶剂和温度等。
共晶形成的热力学在药物领域得到了较为充分的研究[11-17],如张建军等[11-12]通过三元相图的绘制和热力学参数的计算,研究了阿德福韦酯(AD)和糖精(SAC)共结晶的热力学;通过过饱和度和诱导期等动力学参数的测定,研究了AD/SAC 共结晶的动力学,获得了溶液初始组成、溶剂和温度等关键因素对AD 和SAC 共结晶的影响。Jan Holaň 等[13]通过三元相图的构建对阿戈美拉汀/柠檬酸共晶的溶剂体系进行筛选,以改善共晶的晶体品质,提高共晶的产率。Na Wang等[14]以尿素和甲酚的同分异构体为研究对象,结合分子动力学模拟和相图分析,从Hansen 溶解度常数、溶剂化自由能以及尿素和甲酚的同分异构体分子间相互作用出发,对选择性共结晶的热力学机理进行了研究。Heiner Veith 等[15]基于物料平衡和对热力学非理想模型的校正,解释了共晶筛选的热力学方法,以获得共晶形成的最适宜溶剂和最优过程参数。尽管含能共晶形成的热力学研究目前尚未见报道,但药物领域这些研究结果可为其提供重要参考。
1,4‑DNI是一种多硝基咪唑类化合物,其撞击感度(>20 J)优于HMX(7.5 J)[18],爆轰性能(爆速8125 m·s-1,爆 压27.5 GPa)优 于TNT(爆 速7304 m·s-1,爆 压21.3 GPa)[19]。Tan等[9]以乙酸乙酯为溶剂,采用缓慢的溶剂蒸发法,得到了摩尔比为1∶1 的CL‑20/1,4‑DNI共晶。该共晶具有晶体密度高(1.922 g·cm-3)、撞击感度低(10 J)、热稳定性好(放热峰温253 ℃)以及爆轰性能(爆速9242 m·s-1,爆压39.01 GPa)优良等特性,有望作为一种高能低感共晶炸药替代HMX 在低易损性配方中得到应用。
因此,本研究以CL‑20/1,4‑DNI 共晶为研究对象,采用HPLC 法测定不同条件下共晶组分的溶解度,绘制该共晶的三元相图;采用相应的数学模型对溶解度数据进行拟合,得到共晶形成的热力学参数,确定溶剂和温度对三元相图和热力学参数的影响,以期为共结晶溶剂的筛选、工艺放大及过程参数的调控提供理论依据,所采用的理论方法和技术手段亦可推广到其它含能共晶体系。
2 实验部分
2.1 试剂与仪器
试剂:CL‑20,中国工程物理研究院化工材料研究所;1,4‑DNI,实验室自制;甲醇,乙酸乙酯,丙酮,均为分析纯,购于成都科龙化工试剂厂。
仪器:程序控温高精度低温恒温槽,CXGC‑0506型,南京舜玛仪器设备有限公司;分析天平,AL‑104型,梅特勒一托利多仪器有限公司;高效液相色谱仪,EX‑1600 型,美国億马科技(亚太)有限公司。
2.2 实验过程
2.2.1 不同溶剂中共晶组分的溶解度测定
2.2.1.1 CL⁃20 及1,4⁃DNI 的溶解度测定
依据CL‑20 在不同溶剂中的溶解度[20],选择了溶解度从大到小的三种溶剂,即丙酮、乙酸乙酯和甲醇。分别移取2.0 mL 丙酮、乙酸乙酯和甲醇于三个试样瓶中,再加入过量的CL‑20(或1,4‑DNI),置于双层夹套玻璃容器中。使用高精度低温恒温槽,以0.010 ℃的精度控制容器温度,于298.15 K 恒温搅拌24 h 使其达到溶解平衡,停止搅拌静置5 h。移取上层饱和清液通过0.22 μm 的微孔滤膜过滤,滤液用甲醇适度稀释。采用HPLC 法测定滤液中CL‑20(或1,4‑DNI)的浓度,所有样品平行测定3 次。HPLC 法的流动相为甲醇:水(70∶30,体积比),流速0.800 mL·min-1,进样体积20 μL,检测波长220 nm。。
2.2.1.2 CL⁃20 的溶解度测定
根据所测1,4‑DNI 在丙酮、乙酸乙酯和甲醇中的溶解度,分别配制成一系列浓度(0.04,0.06,0.08,0.10,0.12,0.16,0.20,0.24 g·mL-1)的1,4‑DNI 丙酮、乙酸乙酯和甲醇溶液,经0.22 μm 微孔滤膜滤过后,再加入过量CL‑20,置于双层夹套玻璃容器中。使用高精度低温恒温槽,于298.15 K 恒温搅拌24 h,待达到溶解平衡后,移取上层饱和清液通过0.22 μm 的微孔滤膜过滤,滤液用甲醇适度稀释。采用上述HPLC 法测定滤液中CL‑20 和1,4‑DNI 的浓度,所有样品平行测定3 次。
2.2.2 不同温度下共晶组分溶解度的测定
2.2.2.1 CL⁃20 和1,4⁃DN 的溶解度测定
在2.0 mL 丙酮中加入过量的CL‑20 或1,4‑DNI,密 封 后 置 于 不 同 温 度(288.15,293.15,298.15,308.15 K 和318.15 K)下的高精度低温恒温槽中,恒温搅拌24 h 使其达到溶解平衡,停止搅拌静置5 h。移取上层饱和清液通过0.22 μm 的微孔滤膜过滤,滤液用甲醇适度稀释。采用上述HPLC 法测定滤液中CL‑20 和1,4‑DNI 的浓度,每个样品平行测定3 次。
2.2.2.2 CL⁃20 的溶解度测定
根据所测1,4‑DNI 在丙酮中的溶解度,配制一系列 浓 度(0.04,0.06,0.08,0.10,0.12,0.16,0.20,0.24 g·mL-1)的1,4‑DNI 丙酮溶液,分别加入过 量的CL‑20,密封后置于不同温度(288.15,293.15,298.15,308.15 K 和318.15 K)下恒温搅拌24 h,待达到溶解平衡后,移取上层饱和清液通过0.22 μm 的微孔滤膜过滤,滤液用甲醇适度稀释,溶液中CL‑20 和1,4‑DNI 的浓度采用HPLC 方法测定,每个样品平行测定3 次。
3 结果与讨论
3.1 溶剂对CL⁃20/1,4⁃DNI 共晶热力学的影响
3.1.1 溶剂对CL⁃20/1,4⁃DNI 共晶三元相图的影响
298.15 K 下CL‑20 和1,4‑DNI 在三种溶剂中的溶解度测定结果见表1。由表1 可知,CL‑20 和1,4‑DNI在三种溶剂中的溶解度有较大差异,其由大到小的顺序为:丙酮>乙酸乙酯>甲醇,甲醇中的溶解度远小于丙酮和乙酸乙酯。此外,在前两种溶剂中,CL‑20 和1,4‑DNI 的溶解度差异较小,1,4‑DNI 约为CL‑20 的2 倍。而在甲醇中差异却很大,1,4‑DNI 的溶解度为CL‑20 的20 多倍。根据CL‑20 和1,4‑DNI 在纯溶剂中的溶解度,以及CL‑20 在不同溶剂不同浓度1,4‑DNI溶液中的溶解度,绘制得到了CL‑20、1,4‑DNI 及不同溶剂体系的三元相图,见图1。
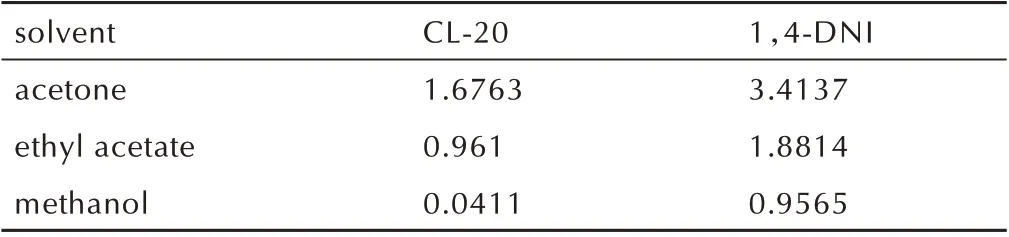
表1 CL‑20 和1,4‑DNI 在不同溶剂中的溶解度(298.15 K)Table 1 Solubilities of CL‑20 and 1,4‑DNI in different sol‑vents(298.15 K) mol·L-1
以图1a CL‑20/1,4‑DNI/丙酮的三元相图为例,测定的实验数据用“■”表示,单位为摩尔分数;不同的平衡区域由数字①~⑥代表:①不饱和溶液(单相区),②固态CL‑20 +饱和溶液(两相区),③固态1,4‑DNI+饱和溶液(两相区),④固态共晶+固态CL‑20+饱和溶液(三相区),⑤固态共晶+固态1,4‑DNI+饱和溶液(三相区),⑥固态共晶+饱和溶液(两相区)(简称共晶区域,并以橙色虚线表示)。b点和e点分别表示CL‑20 和1,4‑DNI 在丙酮中的溶解度;c点和d点是三相点,c为固体CL‑20、固体共晶以及溶液三相共存点,d为固体1,4‑DNI、固体共晶以及溶液三相共存点;f点为CL‑20/1,4‑DNI 共晶组成点。

图1 298.15 K 下CL‑20、1,4‑DNI 及不同溶剂体系的三元相图Fig.1 Ternary phase diagrams of CL‑20,1,4‑DNI and different solvent systems at 298.15 K
由图1 可知,溶剂对三元相图的影响较大。CL‑20与1,4‑DNI 在溶剂中的溶解度越大,共晶区域越大。二者的溶解度越接近,共晶区域的对称性越好。当两组分的溶解度差异显著,如298.15 K 温度下CL‑20 和1,4‑DNI 在甲醇中的溶解度分别为0.0411 mol·L-1和0.9565 mol·L-1,三元相图中共晶区域小且出现严重不对称,明显偏向溶解度较大的1,4‑DNI一侧。三种溶剂中共晶区域由大到小的顺序为:丙酮>乙酸乙酯>甲醇,且在丙酮和乙酸乙酯中对称性更好,仅稍偏向溶解度较大的CL‑20 一侧。因此,以丙酮和乙酸乙酯作结晶溶剂,溶液的初始组成为nCL‑20∶n1,4‑DNI=1∶1 有利于得到纯的共晶。当以甲醇作溶剂时,若溶液的初始组成仍为nCL‑20∶n1,4‑DNI=1∶1,则很难得到纯的共晶。这时需根 据CL‑20/1,4‑DNI/CH3OH 三 元 相 图,适 当 提 高1,4‑DNI 的比例,使结晶点位于共晶区域,以制备纯的CL‑20/1,4‑DNI 共晶。
3.1.2 溶 剂 对CL⁃20/1,4⁃DNI 共 晶 形 成 热 力 学 参 数的影响
CL‑20/1,4‑DNI 共晶在溶剂中溶解后,体系中存在如下平衡[21-23]:
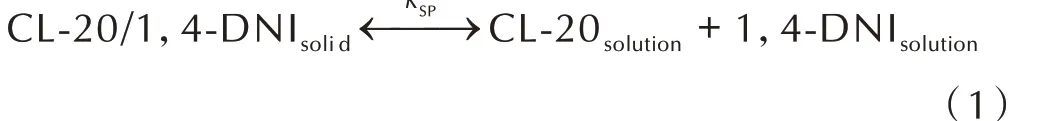
溶液中的CL‑20 和1,4‑DNI 可能发生络合作用,假设络合比例为1∶1,则溶液中还存在另一平衡:
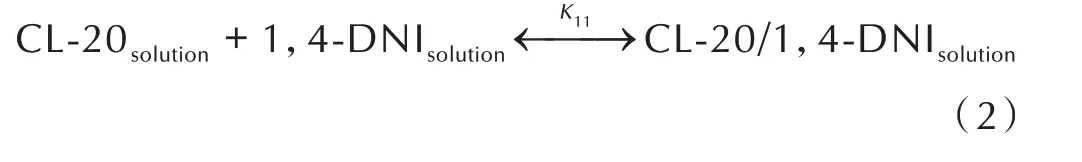
其中,Ksp为溶度积常数,K11为络合常数。根据溶液化学中的平衡理论,可推出CL‑20 在1,4‑DNI 溶液中的溶解度SCL‑20与1,4‑DNI 溶液的浓度[1,4‑DNI]之间的关系为[22]:
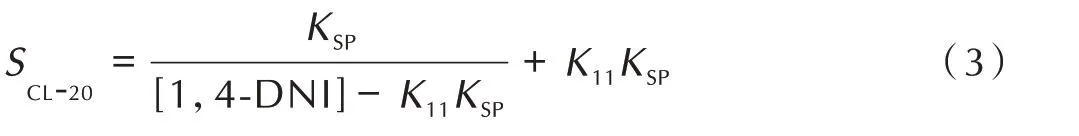
依据(3)式对2.2.1.2 节测试结果进行非线性拟合,结果见表2 和图2。
由表2可知,三种溶剂中的相关系数r2均大于0.99。从图2 也可看出,拟合曲线与测定数据吻合很好。结合表2 和图2 可说明:(1)HPLC 法对体系溶解度的测试 结 果 准 确 可 靠;(2)对nCL‑20∶n1,4‑DNI=1∶1 型 的CL‑20/1,4‑DNI 共晶,在上述三种溶剂中溶解以后,共晶组分间确实发生了1∶1 的络合作用;(3)在三种溶剂中,CL‑20 的溶解度均随1,4‑DNI 浓度的升高快速下降,随后趋于平稳。这是由于1,4‑DNI 的加入导致共晶的形成,从而降低CL‑20 的溶解度,表明共晶的形成有类似盐的同离子效应。
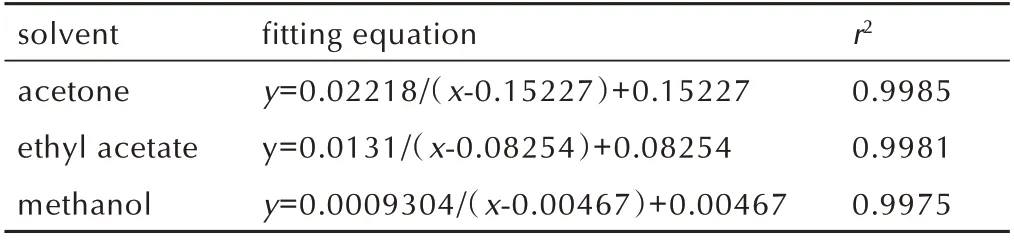
表2 CL‑20 在1,4‑DNI 溶液中的溶解度与不同溶剂1,4‑DNI溶液浓度的非线性拟合结果(298.15 K)Table 2 Nonlinear fitting results of CL‑20 solubilities in 1,4‑DNI solutions and concentrations of 1,4‑DNI solutions in different solvents(298.15 K)

图2 CL‑20 在不同溶剂不同浓度1,4‑DNI 溶液中的溶解度实测值和拟合值对比(298.15 K)Fig.2 Comparison of measured and fitted values of CL‑20 solubilities in 1,4‑DNI solutions with different solvents and concentrations(298.15 K)
共晶形成的标准自由能(ΔG0)可用来评估共晶反应的可能性,为能否形成共晶提供热力学判据[15]。CL‑20 与1,4‑DNI 形成CL‑20/1,4‑DNI 共晶的反应可表示为:

式中,S1,4‑DNI为1,4‑DNI 的溶解度,mol·L-1。由表2 的拟合结果结合式(3)和式(5),可得到298.15 K 下不同溶剂中CL‑20/1,4‑DNI 共晶形成的Ksp、K11及ΔG0,结果列于表3。

表3 不 同 溶 剂 中CL‑20/1,4‑DNI 共 晶 形 成 的 热 力 学 参 数(298.15 K)Table 3 Thermodynamic parameters of CL‑20/1,4‑DNI co‑crystal in different solvents(298.15 K)
从 表3 可 看 出,298.15 K 下 三 种 溶 剂 中CL‑20/1,4‑DNI 共晶的Ksp和K11值差异明显。其中Ksp值从大到小的顺序为:丙酮>乙酸乙酯>甲醇。因为溶度积是与共晶的溶解度正相关的参数,说明CL‑20/1,4‑DNI共晶在三种溶剂中的溶解度也遵从相同的顺序。络合常数K11反映 了溶液中CL‑20 和1,4‑DNI 相互作用的大小。丙酮中的K11最大,说明在该溶剂中CL‑20 与1,4‑DNI 的相互作用最强,则共晶更易析出。乙酸乙酯中的K11稍低于丙酮,而甲醇中的K11则比丙酮和乙酸乙酯中的小很多,表明在甲醇中CL‑20/1,4‑DNI 共晶不易析出。另外,三种溶剂中共晶反应的ΔG0均为负值,且其绝对值顺序为:丙酮>乙酸乙酯>甲醇,表明在该实验条件下,CL‑20/1,4‑DNI 共晶的形成在热力学上为自发进行的过程。
由三元相图和热力学参数的研究结果可知,在所选的三种溶剂中,丙酮是制备CL‑20/1,4‑DNI 共晶的最优溶剂。因此选用丙酮作为溶剂,进一步研究温度对CL‑20/1,4‑DNI 共晶形成热力学的影响,为确定最佳结晶温度提供理论参考。
3.2 温度对CL⁃20/1,4⁃DNI 共晶热力学的影响
3.2.1 温度对CL⁃20/1,4⁃DNI 共晶三元相图的影响
表4 给出了不同温度下CL‑20 和1,4‑DNI 在丙酮中的溶解度测定结果,图3 为不同温度下CL‑20/1,4‑DNI/丙酮的三元相图。由图3 可知,相图中各区域的大小受温度影响较为明显。温度越高,不饱和溶液的单相区域越大,而共晶区域有逐渐减小的趋势。这是由于CL‑20、1,4‑DNI 及其共晶在丙酮中的溶解度随温度升高而增加。表明反应体系的温度越高越不利于共晶的析出,降低体系的反应温度更有利于CL‑20/1,4‑DNI 共晶的形成。

表4 不同温度下CL‑20 和1,4‑DNI 在丙酮中的溶解度Table 4 Solubilities of CL‑20 and 1,4‑DNI in acetone at dif‑ferent temperatures mol·L-1

图3 不同温度下CL‑20、1,4‑DNI 及丙酮体系的三元相图Fig.3 Ternary phase diagrams of CL‑20,1,4‑DNI and acetone systems at different temperatures
3.2.2 温 度 对CL⁃20/1,4⁃DNI 共 晶 形 成 热 力 学 参 数的影响
依据式(3)对不同温度下CL‑20 在1,4‑DNI 丙酮溶液中的溶解度与1,4‑DNI 溶液的浓度进行拟合,结果见表5 和图4。
从表5 和图4 可以看出,不同温度下的相关系数r2均大于0.99,拟合曲线与实验数据吻合很好;CL‑20 的溶解度随反应温度的升高而增大,随1,4‑DNI 浓度的增加而非线性降低,随后趋于平稳。各温度下CL‑20/1,4‑DNI 共晶形成的ΔG0,Ksp及K11拟合结果见表6。

表5 不同温度下CL‑20 在1,4‑DNI 丙酮溶液中的溶解度与1,4‑DNI 丙酮溶液浓度的非线性拟合结果Table 5 Nonlinear fitting of CL‑20 solubilities in 1,4‑DNI acetone solutions and concentrations of 1,4‑DNI acetone so‑lutions at different temperatures
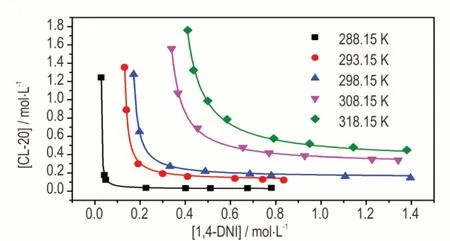
图4 不同温度下1,4‑DNI 丙酮溶液中CL‑20 溶解度的实测值和拟合值的对比Fig.4 Comparison of measured and fitted values of CL‑20 solubilities in 1,4‑DNI acetone solutions at different tempera‑tures
如表6 所示,CL‑20/1,4‑DNI 共晶形成的Ksp随温度的升高显著增大,表明共晶的溶解为吸热过程。且低温下Ksp值的降低意味着CL‑20/1,4‑DNI 共晶的溶解度降低,共晶组分与溶剂的相互作用减小,则共晶组分间的相互作用增大。K11随温度的变化趋势与Ksp相反,即温度越低K11越大,同样说明低温下CL‑20 和1,4‑DNI 之间的相互作用增强。此外,ΔG0值在不同温度下均为负值,且其绝对值随着温度的降低而逐渐升高。以上热力学参数随温度的变化趋势均说明降低温度更有利CL‑20/1,4‑DNI 共晶的形成,这与图3 三元相图的讨论结果相一致。此外,由图3 还可得到,以丙酮作结晶溶剂,溶液的初始组成为nCL‑20∶n1,4‑DNI=1∶1时,在288.15~318.15 K 范围内均可得到纯的共晶。
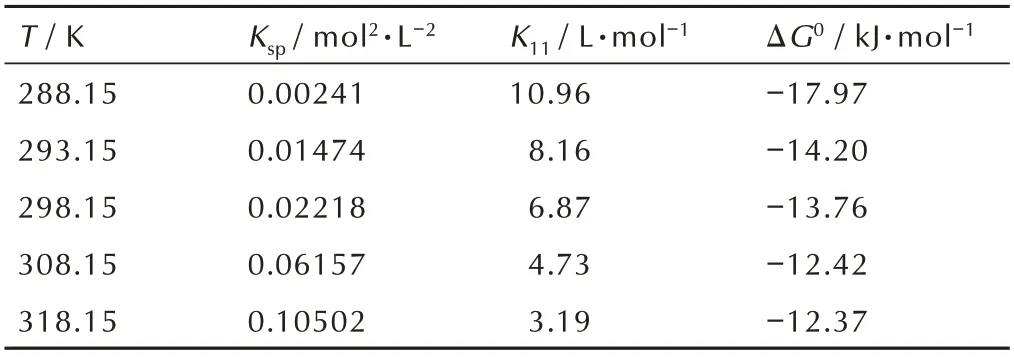
表6 不同温度下丙酮溶剂中CL‑20/1,4‑DNI 共晶形成的热力学参数Table 6 Thermodynamic parameters of CL‑20/1,4‑DNI co‑crystal in acetone solvent at different temperatures
以上研究表明,共晶形成的ΔG0值的计算对选择结晶溶剂、控制结晶温度具有重要意义。根据式(5),共晶组分的溶解度因溶剂的不同而有显著差异,它直接影响ΔG0的大小,而结晶温度通过对溶解度的影响间接影响ΔG0的大小。因此,选择合适的溶剂,并控制一定的结晶温度,促使共晶形成的ΔG0<0,首先从热力学上保证共晶形成的可能性。
4 结论
(1)以丙酮、乙酸乙酯和甲醇作溶剂,通过溶解度的测定,绘制了不同溶剂和不同温度下CL‑20/1,4‑DNI共晶的三元相图,得到了各体系的热力学稳定区域。
(2)通过分析溶剂和温度对CL‑20/1,4‑DNI 共晶三元相图的影响发现,共晶组分在溶剂中的溶解度越大且组分间溶解度差异越小,其三元相图中的共晶区域越大、形状越对称;随着温度的降低,三元相图的不饱和溶液区域变小,共晶区域变大。
(3)基于溶液化学中的平衡理论,通过对溶解度数据的拟合得到了CL‑20/1,4‑DNI 共晶形成的热力学参数。结果表明,络合常数K11和溶度积Ksp在三种溶剂中从大到小的顺序为:丙酮>乙酸乙酯>甲醇;K11随温度的升高而减小,Ksp随温度的升高而增大;不同溶剂不同温度下共晶形成的ΔG0均为负值,且其绝对值在低温和丙酮中最大。
(4)对三元相图和热力学参数的综合分析表明,CL‑20/1,4‑DNI 共晶的形成在热力学上为自发过程,丙酮溶剂和低温更有利于该共晶的析出。
