Jagged1对非小细胞肺癌细胞增殖、转移和凋亡的影响及机制研究
2020-09-16王捷张亚楠张瑜高旭辉
王捷 张亚楠 张瑜 高旭辉
非小细胞肺癌是全球最常见肺癌的重要亚型,其治疗已从传统的手术切除、放化疗发展到免疫治疗和分子靶向治疗[1];然而,有关非小细胞肺癌的发生发展的分子机制尚不完全清楚。Notch信号通路是一条进化上高度保守的信号转导系统,在调控细胞发育、增殖和凋亡等过程中发挥着重要作用,与包括非小细胞肺癌在内的多种肿瘤的发生发展关系密切[2-4]。Notch的重要配体——Jagged1在卵巢上皮癌、肾透明细胞癌和乳腺癌等多种肿瘤组织和细胞中异常高表达,且在肿瘤生长、转移和血管生成等过程中发挥着重要的调控作用[5-7]。有研究指出,Jagged1在非小细胞肺癌组织中异常高表达,且其表达水平与临床分期和淋巴结转移等有关[8,9];而靶向干扰Jagged1可抑制非小细胞肺癌A549细胞上皮间质转化[10],但其在非小细胞肺癌中的作用尚不完全清晰。因此,本研究通过体外细胞实验旨在揭示Jagged1在非小细胞肺癌细胞增殖、侵袭、迁移和凋亡中的作用,并探讨其可能的分子机制。
1 材料与方法
1.1 细胞系、试剂与仪器 肺腺癌细胞系NCI-H1975、A549和正常支气管上皮细胞系16-HBE(中科院上海细胞库),肺鳞癌细胞系NCI-H520、SK-MES-1(中科院昆明细胞库),硝酸纤维素膜(美国PALL公司),RIPA裂解缓冲液和BCA蛋白质定量试剂盒(美国Thermo Scientific公司),STAT3、p-STAT3、CyclinD1、Bcl-2、Survivin、GAPDH 和VEGF抗体(美国Santa Cruz公司),RPMI-1640细胞培养基、Lipofectamine TM 2000和RNA提取试剂盒(美国Invitrogen公司),胎牛血清和青霉素链霉素双抗(美国HyClon公司),胰蛋白酶、二甲基亚砜和MTT试剂(美国Sigma公司),山羊抗兔/鼠IgG二抗(北京中杉金桥公司),ECL试剂盒和Annexin V-FITC/PI凋亡检测试剂盒(上海碧云天),Matrigel基质胶、Transwell小室和流式细胞仪(美国BD公司),倒置相差显微镜(日本NiKon公司),酶标仪(美国Bio-Rad公司),CO2培养箱(德国Heraeus公司),凝胶成像系统(上海复日公司)。
1.2 细胞培养 将16-HBE、NCI-H1975、A549、NCI-H520、SK-MES-1细胞系接种于含100 U/ml青霉素链霉素双抗和10%胎牛血清的RPMI-1640培养基中,置于37℃、饱和湿度和5%CO2的细胞培养箱内常规培养。每2天更换新鲜培养液,待细胞铺满瓶底80%以上时,以0.25%胰蛋白酶消化,并按照1∶3比例传代。实验所有细胞为生长状况良好的第3~5代对数生长期的细胞。
1.3 Western blot检测 向待检测的细胞中加入RIPA裂解液抽提细胞总蛋白后,采用BCA法检测总蛋白的浓度。将热变性的蛋白样品行SDS-PAGE凝胶分离后,电转至硝酸纤维素膜。经5%脱脂奶粉封闭1.5 h后,加入特异性一抗于4℃下孵育24 h。洗膜后,加入二抗于室温下孵育1 h。ECL化学发光剂显影曝光后,以凝胶成像系统扫描分析,以目的条带灰度值与内参GAPDH条带灰度值的比值表示目的蛋白的相对表达量。
1.4 细胞分组与转染 实验分为3组,即对照组(正常培养)、NC-siRNA组(转染阴性对照)和Jagged1-siRNA组(转染Jagged1干扰序列Jagged1-siRNA)。将对数生长期的A549细胞以5×104个接种至6孔细胞板上,将细胞按照如上进行分组,置于培养箱内常规培养,待细胞汇合度达75%时,参照转染试剂LipofectamineTM2000说明书将siRNA按照实验分组转染至A549细胞中,转染6 h后,换新鲜培养继续培养,48 h后收集3组细胞,采用Western blot检测3组细胞中Jagged1蛋白的表达水平以评价转染效果。其中,Jagged1干扰序列Jagged1-siRNA(F:5’-GAAUGUGAGGCCAAACCUU-3’,R:5’-CCUGUAACAUAGCCCGAAA-3’)和阴性对照NC-siRNA(F:5’-UUCUCCGAACGUGUCACGUTT-3’,R:5’-ACGUGACACGUUCGGAGAATT-3’)由美国Invitrogen 公司合成。
1.5 MTT法检测 在96孔细胞板上以每孔105个密度接种对数生长期的A549细胞,培养箱内常规培养过夜。将细胞按照1.4进行分组和转染。其中,每组设置3个重复。转染6 h后,更换培养液继续培养24、48、72 h后,弃上清,每孔加入浓度为5 g/L MTT溶液 20 μl孵育4 h,再加入二甲基亚砜震荡反应至MTT结晶充分溶解后,采用酶标仪在490 nm处检测3组细胞的OD值。
1.6 克隆形成实验 在6孔细胞板上以每孔104接种转染48 h后的各组A549细胞,每组设置3个平行孔。置于细胞培养箱内常规培养,待出现肉眼可见克隆时,终止培养。以10%甲醇固定细胞30 min后,滴加0.5%结晶紫染色15 min。洗去染色液并晾干后,采用倒置显微镜观察各组细胞的克隆形成情况。将超过15个细胞作为一个有效克隆,以(克隆数/种植细胞数)的百分比表示3组细胞的克隆形成率。
1.7 Transwell小室 在24孔细胞板上以每孔105个接种对数生长期的A549细胞,于培养箱内培养24 h后,按照1.4中进行分组并转染,每组设置3个重复。转染48 h后收集各组细胞,以无血清培养基制备浓度为5×103个/ml细胞悬液。在 Matrigel基质胶包被的Transwell小室上室中加入细胞悬液100 μl,并在下室中加入含血清培养基500 μl。置于培养箱内常规培养24 h后,取出小室,使用棉签将上室中残留的细胞轻轻擦去后,以甲醛对下层细胞固定30 min,并滴加0.5%结晶紫染色15 min。洗去染色液后,采用倒置显微镜统计穿膜细胞数,结果以随机选取的5个视野内细胞数的均值表示。
1.8 划痕实验 在6孔细胞板上以每孔105个细胞密度接种对数生长期的A549细胞,于培养箱内常规培养过夜后,按照1.4中进行分组(每组3个重复)并转染。待细胞贴壁后,以移液枪枪头垂直于背部(接种细胞前每隔0.5 cm过孔画横线)横线划痕,以磷酸缓冲液洗去不再贴壁细胞后,加入无血清培养基继续培养。分别在培养0 h和24 h时间点取样,使用倒置显微镜观察细胞的迁移情况,其中以(0 h划痕距离-目标时点划痕距离)/0 h划痕距离的百分比表示细胞的迁移率,结果以随着选取的5个视野内的迁移率的均值表示。
1.9 流式细胞仪检测 胰酶消化收集转染48 h后的对照组、NC-siRNA组和Jagged1-siRNA组细胞,预冷磷酸缓冲液洗涤2次后,以结合缓冲液重悬细胞,调整细胞浓度为105个/ml。向100 μl细胞悬液中依次加入5 μl Annexin-V-FITC和5 μl PI,充分混匀后,避光反应15 min。补加上样缓冲液200 μl后,在1 h内上流式细胞仪进行3组细胞的凋亡率。实验重复3次。

2 结果
2.1 Jagged1在非细胞肺癌细胞系中的蛋白表达和转染效果 与正常支气管上皮16-HBE细胞(0.11±0.02)比较,Jagged1在肺腺癌NCI-H1975、A549和肺鳞癌NCI-H520、SK-MES-1细胞中的蛋白表达水平[(0.52±0.03)、(0.87±0.06)、(0.44±0.03)、(0.28±0.03)]均升高(P<0.05);其中,在A549细胞中最高,在SK-MES-1细胞中最低。与对照组(0.96±0.06)比较,转染Jagged1-siRNA后A549细胞中Jagged1蛋白的表达水平(0.23±0.02)降低(P<0.05);而转染NC-siRNA对A549细胞中Jagged1蛋白的表达(0.88±0.07)无明显影响(P>0.05)。见图1。

图1 Western blot检测Jagged1在非细胞肺癌细胞系中的蛋白表达;A为Jagged1在4种非细胞肺癌细胞系中的蛋白表达;B为转染后Jagged1在A549细胞中的蛋白表达
2.2 Jagged1-siRNA对A549细胞增殖的影响 与对照组比较,转染24~72 h后Jagged1-siRNA组A549细胞的OD值均明显降低,差异有统计学意义(P<0.05);同时,Jagged1-siRNA组细胞的克隆形成率明显低于对照组(P<0.05);但是,NC-siRNA组和对照组细胞的OD值及克隆形成率差异均无统计学意义(P>0.05)。见表1。
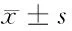
表1 Jagged1-siRNA对A549细胞增殖的影响
2.3 Jagged1-siRNA对A549细胞侵袭和迁移的影响 与对照组比较,Jagged1-siRNA组中侵袭细胞数和迁移率均明显降低(P<0.05);但NC-siRNA组与对照组之间侵袭细胞数和迁移率差异无统计学意义(P>0.05)。见表2。
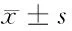
表2 Jagged1-siRNA对A549细胞侵袭和迁移的影响
2.4 Jagged1-siRNA对肺癌A549细胞凋亡的影响 对照组、NC-siRNA组和Jagged1-siRNA组细胞凋亡率分别为(5.18±1.02)%、(7.25±1.23)%和(20.36±2.45)%,3组细胞凋亡率差异有统计学意义(P<0.05);同时,Jagged1-siRNA组细胞凋亡率较对照组明显升高(P<0.05),而NC-siRNA组和对照组之间细胞凋亡率差异无统计学意义(P>0.05)。见图2。
2.5 Jagged1-siRNA对肺癌A549细胞中STAT3信号通路的影响 与对照组比较,Jagged1-siRNA组细胞中STAT3磷酸化水平及其下游相关靶基因CyclinD1、Bcl-2、Survivin、VEGF蛋白的表达水平均明显降低(P<0.05),而NC-siRNA组细胞中STAT3信号通路相关蛋白的表达无明显改变(P>0.05)。见表3,图3。
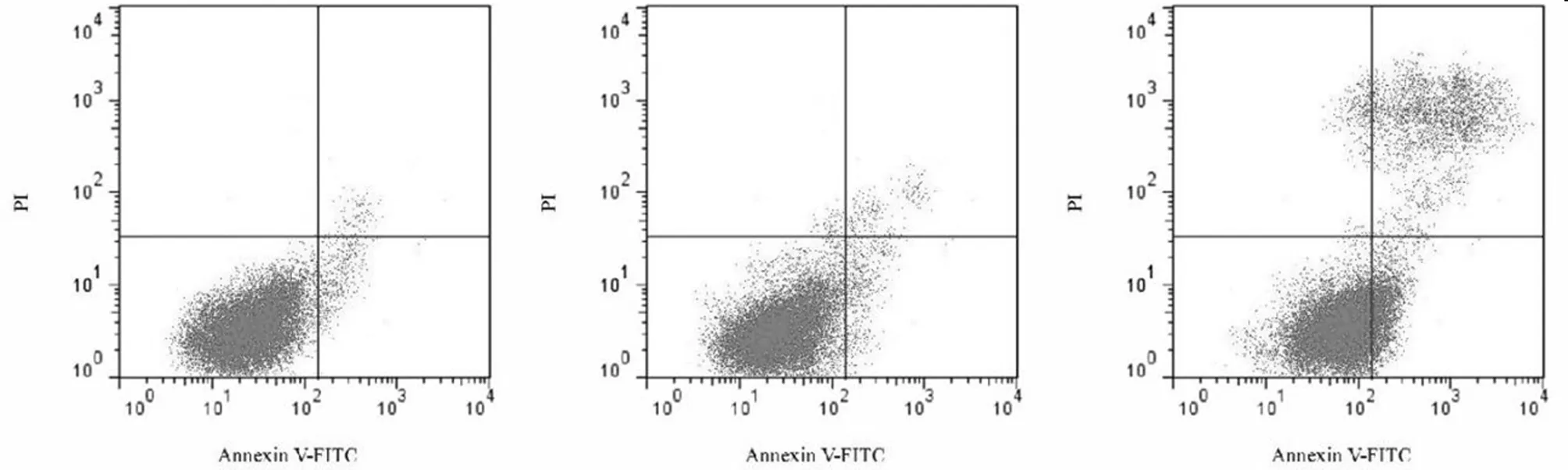
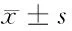
表3 Jagged1-siRNA对肺癌A549细胞中STAT3信号通路的影响

图3 Western blot检测STAT3信号通路相关蛋白的表达
3 讨论
Jagged1是在哺乳动物中第一个被证实的Notch受体的配体,可通过与邻近细胞的Notch受体的细胞外结构域结合活化Notch,与转录调节因子结合,激活靶基因,参与细胞增殖、凋亡和转移等生物学过程[8]。高表达的Jagged1与胆管细胞癌和结直肠癌等肿瘤浸润深度、有无复发和总生存时间等密切相关[11,12]。张保龙等[13]在骨髓瘤的研究中发现,下调Jagged1表达可抑制RPMI8226细胞增殖并诱导细胞周期阻滞和凋亡[13]。Hao等[14]在胶质瘤的研究中指出,敲除Jagged1表达可抑制U251细胞的转移。Hai等[15]研究指出,Jagged1通过激活NF-κB途径诱导胶质瘤起始细胞侵袭。此外,干扰Jagged1还可增强卵巢癌对顺铂化疗药的敏感性[16]。已有研究指出,Jagged1在非小细胞肺癌组织中异常高表达[8],但其具体的调控作用研究较少。本研究在肺腺癌NCI-H1975、A549和肺鳞癌NCI-H520、SK-MES-1细胞中进一步证实了Jagged1高表达,同时干扰Jagged1表达可抑制A549细胞增殖、侵袭、迁移并诱导细胞凋亡。
在胞内外致瘤信号的刺激下,STAT3信号通路异常激活可通过调控相关靶基因,促进非小细胞肺癌细胞增殖和转移[17,18]。CyclinD1是促进细胞从G1期进入S期的重要细胞周期蛋白,Bcl-2和Survivin是公认的凋亡抑制蛋白,VEGF是促进血管生长最强的调控因子,它们的启动子区均有能够与活化的STAT3高亲和结合位点,是STAT3下游的重要靶基因[19,20]。有研究证实,Jagged1可通过调控STAT3信号通路的活化影响多发性骨髓瘤细胞生长、凋亡和卵巢癌细胞迁移[21]。为了探讨Jagged1调控非小细胞肺癌A549细胞的分子机制,本研究进一步检测发现干扰Jagged1表达后A549细胞中STAT3磷酸化水平及其下游相关靶基因CyclinD1、Bcl-2、Survivin、VEGF蛋白的表达水平均明显降低。结果提示,Jagged1可能通过调控STAT3信号通路影响非小细胞肺癌的发生发展。
综上所述,Jagged1在非小细胞肺癌细胞中高表达,干扰其表达可抑制癌细胞增殖、侵袭、迁移并促进细胞凋亡,其作用机制可能与抑制STAT3信号通路的活化有关。
