C57BL/6J乳鼠心肌细胞的提取及鉴定*
2020-09-16张新会罗文龙裴汉军
张新会,罗文龙,裴汉军
(内蒙古科技大学包头医学院第一附属医院 ,内蒙古 包头 014010)
随着老龄化的人口的加剧,心血管疾病正在成为危害人类健康的最大杀手,尤其病情凶险的急性心肌梗死,可直接导致患者死亡[1]。随着生物医学的发展,在细胞水平观察心血管疾病发生及发展的机制,了解其中信号传导、凋亡、以及蛋白表达相关情况,成为治疗心血管疾病的新思路[2]。因而越来越多的生物实验研究需要原代心肌细胞的参与。高纯度的原代心肌细胞是实验成功的基础。但由于人类心肌细胞只有在特殊情况下才能少量增殖[3],并且人类心肌细胞获取困难,不能满足实验需要。目前原代心肌细胞实验以SD乳鼠心肌细胞为主。近年来SD乳鼠心肌细胞的提取技术不断优化。随着研究的不断深入与进展,C57BL/6J小鼠因和人类基因相近,从而更多的被科研使用。但相对于C5BL/6J小鼠动物模型的广泛使用,因C57BL/6J小鼠乳鼠因体型较小,乳鼠心肌细胞获得量低,C57BL/6J乳鼠心肌细胞未被广泛使用。因课题需要C57BL/6J乳鼠心肌细胞,在多次试验的基础上,对乳鼠心肌细胞提取进行改良,获得满意效果。报道如下。
1 材料与方法
1.1材料
1.1.1实验动物 新生C57BL/6J乳鼠(出生1~3 d,最好在24 h内)。由北京斯贝福生物技术有限公司购买(许可证号:SCXK(京)2019-0010),北京维通利华动物技术有限公司鉴定(实验单位使用许可证编号SYXK(京)2017-0015)。
1.1.2实验伦理 本实验研究严格遵守《实验动物管理条例》,并获得内蒙古科技大学包头医学院动物试验伦理委员会批准。
1.1.3实验试剂及设备 胰蛋白酶(含EDTA)、DMEM低糖培养基、Hanks平衡盐溶液(不含钙镁)、5-溴-2-脱氧尿核苷(Brdu)、BSA 、PBS缓冲液、tritonX-100均购自英国sigma公司;胶原蛋白酶Ⅱ型、胎牛血清均购自美国gibco公司;Anti-heavy chain cardiac Myosion抗体购自英国Abcam公司(ab50967);cy3标记山羊抗小鼠二抗购自北京碧云天生物科技有限公司;DAPI购自北京中杉金桥公司;驴血清、Tween-20、4 %多聚甲醛均购自北京索莱宝生物技术公司;青链霉素购自美国scien cell公司;超净台、细胞培养箱、离心机均购自美国thermo公司,muse细胞技术仪(德国MercK),倒置荧光显微镜(德国leica公司),200目筛网,眼科直剪、弯剪各两套,眼科直镊、弯镊各2套,滤器,注射器,烧瓶50 mL(带塞,可封闭),自制搅拌子(除去用大头针针尖,两边用小胶管套住,系紧),500 mL烧杯,磁力搅拌水浴锅(德国IKA公司)。
1.2方法
1.2.1消化酶的配置 胰蛋白酶和II型胶原蛋白酶用Hanks(不含钙镁)配置,稀释成0.06 %的胰蛋白酶及0.04 %胶原蛋白酶。
1.2.2心肌细胞的提取与纯化 取出生在1~3 d(最好出生在在24 h内)的C57BL/6J乳鼠20只,戴手套,取一只放入盛有75 %酒精容器内,约10秒钟,左手捏住乳鼠的背部,右手在乳鼠剑突下剪开皮肤,轻轻用剪刀挑开至小鼠颈部,左手轻微挤压,小鼠心脏便突出胸腔,右手用镊子快速夹取心脏,放入预冷的不含钙镁的Hanks溶液中,重复此过程直至处理完所有小鼠(最好1 h内处理完20只小鼠)。将小鼠尸体移出。更换手套,用另一套直镊和弯镊进行操作。只保留呈椭圆形的心尖部分,剔除心房,同时再次挤压心脏,挤出心腔内血液,放入新的预冷的不含钙镁的Hanks溶液中。将所有心脏修剪完毕后,放入1.5 mLEP管内,用剪刀剪碎心脏,剪成肉末状。将心脏移入50 mL烧瓶中(内有自制搅拌子)封闭烧瓶,加入10 mL 0.06 %胰蛋白酶,放入盛有水预温在37 ℃的磁力搅拌器上,将转速控制在30~40 r/min,消化10 min。将上清液去除。将10 mL 0.04 %Ⅱ型胶原蛋白酶放入烧杯,继续放入37 ℃的水中,将转速控制在30~40 r/min,消化8 min,加入10 mL 10 %胎牛血清的DMEM低糖完全培养基,中和Ⅱ型胶原蛋白酶。吸取上清液,放入50 mL离心管。加入10 mL 0.04 %Ⅱ型胶原蛋白酶继续消化,重复此步骤,约5~7次,可将所有心脏组织消化完毕。将所有上清液经过200目滤网,清除未被消化的心脏组织,收集过滤出的液体于新的50 mL离心管中。将离心管放入离心机内1 000 r/min,离心5 min,除去上清液。用6 mL 10 %胎牛血清的低糖DMEM完全培养基重悬细胞,重悬后放入直径10 cm的培养皿中。放入37 ℃,5 %CO2恒温的细胞培养箱中,静置90 min后,取出培养皿,在无菌操作台上操作,吸取培养基放入50 mL离心管内。用移液器轻轻吹打混匀,吸取20 μL加入0.4 %台盼蓝溶液20 μL,在显微镜下测定细胞成活率(死亡细胞被染成蓝色,有活力的细胞不被染色)。每个视野选取100个细胞,未被染色的细胞数,即为细胞存活率。每次数4个视野。吸取100 μL细胞悬液放入100 μL完全培养基中,混匀,在muse计数仪上计数,得出每毫升细胞数,乘以目前所获悬浮细胞液体积,就是此次所得细胞数。根据所获细胞量及要做实验的目的,调整所需细胞量。遵循以下规则,观察细胞形态(4~5)×105/mL,提取蛋白或提取RNA等操作细胞量需控制在1×106/mL,加入0.1 mmol/L Brdu,放入培养板中培养。在细胞培养箱内放置24 h后给予换液,(切记在24 h内过度晃动,切记观察次数过频繁,影响细胞贴壁,使细胞贴壁不匀,造成细胞聚集),清除没有贴壁及活力较差的细胞,同时观察细胞形态。每隔2 d换液1次。
1.2.3细胞形态观察 分别于24 h,48 h,72 h,第5 d观察细胞形态,并拍照。
1.2.4心肌细胞纯度鉴定 培养第3 d行细胞纯度鉴定,用免疫荧光法鉴定心肌细胞。具体方法如下:配置浓度为1 %BSA及的PBST,一抗为Anti-heavy chain cardiac Myosion抗体,二抗为cy3标记山羊抗小鼠抗体(带有红色荧光)。用PBS冲洗细胞2次。4 %多聚甲醛常温下固定心肌细胞10 min后,用PBS清洗细胞2次,每次5 min,加入0.25 %tritonX-100室温下透化细胞10 min,10 %驴血清封闭30 min,加入浓度为1 %BSA的PBST,稀释的一抗(1∶200),常温下摇床1 h,再次用PBS清洗细胞,避光加入1 %BSA的PBST稀释的cy3标记山羊抗小鼠二抗(1∶500),孵育1 h,加入DAPI,倒置荧光显微镜下计算心肌细胞纯度,每个视野选取100个细胞,被染色的细胞数量,即为此视野心肌细胞数,本实验共选取5个视野。
1.2.5细胞活力测定 细胞活力可以直观的从细胞搏动状态反应出来,自细胞培养48 h后,每天10:00,14:00,18:00,22:00观察第3~9 d细胞搏动情况。
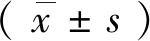
2 结果
2.1心肌细胞存活率 经台盼蓝染色,计算细胞成活率平均值在95.5 %。见表1。

表1 台盼蓝染色测定心肌细胞成活率
2.2细胞数量测定 经细胞技术仪检测,本次共获取心肌细胞9.32×106个。
2.3细胞形态及搏动情况 心肌细胞2~4 h开始贴壁24 h大部分贴壁,刚贴壁细胞呈类圆形,贴壁后逐渐伸展伸出伪足,少数可出现博动,细胞折光性能好,呈星型或梭型。72 h后细胞交织成网,相连组成合胞体,规律性搏动。第5 d后细胞密集,胞体明显增大,形成细胞簇,搏动次数更快。细胞从第3 d开始细胞搏动一致,在细胞培养2周内,搏动次数在50~130次/分,2周后细胞搏动次数较低,有时已停止搏动。见图1。
2.4心肌细胞纯度鉴定 倒置荧光显微镜下观察心肌细胞。红色为荧光标记的Anti-heavy chain cardiac Myosion抗体,蓝色为细胞核,经测定纯度平均可达94 %。见图2,表2。

表2 心肌细胞纯度鉴定结果
2.5心肌细胞活力 自第3 d开始细胞搏动次数逐渐增高,与第3 d细胞活力相比与细胞培养4~9 d相比,均具有统计学意义(P<0.01)。第6 d与第7 d活力相比,差异均具有统计学意义(P<0.05),第8 d与第7 d活力相比,差异均具有统计学意义(P<0.01)。见表3,图3。

表3 心肌细胞活力测定(n=4,次/分)
3 讨论
本实验在原有乳鼠心肌细胞提取基础上,对C57BL/6J乳鼠进行心肌细胞提取,并对原有心肌细胞提取技术进行改良。传统方法只使用胰蛋白酶,胰蛋白酶活性强,虽能也可以消化心脏组织产生心肌细胞,但细胞产量较低,心肌细胞破坏严重。Ⅱ胶原蛋白酶对心脏亲和力强,使心肌组织疏松,便于心肌细胞的分离。目前均采用胰蛋白酶联合Ⅱ型胶原蛋白酶的消化方法,消化酶用不含钙镁的溶液配置,可以保证消化酶的消化强度,不破坏消化酶酶的活性,使之能够更好的消化组织[4-6]。本实验降低胰酶浓度及胶原蛋白浓度,在保证消化酶活性的同时,尽量减少消化酶对心肌细胞的损害,促进心肌细胞的产量。为保证心肌细胞的纯度以及避免污染,建议在乳鼠剑突下剪开胸腔,避免剪开腹腔。加入自制搅拌子[5],更够加速消化酶和心脏组织充分混合,继而能够更好的消化。同时大针较细,转速度较低,避免旋转对心肌细胞造成损害,最大程度的保护心肌细胞,促进心肌细胞的产出。成纤维细胞在2h内贴壁,心肌细胞2~4h开始贴壁。因此采用差速贴壁方法,既往差速贴壁时间60~120 min不等[4-10],有研究曾分别给与差速贴壁60 min、90 min、120 min。结果60 min细胞数相比较多,但细胞纯度较90 min、120 min纯度较低。120 min纯度较90 min无差别,但细胞数目少,综上选用90 min差速贴壁效果较好。成纤维细胞可以增殖,因此用Brdu抑制成纤维细胞DNA的合成,从而抑制成纤维细胞增殖,保证心肌细胞纯度。所有试验Brdu浓度均采用0.1 mmol/L[4-10],本实验也采用了此浓度。心肌细胞内包含肌球蛋白、肌动蛋白,肌钙蛋白。故可以用三种抗体中的任意一种抗体进行鉴定,本文采用抗肌球蛋白抗体给予鉴定。为探讨心肌细胞的干预时间,对心肌细胞活性给与测定,并进行分析。通过测定心肌细胞在4~7 d,活性逐渐升高,第7 d活性最高,7 d后活性逐渐降低,因此建议心肌细胞干预实验在4~7 d内进行。
总之本研究改良了现存的乳鼠心肌提取方法,采用本方法使C57BL/6J乳鼠心肌细胞活性好,产量高,纯度高,并且给予确认最佳心肌细胞干预时间便于进一步进行心血管疾病研究。
