细胞外通量分析技术在红细胞能量代谢研究中的应用*
2020-09-16王亚奇刘瑞刚闫巧梅
王亚奇,李 姝,刘瑞刚,闫巧梅,苏 燕
(1.内蒙古科技大学包头医学院医学生物化学与分子生物学重点实验室,内蒙古 包头 014040;2.包头医学院第一附属医院检验科)
红细胞能量代谢处于细胞信息调控网络的尾端,受多种影响因素的相互协调作用,在反映细胞表型方面具有优势,且红细胞维持正常的形态结构以及在血液循环中行使生物功能也离不开能量的供应[1]。因而红细胞能量代谢研究被广泛应用到红细胞相关生命科学的各个领域[2-5]。传统的细胞能量代谢研究是通过对细胞内源代谢中间产物及终产物进行定性定量分析,揭示疾病、基因、环境等因素对细胞能量代谢的影响,并将研究结果广泛应用到疾病诊断、药物筛选、疗效监测等多个方面[6-8]。然而,传统细胞能量代谢检测方法在检测结果的连续性及动态性方面仍有欠缺。Seahorse bioscience公司利用细胞外通量检测专利技术(Extracellular Flux,XF)研发出细胞能量代谢检测仪,通过向活体细胞依次添加不同药物并利用探头连续检测细胞外耗氧率(OCR)及胞外酸化率(ECAR)的变化,评估细胞的代谢水平。应用Seahorse XFe细胞能量代谢检测仪能够保证检测过程中细胞的完整性,是传统检测方法的有效补充[9-10]。细胞外通量技术自研发以来,已被广泛应用到代谢性疾病、癌症、线粒体疾病、药物干预等领域的细胞能量代谢检测中[11-13]。红细胞作为机体血液循环的重要组成部分,其能量代谢对于红细胞自身结构功能的维持以及机体微循环稳定起着重要作用。然而,细胞外通量技术应用在红细胞方面的研究却鲜有报道。本实验拟建立细胞外通量技术检测红细胞能量代谢的检测方法,期望在红细胞能量代谢的相关研究中补充传统检测方法并在更深入的领域中得以应用。
1 对象与方法
1.1试剂与耗材 Seahorse XFe24能量代谢分析仪、Seahorse XFe24细胞培养板(01519)、Seahorse XFe24(B01419)细胞外通量检测板购于安捷伦公司。Seahorse XF水化液(0617002)、pH7.4的DMEM细胞培养液(07719010)均购于安捷伦公司;Cell-Tak Cell and Tissue Adhesive细胞粘附剂(7149006)购于Corning公司;无水葡萄糖粉(C10057614)及2-脱氧-D-葡萄糖粉(C10106023)均购于上海麦克林公司。
1.2实验方法
1.2.1实验用品预处理 包被细胞培养板:为使悬浮红细胞在检测过程中牢固粘附在细胞培养板底部,提前使用细胞粘附剂对细胞板进行包被。使用0.1 M碳酸氢钠溶液将Cell-Tak Cell and Tissue Adhesive稀释到终浓度为22.4 g/mL(Seahorse公司推荐浓度),取出XFe24细胞培养板,每孔加入50 μL Cell-Tak Cell and Tissue Adhesive稀释液,室温静置30 min后吸弃Cell-Tak Cell and Tissue Adhesive稀释液,然后向每孔加入200 μL灭菌水重复洗涤2次,晾干后盖上盖子置于冰箱4 ℃储藏备用。水化传感探头:取出XFe24 细胞外通量检测板,将传感探头板连同盖子取下,倒置于桌面上,探头涂层朝上放置以防污染。取下Hydro Booster,每个水化孔中加入1 mL水化液,将Hydro Booster置于加完水化液的检测板上,再将探头板和盖子放在Hydro Booster上,确保所有探头涂层浸入水化液中。在操作过程中,注意不要触碰探头层,所有操作完毕后将检测板放置于37 ℃温箱过夜。预热仪器及设定检测程序:实验前1 d晚上打开仪器,连接电脑上的WAVE软件,进行仪器预热处理并设定检测程序。设置3个不同药物浓度组,1组:葡萄糖和2-DG终浓度分别为10 mM、50 mM;2组:葡萄糖和2-DG终浓度分别为20 mM、100 mM;3组:葡萄糖和2-DG终浓度分别为30 mM、150 mM。设置检测时间及周期,不添加任何药物期:3 min混匀,2 min等待,3 min检测;添加葡萄糖期:3 min混匀,3 min等待,3 min检测;添加2-DG期:3 min混匀,2 min等待,3 min检测。设置完成后保存运行模板并保持开机状态到第2 d检测。
1.2.2红细胞悬液制备 实验当天采集2~4名健康人新鲜抗凝血2 mL,2 000 g离心5 min,去除血浆及白细胞后加入4 ℃生理盐水,继续离心洗涤直至上清为无色透明液体,将洗涤获得的纯红细胞混合,继续加入生理盐水洗涤获得红细胞混合液备用。取5 mL EP管加入2 mL Seahorse DMEM细胞培养液,再加入10 μL红细胞混合液形成红细胞悬液,充分混匀后用细胞计数板计数。
1.2.3XFe24细胞培养板接种红细胞 细胞计数后,在包被好的细胞培养板中分别加入10 μL、20 μL、30 μL、40 μL、50 μL、60 μL、70 μL、80 μL、90 μL、100 μL红细胞悬液,用Seahorse DMEM细胞培养液补匀,使每孔终体积均为500 μL。推荐先加入细胞培养液再加入红细胞悬液并用微量移液器吹打混匀,使细胞分布更加均匀。然后30 g、30 s对细胞培养板进行离心,以促进红细胞均匀沉降。离心后的细胞培养板在37 ℃温箱放置1 h,促进红细胞与底部粘附剂的粘合。1 h后在倒置显微镜下观察红细胞的分布状态。根据细胞分布状态计算最优细胞密度,采用最优细胞密度接种红细胞进行之后的实验操作。
1.2.4加药 称取葡萄糖干粉0.405 g溶解于750 μL的DMEM液体中,配制成3 M的葡萄糖贮存溶液,称取2-DG干粉2.1 g溶于850 μL的DMEM溶液中,配制成15 M的2-DG贮存溶液。然后利用DMEM溶液稀释葡萄糖贮存溶液至终浓度分别为100 mM、200 mM、300 mM各400 μL;同样用DMEM溶液稀释2-DG贮存溶液至终浓度分别为500 mM、1 000 mM、1 500 mM各400 μL。从温箱中取出水化好的细胞外通量检测板,检测板每个探头周围有A、B、C、D各4个加药孔。在A行A孔加入100 mM葡萄糖溶液56 μL,B行A孔加入200 mM葡萄糖溶液56 μL,C行A孔加入300 mM葡萄糖溶液56 μL。A行B孔加入500 mM 2-DG溶液62 μL,B行B孔加入1 000 mM 2-DG溶液62 μL,C行B孔加入1500 mM 2-DG溶液62 μL。使加入药物后的A行每孔检测体系葡萄糖终浓度为10 mM,2-DG终浓度为50 mM;B行每孔检测体系葡萄糖终浓度为20 mM,2-DG终浓度为100 mM;C行每孔检测体系葡萄糖终浓度为30 mM,2-DG终浓度为150 mM。
1.3上机检测 打开设置好检测模板的WAVE软件,编辑实验名称后运行检测程序,在分析仪弹出承载板时将加好药物的传感探头板去除盖子以及hydro booster,将探头板以及水化板上下放置于承载板上,并点击确认运行校正传感探头。在校正完成后,承载板会将水化板送出。将水化板取下,替换为温箱中取出去除盖子的细胞培养板,点击屏幕确认键,承载板收回检测仪内,进行细胞能量代谢检测。
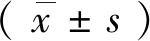
2 结果
2.1最优红细胞检测密度 在细胞培养板内加入不同体积的红细胞悬液,并在倒置显微镜下观察不同体积红细胞在细胞培养板底部的分布状态,40倍镜下观察到40 μL、50 μL、60 μL红细胞悬液组细胞分布均匀且占细胞培养板底部>95 %(图1),通过红细胞计数以及计算得到40 μL、50 μL、60 μL红细胞悬液组细胞数分别为4.39×108/well、5.27×108/well、6.15×108/well。因此,红细胞最优接种密度为(5~6)×108/well,本实验后续的最优药物浓度检测选择5.5×108/well的红细胞接种量进行实验。
2.2最佳药物作用浓度 上机检测后得到3个不同药物浓度组的ECAR值变化曲线(图2),圆点节点线条表示A行ECAR平均值的变化曲线,方块节点线条表示B行ECAR平均值的变化曲线,三角节点线条表示C行ECAR平均值的变化曲线。由图片可知,在未添加葡萄糖之前,3个药物组的ECAR值近似,添加葡萄糖后ECAR变化值很小,添加不同浓度葡萄糖后各组ECAR值增高幅度近似,在添加不同浓度2-DG后,3组不同药物浓度组其ECAR值变化不同,C组ECAR值下降最多,其次为B组、A组。
根据实验数据,可计算得到3个检测指标,(1)基础糖酵解:加入葡萄糖之前的ECAR值,代表在培养基中没有葡萄糖时红细胞的极限呼吸水平;(2)葡萄糖反应性:加入葡萄糖之后的ECAR值减去加入葡萄糖之前的ECAR值,代表红细胞对葡萄糖的吸收能力和细胞代谢活力;(3)糖酵解能力:加入葡萄糖之后的ECAR值减去加入2-DG之后的ECAR值,代表红细胞的能量代谢水平和能力(图3)。
由统计图可知,在未添加葡萄糖之前3个药物浓度组的基础糖酵解水平相近,差异无统计学意义(P>0.05)。在添加不同浓度葡萄糖后,3个组的葡萄糖反应性差异无统计学意义(P>0.05)。在添加不同浓度2-DG后,3个组的糖酵解能力有差(P<0.05)。与50 mM 2-DG组相比,100 mM 2-DG组糖酵解能力升高(P<0.05);150 mM 2-DG组与50 mM 2-DG组进行组间比较,糖酵解能力升高(P<0.05)。随着2-DG浓度增加,红细胞糖酵解能力值也随之增加。
3 讨论
红细胞作为机体血液循环的重要组成部分,在运输氧气、参与免疫反应、防御感染等方面发挥着重要作用,红细胞形态结构的维持以及生理功能的正常发挥离不开能量供应,一旦能量代谢过程发生异常将会引起红细胞病理性改变,造成机体微循环紊乱。同样,机体发生病理性变化也会引起红细胞能量代谢的变化,因此红细胞能量代谢状态可以作为疾病发生发展以及预后效果监测的手段[10,14]。以往的检测方法多为通过破坏红细胞形成溶血液,检测溶血液中某一代谢中间产物或酶的含量来判断红细胞能量代谢的变化[15-17]。但糖酵解过程复杂,每一步都受多种因素的影响,单一某一指标不能够全面反映红细胞能量变化进程,这也是传统细胞能量代谢检测方法的不足。
Seahorse细胞能量代谢分析仪能够向活体细胞添加不同药物,通过检测细胞胞外耗氧率(OCR)以及胞外酸化率(ECAR)的变化进而评估细胞能量代谢的状态,解决了传统细胞能量代谢检测方法的单一性、非连贯性,并且保证了细胞在检测过程中的活性,也使检测结果增加了动态性[12-13]。作为传统方法的补充,细胞外通量技术增加了细胞能量代谢检测结果的完整性,也被广泛应用到多个领域的研究中。然而,由于红细胞能量代谢的特点,应用细胞外通量检测技术检测红细胞能量代谢的研究报道较少。其可能原因如下:(1)红细胞结构单一,无线粒体及其他细胞器,只能进行无氧呼吸,能量代谢水平较低,仅为白细胞的1/30[18]。所以在实验过程中与其他细胞相比,红细胞的ECAR值变化并不明显。(2)红细胞为悬浮细胞,与其他贴壁细胞相比,其与细胞板底部的粘附性较差,在实验过程中,由于传感探头上下移动可能导致红细胞脱离细胞板底部,影响实验的检测结果。
本课题组着眼于红细胞能量代谢检测过程中所遇到的困难,结合相关文献资料,对Seahorse XFe24检测仪检测红细胞能量代谢的方法进行摸索。为了使悬浮红细胞在检测过程中不会漂浮起来,在细胞培养板底部铺一层细胞粘附剂增加红细胞与细胞板底部的粘附。红细胞能量代谢低,ECAR变化没有其他细胞明显,应尽可能的将红细胞铺满细胞培养板底部一层增加其ECAR变化,而不会因多余的未与底部粘附剂结合的细胞在检测过程中漂浮影响检测结果。在检测过程中,向红细胞分别添加葡萄糖和2-DG两种药物,葡萄糖是红细胞能量代谢的原料,红细胞摄取葡萄糖后产生的乳酸使传感探头与细胞培养板底部形成的检测微室溶液酸碱度发生变化。溶液酸碱度细微变化能被传感探头检测到并形成ECAR结果。2-DG是葡萄糖的类似物,在添加足量2-DG后,红细胞摄取2-DG从而抑制了红细胞对葡萄糖的利用,但红细胞不能利用2-DG产生乳酸,因此在添加2-DG后,探头所检测到的ECAR值又会下降。通过添加不同浓度的葡萄糖和2-DG获得红细胞动态ECAR值,通过计算得到基础糖酵解、葡萄糖反应性以及糖酵解能力3个不同的值。结合图3分析,红细胞对葡萄糖的摄取及利用有一定的限度,红细胞的葡萄糖反应性并不会随着葡萄糖浓度的增加而增加。50 mM 2-DG组添加2-DG后的ECAR值仍大于其未添加葡萄糖之前的ECAR值,说明50 mM 2-DG不能完全抑制红细胞对葡萄糖的利用,仍有少量的糖酵解在进行,而100 mM 2-DG组添加2-DG后的ECAR值小于其未添加葡萄糖之前的ECAR值,说明100 mM 2-DG可以完全抑制红细胞对葡萄糖的利用,红细胞不能进行糖酵解,且随着2-DG浓度的增加,对糖酵解的抑制作用越明显。在后期的红细胞能量代谢相关实验中选择10 mM的葡萄糖以及100 mM的2-DG,红细胞检测密度为(5~6)×108/well进行实验可以获得较好的实验结果。
本实验采用仪器为Seahorse XFe24,最终检测结果仅适用于Seahorse XFe24的红细胞能量代谢检测操作。不同型号的Seahorse XFe细胞能量代谢检测仪检测孔数,检测孔体积、加药量及最终的检测体系不同,其他仪器具体实验操作方法及药物添加需要结合实际实验条件进行,本实验的过程可供参考。细胞外通量检测技术与传统能量代谢检测方法结合,可以更好的了解红细胞能量代谢状态[19]。在红细胞基础研究、血液储存、红细胞相关疾病以及更深入的研究中均可以应用此方法获得更加全面、更具动态性的检测结果。
