肠膜明串珠菌乳糖及半乳糖代谢差异性研究
2020-09-16安东妮张春雪谭冬梅刘小鸣赵建新
安东妮,张 兰,张春雪,谭冬梅,吴 怡,刘小鸣*,赵建新,张 灏,陈 卫
(江南大学食品学院,江苏 无锡 214122)
肠膜明串珠菌(Leuconstoc mesenteroides)是乳酸菌明串珠菌属的重要菌种之一。肠膜明串珠菌有4 个亚种[1],其中作为可食用菌种之一的肠膜亚种具有产酸快、风味佳、抑菌性强等优良的发酵特性[2-6],是乳制品混菌发酵体系中常见的组成菌株之一[7-11],其以双乙酰、醋酸和乙醇为主的代谢产物有助于改善风味[12-14],其胞外多糖也有利于提高发酵乳制品品质[15]。
乳糖是牛乳中的主要碳水化合物,半乳糖是乳糖分子的组成单元,乳酸菌的乳糖及半乳糖代谢能力是其在发酵乳制品中应用的关键影响因素之一[16]。目前,对乳糖代谢的研究表明,乳酸菌中存在2 条乳糖代谢通路[17]:一条是通过磷酸转运系统(phosphotransferase systems,PTS)摄入乳糖,经塔格糖-6-磷酸(tagatose-6-phosphate,T6P)途径进行转化代谢;另一条是通过乳糖透性酶摄入乳糖,经Leloir途径进行水解代谢,且上述代谢途径已可用基因编码进行注释[18]。
肠膜明串珠菌是专一性的异型发酵乳酸菌[19],借助渗透酶吸收碳水化合物,在对底物不加修饰的情况下,将碳源从细胞外转移到细胞内。在β-半乳糖苷酶的作用下,进入细胞内的乳糖被降解为葡萄糖和β-D-半乳糖,葡萄糖进入磷酸戊糖途径,被转化为6-磷酸葡萄糖并进行降解,形成6-磷酸果糖,在磷酸葡萄糖异构酶的作用下进一步分解为3-磷酸甘油醛和磷酸二羟丙酮;3-磷酸甘油醛进入糖酵解途径被转化为丙酮酸,丙酮酸则在D-乳酸脱氢酶的作用下被转化为D-乳酸[17]。肠膜明串珠菌还可以通过Lelior途径代谢半乳糖,即半乳糖在半乳糖变旋酶、半乳糖激酶、UDP-半乳糖差向异构酶等酶的作用下,经过一系列生化反应合成胞外多糖。
肠膜明串珠菌不仅可以利用乳糖进行发酵,还可以利用蔗糖等多种碳水化合物进行发酵。鄢明辉[20]通过蔗糖利用率评价肠膜明串珠菌BD3749生长状况,结果表明,肠膜明串珠菌在含蔗糖的番茄汁中可以生长产酸,且能大量合成胞外多糖。于艳婷等[21]利用肠膜明串珠菌进行糙米乳乳酸发酵,研究其生长特性,结果表明,该菌株能利用糙米乳中的糖类发酵产乳酸,且确定了产乳酸的最佳发酵条件为接菌量5%、发酵温度30 ℃、培养时间22 h。旭日花等[22]对分离自通辽市牧民家庭乳样的61 株乳酸菌进行研究,从中筛选出2 株肠膜明串珠菌葡聚糖亚种发酵糖的能力较强。
本研究选取8 株肠膜明串珠菌,测定它们在以乳糖、半乳糖、葡萄糖为单一碳源的化学限定培养基(chemically de fined medium,CDM)和脱脂乳中的生长及产酸情况,并探究不同肠膜明串珠菌在乳糖及半乳糖代谢能力方面的差异性,旨在为肠膜明串珠菌在发酵乳制品中的应用提供一定的理论与应用依据。
1 材料与方法
1.1 材料与试剂
胰蛋白胨、酵母粉、牛肉膏、无水葡萄糖、柠檬酸氢二铵、吐温-80、CH3COONa、MgSO4·7H2O、MnSO4·3H2O、K2HPO4·3H2O、琼脂粉、脱脂乳粉、丙氨酸、精氨酸、天冬酰胺、半胱氨酸、天冬氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸、缬氨酸、烟酸、泛酸、吡哆醛、核黄素、对氨基苯甲酸、叶酸、氰钴胺、生物素、硫胺素、腺嘌呤、鸟嘌呤、肌苷、黄嘌呤、乳清酸、尿嘧啶、胸腺嘧啶(均为分析纯) 国药集团化学试剂有限公司。
实验菌株信息如表1所示。
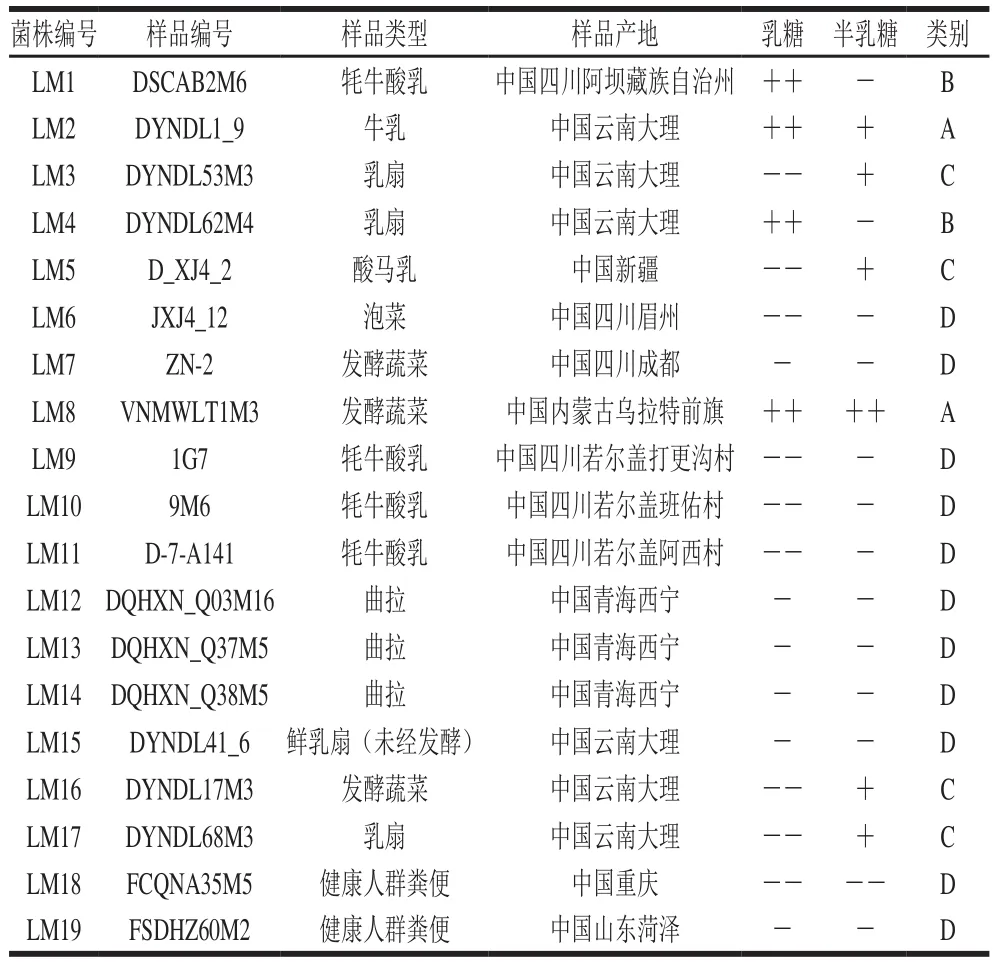
表1 实验菌株信息Table 1 Information on strains used in this study
分别测定19 株肠膜明串珠菌在CDM-乳糖和CDM-半乳糖培养基2 个环境下的OD600nm和pH值变化情况,并根据培养12 h后OD600nm的大小判别其对乳糖及半乳糖利用能力的强弱(OD600nm越大,表示对乳糖或半乳糖的利用能力越强),分为4 个类别,分类情况见表1。A、B、C三类中分别选取生长特性最为突出的2 株菌作为实验菌株,即LM1、LM2、LM3、LM4、LM5、LM8;D类考虑到生长情况太弱不利于指标检测及后续研究,故选择对乳糖和半乳糖利用情况较差的2 株菌作为实验菌株,即LM6、LM7,共选择8 株肠膜明串珠菌作为实验菌株。
1.2 仪器与设备
UV-1800紫外-可见分光光度计 岛津仪器(苏州)有限公司;3020酶标仪 美国Thermo Fisher Scientific公司;ST3100 pH计 奥豪斯仪器(常州)有限公司;MK-20干式恒温器 杭州奥盛仪器有限公司;HWS-150恒温恒湿培养箱 上海森信实验仪器有限公司;GR60DA立式自动压力蒸汽灭菌锅 致微(厦门)仪器有限公司;SW-CJ-1FD超净工作台 苏州安泰空气技术有限公司。
1.3 方法
1.3.1 试剂配制
MRS培养基:参照Wu Qinglong等[17]的配方配制;CDM培养基:参照文献[23-25]配方配制。CDM培养基完全溶解后将pH值调至6.5左右,经过滤灭菌后保存于4 ℃备用,其他培养基在使用前均于115 ℃中灭菌20 min,脱脂乳使用前于105 ℃灭菌10 min。
1.3.2 菌株活化
实验前菌株需在MRS培养基中活化3 代,第1代从保菌管中蘸取菌液,涂布于MRS固体平板上,划线分离,30 ℃培养24 h;第2代挑取单菌落至MRS液体培养基,30 ℃培养24 h;第3代按体积分数2%接种于MRS液体培养基中,30 ℃培养12 h。
1.3.3 菌株在CDM中的生长特性测定
将活化后的菌液按体积分数2%分别接种于CDM-乳糖、CDM-半乳糖、CDM-葡萄糖、CDM-无糖液体培养基中,置于30 ℃培养箱中培养,每隔2 h取样测定pH值和OD600nm,测定0、2、4、6、8、10、12 h菌株的生长及产酸情况。每隔6 h取样测定活菌数,测定0、6、12 h的活菌数变化。
1.3.4 菌株在脱脂乳中的生长特性测定
将活化后的菌株按体积分数2%分别接种于11 g/100 mL脱脂乳中,置于30 ℃培养箱中培养,每隔2 h取样测定pH值及活菌数,测定0、2、4、6、8、10、12、14、24 h菌株生长、产酸及活菌数变化情况。
1.3.5 各菌株与乳糖、半乳糖代谢相关基因的差异性分析
在KEGG网站查询肠膜明串珠菌的乳糖及半乳糖不同代谢途径相关基因数量并进行差异性分析。
1.4 数据处理
各实验均设2 组平行实验,实验结果以平均值±标准差表示,采用Origin软件绘图。
2 结果与分析
2.1 菌株在不同碳源的CDM培养基中的生长特性
2.1.1 菌株在CDM-乳糖培养基中的生长特性
由图2~4可知,实验菌株在以乳糖为单一碳源的CDM培养基中生长状况可分为2 类:一类能够稳定生长(LM1、LM2、LM4、LM8),培养12 h后其OD600nm均大于0.500,pH值均降低至5以下,活菌数差异较大;一类几乎不利用乳糖产酸,仅能维持基本生长,培养0~12 h的OD600nm增长均不超过0.100,pH值也只下降了0.1~0.2。其中,菌株LM1培养12 h后的OD600nm高达1.240,pH值降至4.44;菌株LM8培养12 h后的OD600nm高达1.132,pH值降至4.71;发酵终点时,菌株LM1、LM2和LM4的活菌数超过8 (lg(CFU/mL)),菌株LM8的活菌数低于8 (lg(CFU/mL))。说明菌株LM1、LM2和LM4可以很好地利用乳糖生长繁殖,且在发酵12 h后未进入衰退期,菌株LM8可以很好地利用乳糖产酸,发酵12 h后可能已经进入衰退期。由此可知,不同肠膜明串珠菌在以乳糖为单一碳源环境中的生长及产酸情况存在很大差异。
2.1.2 菌株在CDM-半乳糖培养基中的生长特性
由图5~7可知,实验菌株在以半乳糖为单一碳源的CDM培养基中的生长情况仍可大致分为2 类。以发酵终点pH值是否降至6.0以下为界,一类能够稳定生长(LM2、LM3、LM5、LM8),至发酵终点仍未进入稳定期,其中,菌株LM2生长情况最佳,培养12 h的OD600nm达0.508,pH值降至5.33;菌株LM5培养12 h的OD600nm为0.478,pH值降至5.56;菌株LM8培养12 h的OD600nm为0.478,pH值降至5.54;菌株LM3的生长情况稍次于上述3 株菌,培养12 h后OD600nm为0.299,pH值降至5.85。另一类菌株几乎无法利用半乳糖(LM1、LM4、LM6、LM7),仅能维持基本生长,培养8 h后进入稳定期,培养12 h后OD600nm的增长不超过0.200,pH值均高于6.0,活菌数差值小于1 (lg(CFU/mL))。半乳糖环境中的优势菌与乳糖环境下的优势菌相比,生长情况较弱,发酵终点时其OD600nm均小于0.600,且pH值均未降至5.0之下。
2.1.3 菌株在CDM-葡萄糖培养基中的生长特性
由图8~10可知,所有实验菌株在以葡萄糖为碳源的CDM培养基中均可生长,但是pH值及OD600nm的变化幅度不同:培养12 h后,菌株LM2 OD600nm最小,为0.853,菌株LM7 OD600nm最大,达到1.864,远高于其他菌株;菌株的产酸能力也有显著提升,发酵终点时pH值均降低至5以下,菌株的产酸能力也有差异,其中菌株LM7产酸能力最强,培养12 h后pH值下降至4.17,菌株LM4产酸能力最弱,培养12 h后pH值下降至4.67;菌株培养12 h后的活菌数均超过8 (lg(CFU/mL)),其中生长活力最强的菌株LM7超过9 (lg(CFU/mL)),明显强于在乳糖、半乳糖环境中的生长情况。表明菌株LM7生长量较大、活力较强。
2.2 菌株在脱脂乳中的生长特性
由图11~12可知,30 ℃培养条件下,8 株肠膜明串珠菌在脱脂乳中培养8 h后进入稳定期,24 h后,pH值均未降至6.0以下。其中产酸能力最强的为菌株LM2,发酵终点处pH值降至6.08,与发酵初始相比下降0.54,这可能是由于菌株LM2乳糖利用能力较强;其次为菌株LM1,发酵终点pH值为6.12,与发酵初始相比下降0.49;而菌株LM3、LM5和LM8培养24 h后pH值下降幅度不超过0.20。实验菌株活菌数整体呈先迅速上升再缓慢增长后逐渐稳定,说明实验菌株在脱脂乳环境下能够较好地生长,但产酸情况不佳。其中,菌株LM1和LM2的产酸能力较强,培养24 h后菌株LM2和LM6的活菌数最多,而活菌数从开始培养到发酵终点增加最多的是菌株LM1和LM6。
2.3 根据基因预测菌株对乳糖和半乳糖的利用情况

表2 8 株肠膜明串珠菌乳糖及半乳糖不同代谢途径(及相关酶)相关基因数量Table 2 Number of genes related to lactose and galactose in different metabolic pathway (and related enzymes) in 8 strains of L. mesenteroides
根据KEGG数据库中的基因信息分析实验菌株对乳糖及半乳糖的利用能力,结合图1和表2数据分析,8 株菌株均无PTSgal(EIIAgal、EIIBgal、EIICgal)和PTSlac(lacE/F)相关基因,说明菌株并不能通过PTS将半乳糖和乳糖摄入胞内,即不能将β-D-半乳糖转化为6-磷酸半乳糖,也不能将乳糖转化为6-磷酸乳糖,8 株菌株均没有磷酸-β-半乳糖苷酶将6-磷酸乳糖转化为6-磷酸半乳糖的lacG基因。由表2可知,实验所用8 株肠膜明串珠菌无T6P途径相关基因(lacA/B、lacC、lacD),说明8 株肠膜明串珠菌只存在通过Leloir途径代谢乳糖的可能性。各菌株Leloir途径相关基因数量差异性不大,仅菌株LM6的galM基因数量与另外7 个菌株不同,其余基因数量全部一致。渗透酶系统代谢途径中转运乳糖及半乳糖途径的lacS和laZ基因数量在各菌株间的差异性较大,含lacS基因数量最多的是菌株LM2和LM8(5 个),最少的是菌株LM7(1 个);含lacZ基因数量最多的是菌株LM2、LM4和LM8(3 个),最少的是菌株LM3、LM6和LM7(1 个)。
根据各菌株的基因与代谢途径解析可知,除菌株LM7外,其他7 株菌乳糖代谢的相关基因(lacS、lacZ)均位于同一基因簇,基因表达较强,而半乳糖代谢的相关基因(galP、galM、galK、galT、galE)分布较散,大多不在同一基因簇上,基因表达较弱,这可能是导致实验菌株在以乳糖为单一碳源的CDM培养基中生长能力更强的原因。但是如想进一步解析基因差异性与乳糖和半乳糖代谢的相关性,尚需对菌株的β-半乳糖苷酶活性、磷酸-β-半乳糖苷酶活性、发酵液中残留乳糖及半乳糖含量等特性进行测定。
3 结 论
通过8 株肠膜明串珠菌在不同碳源CDM培养基及脱脂乳环境中的生长及产酸情况可知,不同肠膜明串珠菌对乳糖的代谢能力存在显著差异,菌株LM1、LM2、LM4和LM8在以乳糖为单一碳源的CDM培养基中长势最好,菌株LM2、LM3、LM5和LM8在以半乳糖为单一碳源的CDM培养基中生长较好。实验菌株在以葡萄糖为单一碳源的CDM培养基中生长情况优于其他3 种环境,生长量最大、活力最强的是菌株LM7。在脱脂乳环境下,实验菌株的活菌数明显增长,培养8 h后进入稳定期,其中菌株LM1和LM2产酸能力最强,菌株LM2和LM6活菌数最高。基因分析表明,8 株肠膜明串珠菌不能通过PTS摄入乳糖和半乳糖,只存在通过Leloir途径代谢乳糖的可能性,各菌株Leloir途径相关基因差异性不大,仅菌株LM6的galM基因数量与另外7 个菌株不同。
