过表达miR-140-5p的人脐带间充质干细胞对骨关节炎的治疗作用
2020-09-16胡守业井文森
彭 侃,鲁 超,胡守业,井文森,王 波
(西安交通大学医学部附属红会医院关节病医院骨坏死与关节重建病区,西安 710054;*通讯作者,E-mail:pengkan00@126.com)
骨关节炎(osteoarthritis, OA)是一种严重的关节退行性疾病,常导致患者关节疼痛和残疾,其主要发病人群为老年人[1]。目前,骨关节炎的常用治疗措施包括关节内注射非甾体类抗炎药(NSAIDs)和细胞外基质(ECM)透明质酸成分,虽然上述疗法可在一定程度上缓解关节痛,但其治疗效果时效较短(1-4周)[2]。此外,关节置换手术仅适用于对治疗无效的重症骨关节炎患者,并且关节置换假体的寿命有限[3]。关节软骨损伤是骨关节炎发病的主要特征之一,但是骨关节炎患者的关节软骨自我修复能力较低。
大量研究证实间充质干细胞(MSC)具有自我更新能力并具有分化成多种谱系的潜力,现已被广泛用于治疗多种慢性疾病[4]。此外,MSC已经逐步应用于软骨修复和骨关节炎治疗中[5]。然而,现有研究表明MSC的分化能力并不强,只有少数注射的细胞可黏附于软骨缺损部位[6,7]。据报道,与其他来源的MSC相比,人脐带间充质干细胞(hUC-MSC)具有较低免疫原性,不会引起明显的免疫排斥反应,所以hUC-MSC是同种异体移植的合适选择[8]。因此,诱导hUC-MSC产生软骨分化潜能可能有助于提高骨关节炎关节中的软骨修复,然而,目前这方面的研究较少。
研究表明,一些microRNA(miRNA)在软骨形成和骨关节炎发生中发挥重要作用,并且miRNA具有调节MSC生长分化的功能[9,10]。miR-140-5p是软骨形成中的关键正调控因子,其可靶向调控MMP13、ADAMTS5、SOX9等基因来抑制炎症和促进软骨形成,其在预防和治疗骨关节炎方面具有较高的潜力[11-13]。
因此,本研究通过慢病毒将miR-140-5p转染至hUC-MSC,将其在骨关节炎大鼠模型中进行关节内注射,以探讨高表达miR-140-5p的hUC-MSC在治疗骨关节炎方面的潜在应用价值。
1 材料与方法
1.1 大鼠及主要试剂
60只SPF级8周龄雄性SD大鼠由西安交通大学医学部实验动物中心(SYXK(陕)2018-001)提供。DMEM/F12培养基、DMEM高糖培养基购自美国Gibco公司;成骨和成脂分化培养基购自赛业(苏州)生物科技有限公司;FITC标记一抗(CD29、CD34、CD45、CD90、CD105和IgG)购自美国BioLegend公司;miR-140-5p模拟物或抑制剂、过表达miR-140-5p的重组慢病毒载体pLenO-DCE-Puro-miR-140-5p和空慢病毒载体委托上海吉玛制药技术有限公司合成;293T细胞购自北京索莱宝科技有限公司;茜素红染色和油红O染色试剂盒购自广州赛业生物科技有限公司;Lipofectamine 2000购自美国Invitrogen公司;Polybrene储液、MTT测定试剂购自美国Sigma公司;Trizol试剂购自美国Invitrogen公司;PrimeScriptTMRT试剂盒、SYBR Premix Ex Taq购自日本TaKaRa公司;用于Western blot的一抗和二抗均购自美国Cell Signaling Technology公司;Pierce ECL化学发光液购自美国ThermoFisher公司;
1.2 hUC-MSC的分离和培养
无菌收集西安交通大学医学部附属红会医院正常足月剖宫产健康新生儿脐带标本并在4 ℃保存。本研究已获得本院伦理委员会批准,获得患者监护人的知情同意后对标本进行收集。取5 cm左右的脐带置于含有DMEM/F12培养基的培养瓶中,然后在无菌环境中取出脐带,PBS冲洗并剔除血管,剥离出华通胶并剪碎成组织块,将组织块接种于含hUC-MSC培养基的培养瓶中,于37 ℃、5% CO2培养。每3 d更换培养基1次,每天观察细胞的生长情况;待组织块周围长满细胞时,更换培养基,当融合率达到80%-90%时,用0.25%的胰蛋白酶消化传代。
1.3 成骨和成脂分化及染色
根据说明书分别使用成骨和成脂分化培养基诱导分化进行评估。根据试剂盒说明,通过茜素红染色考察hUC-MSC的成骨分化能力,通过油红O染色试考察hUC-MSC的成脂分化能力,然后在Olympus显微镜下进行观察(×100)。
1.4 流式细胞术鉴定人脐带间充质干细胞
hUC-MSC的第3代通过流式细胞仪鉴定干细胞表面标记。将hUC-MSC用0.25%胰酶消化,PBS重悬,制备1×106/ml的细胞悬液。然后取100 μl的细胞悬液与20 μl的FITC标记的一抗(CD29、CD34、CD45、CD90、CD105和IgG)4 ℃避光孵育1 h,通过Beckman Coulter流式细胞仪检测细胞的免疫荧光。
1.5 细胞增殖测定
用MTT法测定hUC-MSC的增殖能力。按照试剂盒说明,将1×104细胞在96孔板中培养48 h,用100 μl无菌MTT(0.5 mg/ml)在37 ℃染色4 h,除去培养基并加入150 μl二甲基亚砜,测量490 mm处的吸光度。
1.6 miR-140-5p过表达慢病毒转染
用Lipofectamine 2000将pLenO-DCE-Puro-miR-140-5p和空慢病毒共同转染293T细胞8 h,PBS洗涤3次,用含10%胎牛血清的高糖培养液培养72 h,每天观察绿色荧光蛋白。收集转染的293T细胞上清液并在4 000 r/min离心15 min,收集上清液并用0.45 μm微孔滤膜过滤,将滤液在25 000 r/min离心1 h,收集病毒沉淀并重悬于500 μl DMEM培养基中,4 ℃溶解过夜,将溶解后的病毒用EP管分装并置于-80 ℃保存。含miR-140-5p的重组慢病毒悬液的滴度为2×108TU/ml,对照慢病毒的滴度为1×109TU/ml。将hUC-MSC分为3组:感染组(过表达miR-140-5p组)、空病毒组和对照组。将P3代hUC-MSC按1×105/孔接种于6孔板中过夜培养,感染组按照10 μl/孔加入重组慢病毒,空病毒组按照2 μl/孔加入空病毒,对照组未处理。另外,在每孔加入Polybrene储液(终浓度为10 μg/μl),加入培养基培养24 h。之后用相同感染方式再次感染细胞,感染24 h时换液,72 h时收集细胞。
1.7 骨关节炎大鼠模型的建立及处理
将60只雄性SD大鼠随机分为假手术组、模型组、空病毒组和过表达miR-140-5p的重组慢病毒组(miR-140-5p组),每组15只。戊巴比妥钠溶液(30 mg/kg)腹腔注射麻醉大鼠,切断大鼠右膝关节的前交叉韧带建立骨关节炎模型[14]。模型组、空病毒组和miR-140-5p组大鼠进行建模,假手术组大鼠进行相同的手术操作,但不切断前交叉韧带。建模后第29天(4周后的第1天),空病毒组和miR-140-5p组大鼠在麻醉状态下用30G针将50 μl空病毒或过表达miR-140-5p的重组慢病毒感染的hUC-MSC(1×106个细胞)注入关节腔内,假手术组和模型组注射等体积PBS。共给药8周,每周注射3次。
1.8 番红O-固绿染色和OARSI评分
给药后第57天(给药8周后的第1天),用4%多聚甲醛固定大鼠膝关节,石蜡包埋,切成5 μm厚的切片,脱蜡水合并按照生产商说明用番红O-固绿染色染色以检查膝关节软骨的破坏情况。通过国际骨关节炎研究协会(OARSI)评分[15]评估各组大鼠的关节软骨损伤程度。
1.9 RT-PCR检测mRNA水平
给药后第57天(给药8周后的第1天),分离大鼠软骨组织并在液氮中研磨,根据试剂盒说明书,用Trizol试剂提取大鼠软骨组织的总RNA。用1 μg总RNA和PrimeScriptTMRT试剂盒通过反转录反应合成cDNA。用SYBR Premix Ex Taq在Applied Biosystems 7500实时PCR系统上进行RT-PCR。GAPDH和U6分别用作目的基因和miR-140-5p表达的内部对照。通过2-ΔΔCt方法分析RNA的相对表达。每个实验至少重复3次。引物序列见表1。

表1 引物序列
1.10 Western blot检测SOX9、collagen Ⅱ、Aggrecan、NLRP3、caspase-1、MMP13和ADAMTS-5蛋白表达水平
在含1% Nonidet P-40、150 mmol/L NaCl、50 mmol/L Tris-HCl和0.1% SDS(含蛋白酶抑制剂)的缓冲液(pH 7.4)中裂解大鼠软骨组织,将蛋白质溶液在4 ℃下以10 000 r/min离心10 min,以除去沉淀物。将变性的蛋白质溶液进行10% SDS-PAGE分离,电转移到硝酸纤维素膜上。在室温下用5% BSA封闭1 h,将膜与一抗在4 ℃孵育过夜。一抗如下所示:SOX9(1 ∶1 000)、collagen Ⅱ(1 ∶1 000)、Aggrecan(1 ∶1 000)、NLRP3(1 ∶1 000)、caspase-1(1 ∶1 000)、MMP13(1 ∶1 000)、ADAMTS-5(1 ∶1 000)、GAPDH(1 ∶1 000)。二抗是HRP标记的山羊抗兔IgG(1 ∶1 000)。使用Pierce ECL化学发光液进行显影。通过使用Image J软件将条带强度标准化为GAPDH。
1.11 统计学分析
使用SPSS 22.0软件进行数据统计分析,符合正太分布的数据表示为平均值±标准差。通过t检验或单因素方差分析及LSD事后检验比较组间差异。P<0.05表示差异具有统计学意义。
2 结果
2.1 hUC-MSC的鉴定结果
观察分离培养的第3代(P3)hUC-MSC形态,结果见图1。流式细胞仪检测结果显示,P3代hUC-MSC的表面标志物CD29表达率98.13%、CD90表达率98.92%、CD105表达率95.03%为高表达;造血干细胞表面标志物CD34表达率1.17%和CD45表达率0.96%为低表达(见图2)。
图1 倒置相差显微镜观察第3代hUC-MSC形态 (×100)Figure 1 Morphology of the 3rd generation hUC-MSC under inverted phase contrast microscope (×100)
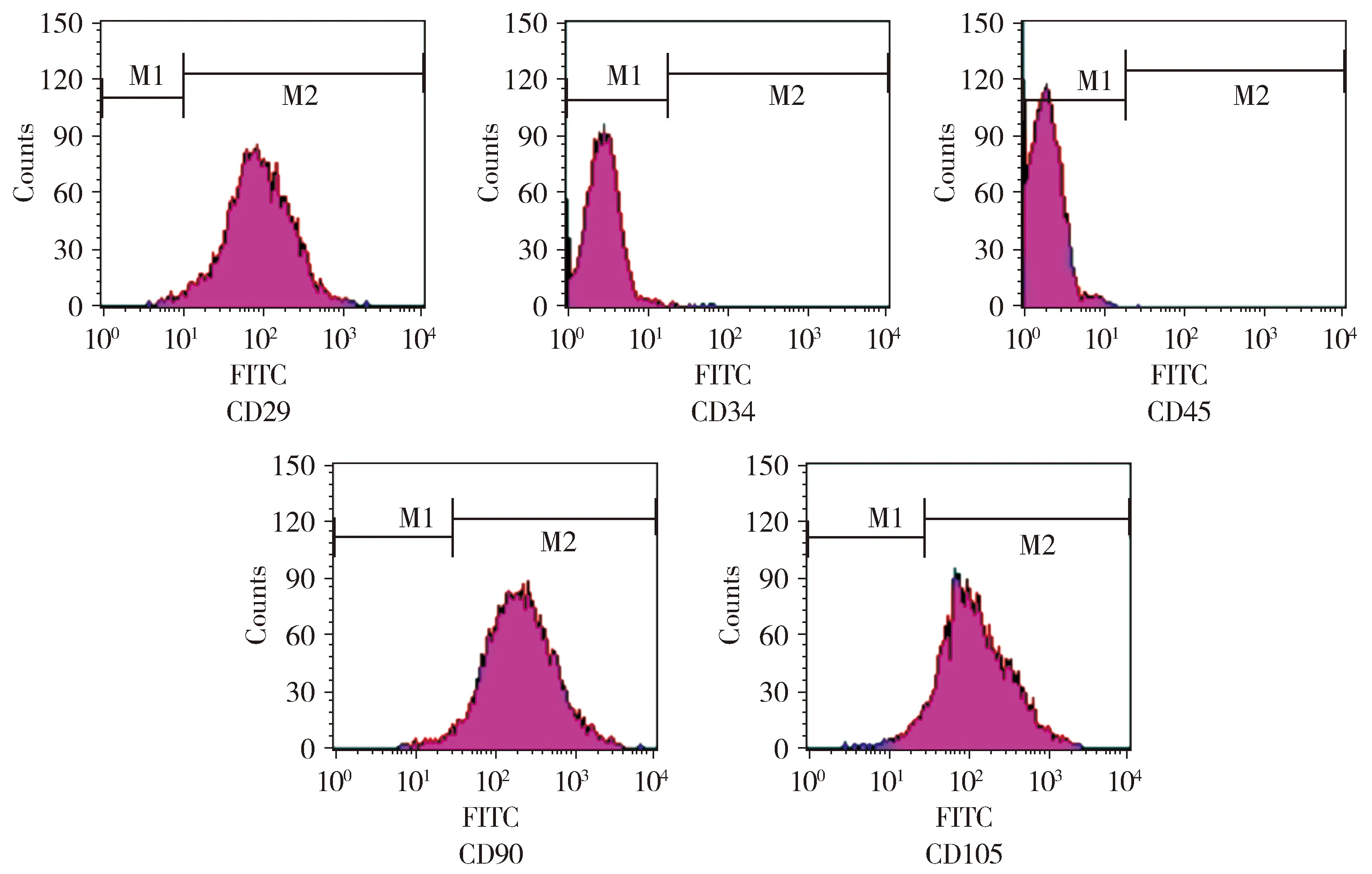
图2 P3代hUC-MSC的表面标记物Figure 2 Surface markers of third generation hUC-MSC
分别在成骨和成脂诱导培养基中培养hUC-MSC细胞来考察成骨和成脂分化潜能,油红O染色结果证实hUC-MSC可分化为脂肪细胞,茜素红染色证实细胞可分化为骨细胞,hUC-MSC具备多向分化潜能(见图3)。

图3 茜素红和油红O染色检测hUC-MSC的成骨和脂肪分化能力 (×100)Figure 3 Abilities of osteogenic and adipogenic differentiation of hUC-MSC by Alizarin red and oil red O staining (×100)
2.2 miR-140-5p对hUC-MSC增殖的影响
应用过表达miR-140-5p的重组慢病毒转染的hUC-MSC(感染组)中miR-140-5p表达水平显著高于对照组和空病毒组(P<0.05)。然而,感染组、空病毒组和对照组的细胞增殖能力差异无统计学意义(P>0.05,见图4)。

与对照组和空病毒组比较,*P<0.05图4 miR-140-5p在hUC-MSC中的表达及对hUC-MSC增殖的影响Figure 4 Expression of miR-140-5p in hUC-MSC and its effect on hUC-MSC proliferation
2.3 过表达miR-140-5p的hUC-MSC对骨关节炎大鼠软骨退变的影响
假手术组大鼠膝关节软骨和骨结构完整,而模型组的番红O失染严重,关节软骨发生明显结构破坏;空病毒组也存在番红O失染,但失染程度低于模型组;过表达miR-140-5p的hUC-MSC治疗的大鼠(miR-140-5p组)的番红O失染情况明显好转(见图5)。模型组大鼠的OARSI评分显著高于假手术组,而空病毒组和miR-140-5p组OARSI评分均显著低于模型组,并且miR-140-5p组低于空病毒组(P<0.05,见图5)。
2.4 过表达miR-140-5p的hUC-MSC对骨关节炎大鼠软骨组织中软骨分化标志基因表达的影响
基因表达结果显示,模型组大鼠软骨组织中的miR-140-5p表达水平明显低于假手术组,miR-140-5p组miR-140-5p表达水平明显高于其他组(P<0.05)。与假手术组相比,模型组的软骨分化标志基因collagen Ⅱ(COL2A1)、Aggrecan和SOX9的表达水平均显著降低,空病毒组和miR-140-5p组的collagen Ⅱ(COL2A1)、Aggrecan和SOX9的表达水平均显著高于模型组,并且miR-140-5p组显著高于空病毒组(P<0.05,见图6)。

与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与空病毒组比较,&P<0.05B.各组大鼠膝关节的OARSI评分图5 过表达miR-140-5p的hUC-MSC对骨关节炎大鼠软骨退变的影响Figure 5 Effect of hUC-MSC overexpressing miR-140-5p on cartilage degeneration of rats
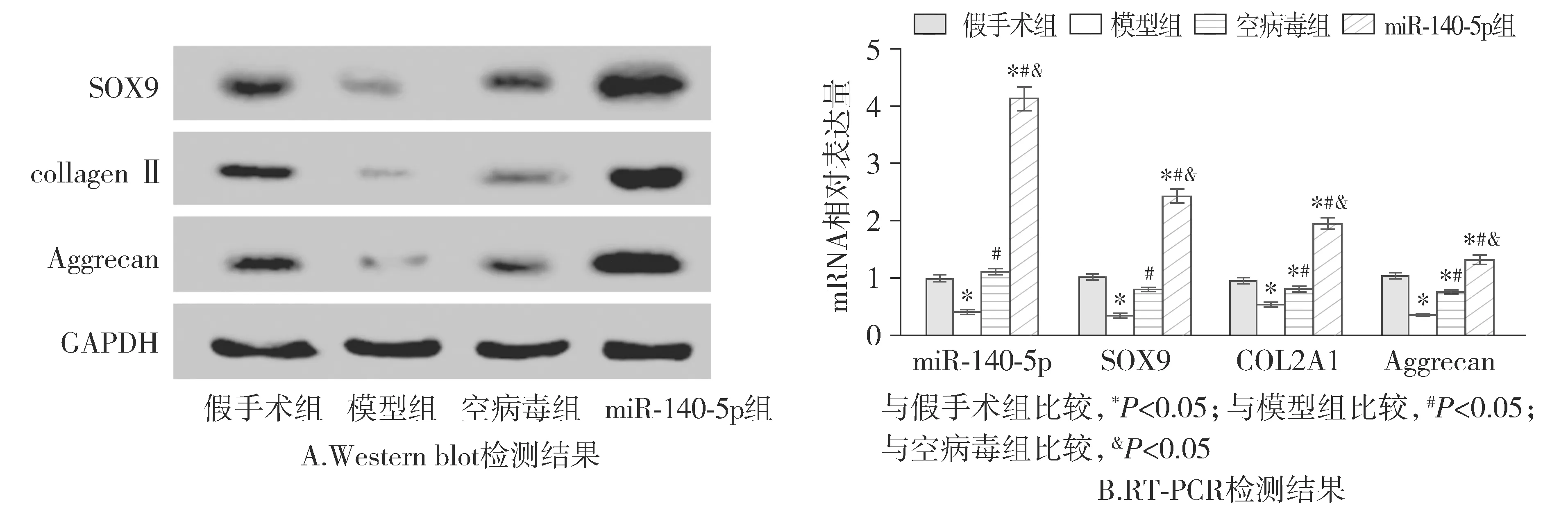
图6 大鼠软骨组织中miR-140-5p、collagen Ⅱ(COL2A1)、Aggrecan和SOX9的mRNA或蛋白表达Figure 6 The mRNA or protein expression of miR-140-5p, collagen Ⅱ(COL2A1), Aggrecan, and SOX9 in cartilage tissue of rats
2.5 过表达miR-140-5p的hUC-MSC对骨关节炎大鼠软骨组织中炎症因子表达的影响
与假手术组相比,模型组的软骨组织中炎症因子NLRP3、caspase-1、MMP13和ADAMTS-5的mRNA和蛋白表达水平均显著升高(P<0.05),空病毒组和miR-140-5p组的NLRP3、caspase-1、MMP13和ADAMTS-5的mRNA和蛋白表达水平均显著低于模型组,并且miR-140-5p组的炎症因子表达水平均显著低于空病毒组(P<0.05,见图7)。

图7 大鼠软骨组织中NLRP3、caspase-1、MMP13和ADAMTS-5的mRNA或蛋白表达Figure 7 The mRNA or protein expression of NLRP3, caspase-1, MMP13 and ADAMTS-5 in cartilage tissue of each group of rats
3 讨论
关节软骨损伤会降低其自我修复功能,提高关节软骨的修复功能是治疗骨关节炎的新策略。大量研究证实,干细胞具有分化潜能和抗炎功能,干细胞疗法近年来已成为治疗骨关节炎的新型治疗方法[16]。间充质干细胞存在于人体的各种组织中,如骨髓、脂肪组织、脐带组织、脐带华通胶、韧带等,并且间充质干细胞具有不同的增殖和分化潜能[17]。
目前治疗骨关节炎的干细胞疗法主要是脂肪来源的干细胞和骨髓间充质干细胞,关于脐带间充质干细胞方面的研究较少。与其他来源的间充质干细胞相比,来源于脐带华通胶的间充质干细胞在骨关节炎软骨修复方面具有多种优势。首先,新生儿脐带标本丰富,因此可提供大量的hUC-MSC。其次,hUC-MSC的收集过程中不会对个体造成创伤或疼痛。再次,hUC-MSC增殖较快并且无致瘤性[18]。另外,hUC-MSC具有更高的可诱导性[19]。基于上述优势,hUC-MSC在治疗骨关节炎方面的应用前景广阔。
多项研究已证明,micro RNA(例如miR-140、miR-146、miR-27b)在软骨形成中起积极作用,并且其表达水平随着骨关节炎的进展而逐渐减少[20]。有研究表明,关节内注射miRNA-140可通过调节细胞外基质(ECM)稳态来减弱大鼠骨关节炎的进展[21]。其他研究者提出,miR-140-5p是软骨形成中的关键正调控因子,其可靶向调控MMP13、ADAMTS5、SOX9等基因来抑制炎症和促进软骨形成,其在预防和治疗骨关节炎方面具有较高的潜力[11]。
本研究应用过表达miR-140-5p的重组慢病毒转染hUC-MSC,研究表明转染后hUC-MSC中的miR-140-5p表达水平显著升高。先前的研究报道miR-140可以诱导软骨细胞增殖[22],但在本研究中hUC-MSC的增殖能力未受到影响。其原因可能是由于miRNA具有协同干细胞增殖和分化平衡的作用,Liu等[23]证明miR-184控制着成年神经干细胞的增殖与分化之间的平衡。因此,miR-140-5p的过表达可能不会直接促进hUC-MSC的增殖,但可能促进了软骨分化。
本研究中番红O固绿染色和OARSI评分显示,空病毒转染的hUC-MSC和过表达miR-140-5p的慢病毒转染的hUC-MSC均明显抑制了骨关节炎大鼠的软骨退变,并且过表达miR-140-5p的hUC-MSC的治疗效果更好。胡琼英等[24]应用人脐带血间充质干细胞治疗类风湿性关节炎小鼠,研究表明治疗后小鼠临床症状明显改善,促炎因子表达水平显著降低。曹娟等[25]应用脐带间质干细胞干预后的骨关节炎新西兰大白兔模型,研究显示干预后兔滑膜增厚、关节积液等病变情况显著改善,软骨及滑膜炎性细胞浸润减轻,IL-6、MMP-13等炎症因子表达水平显著降低。上述研究说明脐带血间充质干细胞对关节炎疾病具有一定的治疗作用,而通过上调hUC-MSC中miR-140-5p的表达后,其治疗效果得到很大程度的提升。其原因与miR-140-5p的抗炎和促进软骨形成的作用密切相关[11]。
关节软骨是一种胶原纤维构成的软骨,在关节活动中发挥缓冲压力、承受力学负荷、润滑、增加关节灵活性等重要作用。关节软骨是一种专门的连接组织,其细胞外基质主要由蛋白多糖aggrecan和collagen Ⅱ等大分子组成[26]。SOX9基因是对骨骼系统发育有重要影响的转录激活因子,可在软骨前体细胞和软骨细胞中表达,并且SOX9可通过调控aggrecan和collagen Ⅱ来影响软骨的生成[27]。collagen Ⅱ(COL2A1)、Aggrecan和SOX9均是软骨分化标志基因,而collagen Ⅱ和Aggrecan是SOX9的下游信号分子。当上述基因表达降低时说明软骨细胞外基质发生降解、软骨组织受损。本研究显示过表达miR-140-5p的hUC-MSC显著上调了骨关节炎大鼠软骨组织中collagen Ⅱ(COL2A1)、Aggrecan和SOX9的表达,说明该干细胞疗法可明显提高骨关节炎大鼠的软骨修复功能。
NLRP3炎症体信号通路参与介导骨关节炎的发病过程,其可调节促炎性细胞因子和降解酶的合成和释放[28]。已有研究表明,兔膝骨性关节炎模型关节软骨中NLRP3的表达水平显著升高[29]。caspase-1是NLRP3的下游靶基因,不仅参与骨关节炎进展,而且可介导细胞凋亡和细胞焦亡。在MMPs组中,MMP-13是参与骨关节炎软骨退变的主要酶,具有水解细胞外基质collagen Ⅱ蛋白的作用[30,31]。ADAMTS-5是与关节疾病相关的聚集蛋白聚糖酶[32]。下调ADAMTS-5的表达会减弱由炎症介质刺激的软骨细胞中aggrecan的降解,从而提供骨关节炎治疗作用[33]。本研究结果表明,过表达miR-140-5p的hUC-MSC显著抑制了骨关节炎大鼠软骨组织中NLRP3、caspase-1、MMP13和ADAMTS-5的表达,说明该干细胞疗法的软骨治疗功能与其对上述炎症相关因子的抑制有关。
综上所述,通过关节腔内注射过表达miR-140-5p的hUC-MSC可显著抑制骨关节炎大鼠的软骨退变并提高软骨修复功能;过表达miR-140-5p的hUC-MSC可通过抑制NLRP3、caspase-1、MMP13和ADAMTS-5的表达来发挥软骨治疗作用。
