Genistein通过JAK2/STAT3信号通路抑制小鼠视网膜新生血管的形成
2020-09-16李宸宇王文娟贺荣华王永瑞周国宏
李宸宇,孔 丽,王文娟,贺荣华,王永瑞,周国宏*
(1山西医科大学第一临床医学院眼科,太原 030001;2山西医科大学解剖教研室;3山西省眼科医院泪道病科;4天津市儿童医院眼科;5山西省眼科医院急诊科;*通讯作者,E-mail:guohongzhou2005@163.com)
视网膜新生血管性疾病是临床上严重的致盲性眼病之一[1,2]。目前该类疾病的患病率呈逐年上升的态势,新生血管的形成是一项涉及多个机制、多个通路的极其复杂的生物学过程,其中抗新生血管生成因子和促新生血管生成因子间的互相作用这一机制被广泛认可。既往针对视网膜新生血管形成的治疗方案通常为玻璃体切除术、视网膜激光光凝等,但不可否认这些手段往往都伴随着对组织不同程度的损害。随着技术手段的不断丰富,研究的目光逐渐集中到了选择性分子靶向治疗病理性血管形成方向,这也要求更加深入了解参与其形成的信号通路[3]。
JAK/STAT之所以被关注,是因为其作为一种重要的信号转导通路,介导许多细胞因子和生长因子的信号转导过程并参与多种细胞通路的调控,如细胞增殖、分化和凋亡[4]。该通路是由酪氨酸激酶相关受体、酪氨酸激酶JAK和转录因子STAT三部分组成[5]。有研究认为,JAK2/STAT1的激活将诱导细胞死亡,而JAK2/STAT3的激活则可能促进细胞的生长和繁殖[6],信号转导与转录激活子-3(STAT3)蛋白对调控细胞分化、增殖和血管的生成有非常重要的作用[7],在通过激光诱导制备脉络膜新生血管(CNV)的动物模型中,STAT3的活化被认为参与促进了CNV的发展[8],STAT3的酪氨酸705位点被Janus激酶激活(JAK)如JAK2激活时,可使STAT3二聚化后转移到细胞核并引起各种生物反应[9,10]。
Genistein为一种来源于大豆异黄酮的特异的酪氨酸酶抑制剂[11],是大豆异黄酮的主要成分[12],之前的研究显示Genistein可以通过预防促炎因子诱导的血管内皮屏障功能障碍,进而调节血管炎症发生的进程,从而实现预防动脉粥样硬化的发生[13,14]。有研究[8,15]发现Genistein可保护和修复高糖诱导的人视网膜色素上皮细胞,其作用可能与抗氧化、增强SOD活性有关。作为酪氨酸酶抑制剂,可以抑制酪氨酸酶所引起的受体磷酸化和有丝分裂的信号转导,从而实现抑制细胞增殖的作用[16,17]。
然而,关于Genistein是通过何种作用机制参与到抑制视网膜新生血管的过程中,这一问题尚未完全明确。Genistein在高氧诱导的视网膜新生血管的模型中是否通过JAK/STAT信号通路发挥作用?本研究旨在探讨Genistein在视网膜新生血管形成过程中的所发挥的作用以及JAK/STAT信号通路在其中扮演的角色,希望为视网膜新生血管的治疗提供有效策略。
1 材料与方法
1.1 一般资料
1.1.1 实验动物及分组 C57BL/6J小鼠由山西医科大学实验动物中心提供,小鼠的饲养和实验严格依照《实验动物管理条例》。选取7日龄C57BL/6J健康小鼠36只,雌雄不限,体质量在4.0-5.0 g之间,与其母鼠共同喂养。每日使用室内日光灯照射持续12 h,且维持室内环境温度为(22±2)℃,湿度恒定于50%-60%之间。应用随机数字表法将小鼠分为正常对照组、模型组、实验对照组和实验组,每组各9只,即18眼。
1.1.2 主要试剂和仪器 Geinstein(上海阿拉丁生化科技股份有限公司);二甲基亚砜(DMSO)(深圳市康初源有限公司);Trizol试剂(Sigma-Aldrich,美国);RevertAidTMFirst Strand cDNA Synthesis Kit(上海生工生物科技有限公司);RIPA裂解液(Sigma-Aldrich,美国);兔抗鼠JAK2抗体、兔抗鼠STAT3抗体、抗兔IgG二抗,β-actin多克隆抗体(Santa Cruz,美国);氧浓度检测仪(青岛科凯电子研究所有限公司);眼科手术显微镜(Leica,德国);荧光显微镜(Leica,德国);PCR仪(德国Eppendorf);多功能数字凝胶成像分析系统(美国Bio-Rad公司)。
1.2 研究方法
1.2.1 氧诱导视网膜病变(oxygen-induced retinopathy, OIR)小鼠模型的建立 除了正常对照组在自然环境中饲养,不予任何处理外,将其余三组7日龄小鼠与其母鼠于同一氧箱饲养,密封氧箱的氧体积分数被设定为(75±2)%,于5 d后打开氧箱,并返回到正常氧浓度环境继续饲养5 d,可诱导视网膜新生血管的形成。
1.2.2 小鼠玻璃体腔注射 在小鼠出氧箱第5天(即出生第12天,P12)时,实验对照组和实验组的小鼠,参考贺荣华等[17]描述的方法,以5%水合氯醛进行腹腔注射(300 ml/kg体质量),麻醉妥当后置于手术显微镜下,于角膜缘后1 mm处垂直眼球进针,使用微量注射泵行玻璃体腔药物注射。予实验对照组注射DMSO 1 μl;予实验组注射溶于DMSO(400 mg/L)溶剂中的Genistein 1 μl;此两组小鼠待麻醉剂失效后回归鼠笼继续同母鼠饲养;正常对照组和模型组不予药物处理。
1.2.3 视网膜荧光造影铺片 按照以下配方配置视网膜荧光造影剂:将异硫氰酸葡聚醛荧光素(FITC-dextran,相对分子质量2×106)50 mg,溶解于1 ml PBS缓冲液。分别随机在4组P17小鼠中各取2只,用5%水合氯醛通过腹腔注射(300 ml/kg)的方法对小鼠进行麻醉,麻醉妥当后剪开其胸骨,将少量荧光素通过1 ml注射器注入小鼠左心室。注射完毕后立即摘取眼球并置于4%多聚甲醛避光固定3 h。手术显微镜下剥离视网膜并铺片,通过荧光显微镜观察并拍照记录结果。
1.2.4 视网膜的剥离 第17天(即P17)时使用颈椎脱臼法处死其他小鼠,同前方法保留视网膜铺片,置于Eppendorf管中。进行real-time PCR、Western blot试验前保存于-80 ℃冰箱中。
1.2.5 real-time PCR法检测小鼠视网膜JAK2和STAT3 mRNA水平 各组取P17小鼠4只,8眼行real-time PCR检测JAK2 mRNA和STAT3 mRNA表达,利用生工RNA提取试剂盒提取小鼠视网膜总RNA后,按RevertAidTMFirst Strand cDNA Synthesis Kit说明书逆转录条件:11 μl RNA(1 μg),随机引物(0.2 μg/ml)1 μl,65 ℃孵育5 min;加入4 μl 5×Buffer,3 μl dNTP(10 mmol/L),1 μl RNA酶抑制剂(20 U/μl)和1 μl逆转录酶(20 U/μl),25 ℃孵育10 min、42 ℃孵育1 h、72 ℃孵育15 min,完成RNA逆转录为cDNA的过程。以cDNA为模板,分别对JAK2和STAT3进行PCR。引物序列见表1。加入PCR反应液,94 ℃预变性10 min,活化Tag酶;94 ℃ 15 s,60 ℃ 60 s,45个循环结束。反应结束后通过熔解曲线检测,确认扩增的特异性,根据各组组织中β-actin、JAK2和STAT3mRNA的Ct值,以2-ΔΔCt表示各组组织中JAK2和STAT3 mRNA的相对表达。

表1 引物序列
1.2.6 Western blot法检测JAK2和STAT3蛋白在小鼠视网膜的表达 各组取P17小鼠3只,6眼行Western blot法检测,用裂解液裂解小鼠视网膜,置于Eppendorf管中,超声匀浆,10 000g,4 ℃离心10 min,取上清,蛋白定量。加入等体积的2×SDS buffer(Tris-Cl 100 mmol/L,DTT 200 mmol/L,甘油20%,溴酚蓝0.2%,SDS 4%),95 ℃煮沸5 min,迅速冰浴,10 000g,4 ℃离心10 min,收集上清。蛋白经SDS-PAGE电泳法分离(JAK2 8%的分离胶,STAT3 15%的分离胶),电转印法将电泳条带转移到PVDF膜上,5%BSA溶液,4 ℃封闭3 h;分别加入兔抗鼠JAK2单克隆抗体或兔抗鼠STAT3单克隆抗体,4 ℃过夜孵育,洗涤,再加入抗兔IgG二抗,孵育,洗涤;ECL底物化学发光,显影,定影,扫描。以β-actin为内参。根据各组组织中β-actin、JAK2和STAT3蛋白印迹测定的光密度值,以JAK2/β-actin的比值和STAT3/β-actin比值表示各组组织中JAK2和STAT3蛋白的相对表达。
1.3 统计学处理

2 结果
2.1 各组小鼠视网膜血管的形态
正常对照组视网膜血管走行自然、清晰,未见新生血管簇、血管渗漏和缺血无灌注区;模型组和实验对照组的视网膜血管可以观察到明显的新生血管簇,伴随着血管走形紊乱,其间可见明显的分支、分层现象;实验组小鼠视网膜新生血管簇较少,未见明显的血管分层、分支现象,走形比较自然(见图1)。

A.正常对照组 B.模型组 C.实验对照组 D.实验组图1 荧光显微镜下各组小鼠视网膜新生血管形态比较 (FITC-dextran,×50)Figure 1 Morphology of retinal neovascularization in each group under fluorescence microscope (FITC-dextran,×50)
2.2 各组小鼠视网膜中JAK2和STAT3 mRNA表达水平的比较
各组视网膜中JAK2和STAT3 mRNA表达水平总体比较,差异有统计学意义(JAK2:F=26.92,P<0.001;STAT3:F=25.21,P<0.001),与正常对照组相比,模型组和实验对照组小鼠视网膜中JAK2和STAT3的mRNA的表达水平(2-ΔΔCt)明显升高,差异有统计学意义(P<0.05);与模型组和实验对照组相比,实验组中JAK2和STAT3的mRNA的表达水平(2-ΔΔCt)明显降低,差异有统计学意义(P<0.05);模型组和实验对照组比较,差异无统计学意义(P>0.05);实验组和正常对照组比较,差异无统计学意义(P>0.05,见表2)。
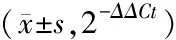
表2 各组JAK2和STAT3 mRNA水平的比较
2.3 各组小鼠视网膜中JAK2和STAT3蛋白表达水平的比较
Western blot法检测结果表明,各组视网膜中JAK2和STAT3蛋白表达水平总体比较,差异有统计学意义(JAK2:F=26.46,P<0.001;STAT3:F=16.10,P<0.001),与正常对照组相比,模型组和实验对照组小鼠视网膜中JAK2和STAT3的蛋白表达水平明显升高,差异有统计学意义(P<0.05);与模型组和实验对照组相比,实验组中JAK2和STAT3的蛋白表达水平明显降低,差异有统计学意义(P<0.05);模型组与实验对照组比较,差异无统计学意义(P>0.05);实验组和正常对照组比较,差异无统计学意义(P>0.05,见图2,表3)。

图2 Western blot法检测各组小鼠视网膜中JAK2和STAT3蛋白表达量Figure 2 The expression levels of JAK2 and STAT3 proteins in the retinas of mice in each group by Western blot
表3 各组JAK2和STAT3蛋白表达量的比较
3 讨论
近年来,由病理性视网膜新生血管引起的眼部疾病在致盲性眼病中所占比例不断上升,成为了导致各年龄段患者失明的主要原因,常见的视网膜新生血管眼病包括早产儿视网膜病变、糖尿病视网膜病变和视网膜中央静脉阻塞等。新生血管的生成,涉及到内皮细胞的增殖、迁移和发芽[18],受到诸如细胞因子、黏附因子、蛋白酶等各种复杂信号通路的调控。一般认为,在由前述疾病引起视网膜大面积的缺血、缺氧的环境下[19],视网膜出现了微循环障碍,打破了调节血管生长的各类因子间的稳态。这种失衡的结果表现为以VEGF为代表的促血管生长因子的大量表达,而新生血管由于自身发育的不完善,在生长过程中可能会出现血管的渗漏和出血,进而诱发视网膜脱离或玻璃体出血等严重并发症,从而破坏了感光细胞和视力。
JAK/STAT通路作为广泛存在于各类细胞内的介导激素、生长因子和细胞因子等的信号转导通路,通常不能自主发挥作用,相反,它们受到各种各样的内在和外界刺激的调节[20]。这些复杂的调控手段为特定细胞或组织中的转录输出提供了调节的灵活度[21]。这一信号转导途径完成其生物学效应的主要机制是JAK通过结合细胞因子及其受体,激活下游底物STAT,进而激活靶基因启动子完成调控作用。越来越多的研究表明,VEGF的基因转录发生在STAT3的下游[22],当VEGF启动子中的STAT3结合位点发生突变时,VEGF的表达出现了显著的抑制状态[23];研究发现JAK/STAT可能是通过活性氧簇(ROS)发生氧化还原反应而刺激小鼠的视网膜新生血管生成[24],而AG490,作为JAK2的抑制剂,可以通过抑制JAK2和STAT3的磷酸化,达到对下游STAT3途径的药理阻滞,从而减少了玻璃体内新生血管的形成,本研究也得出了类似的结果。
既往的研究表明[25],Genistein作为大豆异黄酮的重要成分,已被证明在抗氧化方面有确切作用[26]。而在肿瘤治疗方面,除了通过调节雌激素受体、诱导癌细胞凋亡等方式抑制肿瘤的生长[27],还能通过对新生血管的抑制作用来预防肿瘤的生长和转移等[28]。作为酪氨酸激酶的特异性抑制剂,Genistein可以通过抑制酪氨酸酶引起的受体磷酸化和有丝分裂的信号转导[29],从而实现抑制细胞增殖的作用。
在本实验中,为了直接观察视网膜血管的情况,我们制备了各组小鼠的视网膜血管荧光造影的铺片,相对于正常对照组,模型组和实验对照组的视网膜可见明显的新生血管簇。与此同时,模型组和实验对照组的JAK2和STAT3的mRNA及蛋白表达水平明显高于正常对照组,据此可以认为高氧诱导下的小鼠视网膜新生血管中的生成会伴随着JAK2和STAT3的表达水平的升高。与之相反,实验组JAK2和STAT3的mRNA及蛋白表达水平明显低于模型组和实验对照组,这表明了Genistein可以抑制JAK2和STAT3的mRNA和蛋白的表达。同时我们观察到实验组的铺片未见明显的视网膜新生血管簇,可以推测Genistein可能是通过抑制JAK2/STAT3信号通路,进而抑制视网膜新生血管的形成。
当视网膜新生血管不可逆转的影响视觉功能时,现有阻断VEGF的治疗措施往往局限于晚期,为了更早介入新生血管的形成,充分研究Genistein在抑制视网膜新生血管形成过程中所发挥的作用,将会在视网膜新生血管疾病的治疗方面有很好的应用前景。但本研究尚存一些不足,比如小鼠模型的实验结果能否成功推广到其他动物实验及人体实验,再比如通路中是否存在其他反馈机制,接下来,我们将继续深入研究其通路机制,探索其在剂量、代谢周期等方面展开更多研究。
