正丁基苯酞通过抑制心力衰竭大鼠心房重构降低心房颤动易感性
2020-09-16李晶瑾折剑青
刘 洋,梁 潇,李晶瑾,郝 翔,折剑青
(西安交通大学第一附属医院心血管内科,西安 710061;*通讯作者,E-mail:jianqingshe@xjtu.edu.cn)
心房颤动(atrial fibrillation,AF)是一种临床常见的持续性心律失常,也是心力衰竭(heart failure,HF)的常见并发症,目前的房颤治疗方法在某种意义上是一种姑息治疗[1]。有学者提出了一种新的治疗理念,即所谓的上游治疗,其旨在通过抑制心房结构重塑(atrial structural remodeling,ASR)来预防或抑制房颤,并从理论上彻底改善这种情况[2]。然而,在上游治疗中可供选择和使用的有效药物却相对有限。多项研究证实,氧化应激和炎症与心房结构重塑有关,包括心房增大、纤维化和间隙连接重塑[3]。活性氧水平升高与活化的促炎介质和细胞因子有关,从而介导心房成纤维细胞过度增殖、促进胶原沉积、加重心房结构重塑,最终导致房颤形成[1]。因此,抗氧化剂和抗炎方法可能会抑制心房结构重塑,从而抑制房颤的发生。
正丁基苯酞(n-butylphthalide,NBP)是一种由芹菜籽挥发油中分离出的左旋体经人工合成的消旋体化合物,目前已应用于缺血性卒中的治疗[4]。先前的研究表明,正丁基苯酞通过减少氧化应激、抑制炎症等多种机制在脑保护中发挥重要作用[5]。此外,正丁基苯酞还通过抗氧化和抗线粒体细胞凋亡对心肌缺血再灌注损伤发挥心脏保护作用[6]。推测在心力衰竭后,应用正丁基苯酞可能通过其抗炎、抗氧化等作用抑制心房结构重塑和房颤形成,从而发挥心脏保护作用。因此,本研究通过观察正丁基苯酞对心力衰竭大鼠心房结构重塑和房颤形成的影响,揭示其可能的作用机制。
1 材料与方法
1.1 实验动物
7-8周龄雄性Wistar大鼠90只,无特定病原体(SPF),平均体质量为(265.4±13.6)g,购自西安交通大学医学院医学实验动物中心[许可证号:SYXK(陕)2018-001]。饲养环境温度为3 ℃、相对湿度为55%,12 h光照/黑暗循环。饲养期间用纯净水和标准大鼠饲料饲养大鼠(南通特洛菲饲料科技有限公司),不限制饮食。
1.2 动物分组
将90只雄性Wistar大鼠随机分为3组,即正丁基苯酞组、模型组和假手术组,每组30只。将正丁基苯酞(石药集团恩必普药业有限公司)溶解在大豆油中制成浓度为30 mg/ml的正丁基苯酞溶液。正丁基苯酞组按照每天200 mg/kg体质量的剂量(2 ml)灌胃Wistar大鼠,模型组和假手术组用等量(2 ml)的大豆油灌胃,共给药4周,每天1次。
1.3 心肌梗死后心力衰竭模型的建立
结扎Wistar大鼠左前降支冠状动脉(LADCA)建立心肌梗死(myocardial infarction,MI)大鼠模型。腹膜内注射7%的水合氯醛(300 mg/kg)麻醉大鼠,气管插管并与呼吸机连接。呼吸频率为45次/min,潮气量为30 ml/次。在第三和第四肋之间打开胸腔暴露心脏。于左心耳根部下方2 mm结扎LADCA。当LADCA区域由鲜红变苍白,并且心电图显示大鼠ST-T抬高超过50%,且持续时间超过30 min表明建模成功。然后,逐渐缝合胸腔。假手术组大鼠接受相同手术但未结扎左前降支冠状动脉。建立心肌梗死模型后第7天,使用Visual Sonics Vevo®2100高分辨率小动物超声成像系统超声检查大鼠心动图。将大鼠麻醉,仰卧放置在实验台上,去除胸前毛发。建模后第7天及治疗结束后1 d,采用M模式示踪测量大鼠左心室收缩末期内径(LVESD)、左心室舒张末期内径(LVEDD)、左室射血分数(LVEF)、左室短轴缩短率(LVFS)和左心房直径(LAD)。当LVEF降低45%时表示心力衰竭大鼠模型建模成功。
1.4 房颤诱导测试
参考文献[7]所述方法并做适当修改来诱导大鼠房颤。超声心动图检查后,腹膜内注射3%的戊巴比妥钠(30 mg/kg)麻醉大鼠。无创气管插管,连接PowerLab生理记录仪并记录肢体导联心电图,将电极导管插入大鼠食管至左心房后壁用于记录食管心电图和房颤感应。测量起搏阈值后通过电刺激器以双阈值、20 ms的周期长度、5 ms的脉冲宽度和30 s的刺激时间进行心房起搏。房颤定义为心电图出现快速、不规则和混乱的房颤波,且持续时间超过5 s,起搏重复3次。如果房颤成功诱导至少一次并且持续时间超过5 s,则为房颤诱导成功。
1.5 Masson三色染色检测心房组织纤维化
大鼠治疗结束后1 d,分离心脏左心房组织并用盐水冲洗,4%多聚甲醛固定,石蜡包埋制作4 μm厚切片。使用Masson三色染色试剂盒(北京索莱宝科技有限公司)按照说明书检测大鼠的左心房组织纤维化程度。
1.6 免疫组化检测连接蛋白43(Cx43)的表达
将左心房组织切片脱蜡、水化,并在0.6%过氧化氢甲醇溶液中孵育30 min以阻断内源性过氧化物酶。将切片与连接蛋白43(Cx43)(1 ∶2 000稀释,英国Abcam公司)一抗过夜孵育。然后与辣根过氧化物酶标记的山羊抗兔IgG抗体(1 ∶1 000稀释,英国Abcam公司)在37 ℃下孵育30 min。使用DAB显色试剂盒(北京索来宝科技有限公司)进行显色。随机选择5个视野进行阳性染色评分,阳性细胞数<5%为0分,5%-25%为1分,5%-25%为1分,26%-50%为2分,51%-75%为3分,>75%为4分。染色强度评分如下:未染色为0分,浅黄色为1分,棕黄色为2分,深棕色为3分。阳性细胞计数评分×染色强度评分为阳性染色评分。
1.7 蛋白质印迹分析大鼠左心房组织中collagen Ⅰ、collagen Ⅲ、α-SMA、TNF-α、TGF-β1、NF-κB、Nrf2和HO-1的蛋白表达
使用RIPA裂解缓冲液(上海碧云天生物技术有限公司)裂解大鼠左心房组织。BCA蛋白质测定试剂盒(上海碧云天生物技术有限公司)用于测定蛋白质浓度。然后将等量的蛋白质样品在10% SDS-PAGE上电泳并转移到聚偏二氟乙烯膜(PVDF)上。将膜在WB封闭溶液(北京百奥莱博科技有限公司)中室温封闭1 h,然后与collagen Ⅰ(1 ∶3 000稀释)、collagen Ⅲ(1 ∶3 000稀释)、α-平滑肌肌动蛋白(α-SMA,1 ∶1 000稀释)、肿瘤坏死因子-α(TNF-α,1 ∶2 000稀释)、抗肿瘤生长因子-β1(TGF-β1,1 ∶3 000稀释)、核因子-κB(NF-κB,1 ∶1 500稀释)、核因子E2相关因子2(Nrf2,1 ∶1 000稀释)、血红素加氧酶-1(HO-1,1 ∶2 000稀释)和甘油醛糖磷酸脱氢酶(GAPDH,1 ∶3 000稀释)4 ℃过夜孵育,抗体均购自Abcam公司。GAPDH作为内参。然后室温下与相应二抗孵育1 h。使用增强型ECL化学发光检测试剂盒(上海碧云天生物技术有限公司)显影。通过Image Lab 2.0定量分析条带表达强度。
1.8 血清抗氧化能力分析
分别使用超氧化物歧化酶(SOD)测定试剂盒(WST-1法)、过氧化氢酶(CAT)测定试剂盒(可见光法)和丙二醛(MDA)测定试剂盒(TBA法)检测大鼠血清抗氧化能力,所使用试剂盒均购自南京建成生物科技有限公司。
1.9 统计学分析
使用SPSS 19.0软件进行统计分析。所有数据表示为均数±标准差。单因素方差分析(ANOVA)或Kruskal-WallisH检验用于分析多组之间的数据差异,t检验用于分析两组之间的数据差异。P<0.05表示差异具有统计学意义。
2 结果
2.1 正丁基苯酞对心力衰竭大鼠心脏功能的影响
与模型组相比,正丁基苯酞组大鼠的LVFS和LVEF显著升高,而LVEDD、LVESD和LAD显著降低(P<0.05,见表1)。

表1 三组大鼠的心脏功能比较
2.2 正丁基苯酞对心力衰竭大鼠的房颤诱导率和持续时间的影响
正丁基苯酞组大鼠的房颤诱导率显著低于模型组(43.32%±5.63%vs73.21%±11.07%,P<0.05)。正丁基苯酞组大鼠的房颤持续时间显著低于模型组[(176.32±42.68)svs(465.43±75.97)s,P<0.05,见图1]。

与假手术组比较,*P<0.05;与模型组比较,#P<0.05图1 三组大鼠房颤诱导率和持续时间的比较Figure 1 Comparison of atrial fibrillation induction rate and duration of rats among three groups
2.3 正丁基苯酞对心力衰竭大鼠心房纤维化和心肌细胞肥大的影响
模型组大鼠左心房严重纤维化,肌原纤维被严重破坏,心肌明显肥大;正丁基苯酞组大鼠左心房的纤维化和心肌细胞肥大明显减轻(见图2)。Western blot结果显示,模型组中纤维化相关指标collagen Ⅰ、collagenⅢ和α-SMA蛋白的表达水平显著增加,而正丁基苯酞组collagen Ⅰ、collagenⅢ和α-SMA的蛋白表达水平显著低于模型组(P<0.05,见图3)。
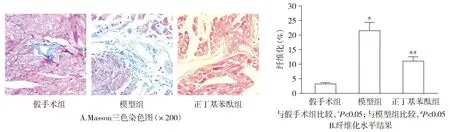
图2 Masson三色染色检测大鼠左心房组织的纤维化Figure 2 Fibrosis in left atrial tissue of rats after different treatment by Masson trichrome staining
2.4 正丁基苯酞对心力衰竭大鼠心房缝隙连接重构的影响
免疫组化检测结果显示,与假手术组相比,模型组大鼠的Cx43的阳性染色评分显著降低(6.21±0.81vs1.13±0.15,P<0.05)。与模型组相比,正丁基苯酞组大鼠的Cx43的阳性染色评分显著升高(1.13±0.15vs4.20±0.55,P<0.05,见图4)。

图4 大鼠左心房组织的Cx43阳性表达情况Figure 4 Immunohistochemical staining of Cx43 positive expression in left atrial tissue of rats in each group
2.5 正丁基苯酞对心力衰竭大鼠心房组织炎症反应和氧化应激的影响
与假手术组比较,模型组大鼠左心房组织的炎症介质TNF-α、TGF-β1和NF-κB水平均显著增加(P<0.05);正丁基苯酞组大鼠的上述指标水平均显著低于模型组(P<0.05)。与假手术组相比,模型组大鼠的Nrf2及其下游抗氧化剂反应元件HO-1蛋白表达水平均显著降低(P<0.05);正丁基苯酞组Nrf2和HO-1蛋白表达水平均显著高于模型组(P<0.05,见图5)。
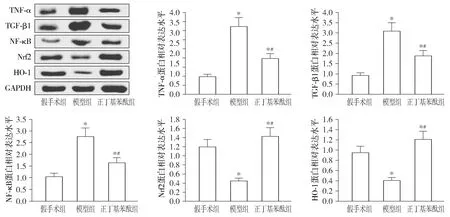
与假手术组比较,*P<0.05;与模型组比较,#P<0.05图5 大鼠左心房组织的TNF-α、TGF-β1、NF-κB、Nrf2和HO-1蛋白表达Figure 5 Expression of TNF-α, TGF-β1, NF-κB, Nrf2 and HO-1 proteins in left atrial tissue of rats
2.6 正丁基苯酞对心力衰竭大鼠的血清抗氧化能力的影响
与假手术组比较,模型组大鼠的血清SOD和CAT活性显著降低,而MDA水平显著升高(P<0.05)。正丁基苯酞组大鼠的SOD和CAT活性显著高于模型组,而MDA水平显著低于模型组(P<0.05,见图6)。
3 讨论
抑制心房结构重塑是房颤治疗的主要目的之一[8]。目前,尚不清楚正丁基苯酞对心房结构重塑和房颤形成的影响。本研究显示,正丁基苯酞治疗可导致心力衰竭大鼠的LVFS和LVEF显著升高,而LVEDD、LVESD和LAD显著降低。表明正丁基苯酞可以预防心力衰竭引起的心脏功能障碍,并减少心室和心房扩张。此外,本研究还显示正丁基苯酞可降低心力衰竭大鼠房颤的诱导性和持续时间。本研究结果提示正丁基苯酞可能是一种房颤治疗的潜在药物。
在心力衰竭过程中,严重的心房纤维化会产生异常的电生理特性,并最终导致房颤的发生[9]。还有研究显示,EZH2抑制剂GSK126通过抑制AngⅡ诱导的心房扩大和纤维化降低了房颤易感性[10]。因此,抗纤维化治疗在房颤的上游治疗中占有重要地位。本研究表明,与假手术组相比,心力衰竭发生明显的心房扩大、细胞肥大、纤维化和间隙连接重塑、房颤易感性增加。在其他研究中也显示了类似的结果[11]。但是,正丁基苯酞治疗可显著降低心房结构重塑,这与房颤易感性降低有关。这些结果表明,正丁基苯酞可能是一种治疗房颤相关纤维化的潜在新药。心房纤维化的形成是由α-SMA标记的成纤维细胞过度增殖和细胞外基质成分(collagen Ⅰ、collagen Ⅲ等)过度沉积所引起的[12]。本研究显示,正丁基苯酞治疗显著降低了心力衰竭大鼠的collagen Ⅰ、collagen Ⅲ和α-SMA的蛋白表达水平。尽管不确定正丁基苯酞对房颤成纤维细胞增殖的作用是直接还是间接,但上述结果表明,正丁基苯酞可抑制心力衰竭大鼠的心房间质纤维化和心肌细胞肥大。
在房颤发病过程中,间隙连接重塑是导致房颤和心律失常的重要原因。缝隙连接通道是心肌细胞间的主要连接方式,Cx43是缝隙连接通道的主要组成蛋白。多项研究表明,上调Cx43可有效阻止房颤的发病[13,14]。本研究表明,与假手术组相比,模型组的Cx43的阳性染色评分显著降低。此外,Cx43的分布还受到纤维化的影响,因为纤维化可能会破坏与正常Cx43组织相关的细胞骨架网络和黏附蛋白[14]。因此,减少心房间质纤维化可能有益于纠正Cx43的表达和分布。本研究显示,与模型组相比,正丁基苯酞组的Cx43的阳性染色评分显著升高。这些数据进一步说明,正丁基苯酞预防房颤的机制与改善间隙连接重塑有关。
众所周知,氧化应激和炎症涉及心房电和结构重塑。活性氧(ROS)的增加直接损害心房肌细胞和离子通道。此外,升高的ROS还可以激活RAAS并促进促炎性介质的合成和分泌(包括TGF-β1、TNF-α和NF-κB),从而增加心房肌成纤维细胞的增殖并促进胶原沉积[8]。因此,抗氧化和抗炎治疗是房颤上游治疗的重要方面。先前的研究表明,NF-κB可以直接调节与炎症反应有关的基因表达,增强包括TNF-α在内的多种炎性细胞因子的转录,并逐渐导致纤维化程度升高[15]。有研究证实TNF-α、NF-κB、TGF-β1的激活与糖尿病相关房颤的形成有关[16]。然而,TNF-α、NF-κB、TGF-β1的下调阻止了心房重构并抑制了房颤的进展[17]。这些数据表明,炎症因子NF-α、NF-κB、TGF-β1在房颤的发展中起着重要作用。在心肌梗死、缺血性中风、阿尔茨海默氏病、糖尿病和帕金森氏病等疾病中,正丁基苯酞也增加了血清的抗氧化能力[6],表明正丁基苯酞具有很强的抗氧化特性和器官保护作用,因此其可能有助于房颤的预防和治疗。本研究显示,模型组大鼠左心房组织的炎症介质TNF-α、TGF-β1和NF-κB水平均显著增加,而正丁基苯酞组的上述指标水平均显著低于模型组。
Nrf2是最重要的转录因子之一,Nrf2的激活可以启动多种抗ROS的抗氧化反应元件(ARE)基因及其下游基因的表达,其中包括血红素氧合酶1(HO-1)。据报道,Nrf2在房颤发生中起重要作用,Nrf2下调可导致氧化应激、心肌细胞肥大和纤维化增加,从而引起房颤[17]。相反,他汀类药物对Nrf2/HO-1通路的激活抑制了心房速搏引起的心房结构重塑[18]。这些数据表明,Nrf2/HO-1途径在房颤发生中具有保护作用。先前的研究表明正丁基苯酞是一种强抗氧化剂。通过Nrf2/HO-1等多种途径在多种疾病中发挥抗氧化作用[5]。本研究显示,与假手术组相比,模型组的Nrf2及HO-1蛋白表达水平均显著降低,而正丁基苯酞组Nrf2和HO-1蛋白表达水平均显著高于模型组。此外,正丁基苯酞治疗显著升高了SOD和CAT活性,而降低了MDA水平。表明正丁基苯酞可通过抑制炎症反应和氧化应激来发挥房颤保护作用。先前的研究表明,心房中HO-1的激活可能会抑制TGF-β1对胶原纤维的上调[18]。因此,正丁基苯酞对炎症因子的抑制和纤维化的抑制可能与Nrf2/HO-1的激活有关。
总之,本研究表明,正丁基苯酞可有效降低心力衰竭大鼠的房颤易感性和持续时间,提高心脏功能,抑制心房结构重塑和纤维化,其作用机制与抑制TNF-α、NF-κB、TGF-β1等炎症因子表达、改善间隙连接重塑及激活Nrf2/HO-1介导的抗氧化活性有关。因此,正丁基苯酞有望成为房颤预防和治疗的上游治疗药物。
