褪黑素对H9c2心肌细胞缺氧/复氧损伤的保护作用及其机制
2020-09-16杨吉平钟钰西苟兴春
杨吉平,费 琳,钟钰西,余 蕾,苟兴春*
(1西安医学院基础医学研究所,陕西省缺血性心血管疾病重点实验室,西安 710021;2西安交通大学第一附属医院精神科;*通讯作者,E-mail:447962736@qq.com)
急性心肌梗死(acute myocardial infarction,AMI)是导致人类死亡的主要原因之一,通过溶栓治疗或经皮冠状动脉内支架术使心肌组织恢复血流供应的同时常常合并出现心肌缺血再灌注损伤(ischemia reperfusion injury,IRI)[1]。如何避免或减轻IRI已成为AMI治疗研究中的难点,心肌IRI是一个极其复杂的病理生理过程,其机制尚不完全清楚,主要包括氧化应激、细胞内钙超载、炎症反应,以及细胞凋亡和细胞坏死等[2-4]。传统观点认为,坏死是被动的、不可逆的细胞死亡。然而,最近研究发现了一种可受调控的程序性细胞坏死(necroptosis)途径,通过阻断这种细胞坏死通路,可以明显缩小心肌梗死的面积,改善心功能[5]。褪黑素(melatonin,MLT)是由松果体产生的一种内源性吲哚类激素,近年来的研究表明,MLT是保护心肌组织缺血性损伤很有潜力的药物[6],但是MLT抗心肌缺血的机制尚未完全阐明,成为限制其进一步研发和临床应用的瓶颈[7]。为此,本研究从程序性细胞坏死信号通路为切入点,探讨MLT在H9c2心肌细胞缺氧/复氧(hypoxia/reoxygenation,H/R)损伤中的保护作用和机制。
1 材料与方法
1.1 细胞株
H9c2细胞为大鼠胚胎心肌细胞株,购自中国科学院上海生命科学研究所。
1.2 主要试剂和仪器
DMEM培养基购自美国Gibco公司,CCK-8细胞增殖和毒性检测试剂盒购自上海睿时生物科技有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测试剂盒购自广州伟伯科技有限公司;MLT和碘化丙啶(propidium iodide,PI)购自美国Sigma公司;受体相互作用蛋白激酶3(receptor interaction protein kinase 3,RIPK3)抑制剂GSK-872购自北京百奥莱博科技有限公司;兔抗RIPK3多克隆抗体购自美国Milipore公司,兔抗磷酸化钙离子/钙调蛋白依赖蛋白激酶(phosphorylated Ca2+/calmodulin-dependent protein kinase,p-CaMK)Ⅱ多克隆抗体购自上海Cell Signaling Technology公司。细胞培养箱购自美国Thermo公司;SpectraMax iD3酶标仪购自上海美谷分子仪器公司,Western blot成像系统购自上海天能科技有限公司。
1.3 分组及药物干预
将H9c2心肌细胞随机分为对照组、H/R组、MLT组、RIPK3抑制剂GSK-872组。根据参考文献[8],将细胞置于37 ℃,95%N2,5%CO2的培养箱中缺氧处理4 h,然后,在20%O2,5%CO2培养箱中复氧6 h,建立H/R模型。MLT组和GSK-872组细胞在H/R前2 h分别给予MLT(终浓度100 μmol/L)和GSK-872(终浓度5 μmol/L)预处理。对照组是用DMEM培养液在正常条件下培养,不进行药物干预。
1.4 CCK-8法检测细胞活力
细胞处理结束后,先将培养液吸弃,用0.01 mol/L PBS洗3次,加入不含血清的DMEM培养液100 μl及CCK-8检测液10 μl,在37 ℃,5%CO2细胞培养箱内避光孵育2 h,酶标仪检测吸光度(450 nm)。
1.5 培养液中LDH活性检测
测定各组细胞培养液中LDH活性来判断心肌细胞损伤的情况。各组细胞处理结束后,收集培养瓶中的细胞培养液,严格按照广州伟伯科技有限公司试剂盒说明书方法检测各组细胞培养液中LDH的活性。
1.6 碘化丙啶(PI)染色观察细胞坏死情况
各组细胞处理结束后,弃掉培养液,用0.01 mol/L PBS洗3次,加入终浓度为5 μmol/L的碘化丙啶(propidium iodide,PI)及Hoechst 33342(5 mg/L),37 ℃,避光孵育30 min,用PBS洗3次,每次5 min;4%多聚甲醛固定10-15 min;激光共聚焦显微镜观察拍照,并比较各组坏死细胞的数量。
1.7 Western blot检测RIPK3和p-CaMK Ⅱ蛋白的表达量
细胞处理结束后立即吸去培养液,用冰PBS洗涤2次,弃去PBS并吸干残液,加入含有磷酸酶抑制剂和蛋白酶抑制剂的RIPA裂解液100 μl,收集细胞于离心管中,在冰上超声裂解20 min,4 ℃离心,12 000 r/min,15 min;将上清液转至另一离心管中,用BCA法进行蛋白定量,每孔取30 μg总蛋白上样,SDS-PAGE电泳,将蛋白转移至PVDF膜,用5%脱脂奶粉封闭1 h,TBST漂洗3次,分别加入RIPK3抗体(1 ∶400)、p-CaMK Ⅱ抗体(1 ∶800)和β-actin抗体(1 ∶2 000),4 ℃过夜,TBST漂洗后,加入HRP标记的山羊抗兔的二抗(1 ∶3 000),室温孵育2 h;TBST漂洗3次,每次10 min,ECL发光,蛋白表达条带应用Image J软件进行灰度分析。
1.8 统计学分析
以上数据以均数±标准差表示,采用SPSS 19.0软件进行统计,多组间的比较采用单因素方差分析,以P<0.05认为差异有统计学意义。
2 结果
2.1 细胞形态变化及细胞活力检测结果
与对照组相比,H/R处理后,倒置显微镜下观察到H9c2心肌细胞明显皱缩,胞体变短,密度减小,细胞活力显著下降(P<0.01)。与H/R组相比,MLT组大多数细胞呈长梭形,死亡的细胞明显减少,密度增大,细胞活力显著提高(P<0.01);GSK-872组细胞密度也显著增大,呈梭形,与MLT组相比细胞活力没有明显变化(P>0.05,见图1)。
2.2 MLT对H/R处理后H9c2心肌细胞培养液中LDH活性的影响
与对照组相比,H/R组H9c2心肌细胞培养液中LDH活性显著升高(P<0.05)。与H/R组相比,MLT组H9c2心肌细胞培养液中LDH活性明显降低(P<0.01)。GSK-872组LDH活性与MLT组相比无显著差异(P>0.05,见图2)。
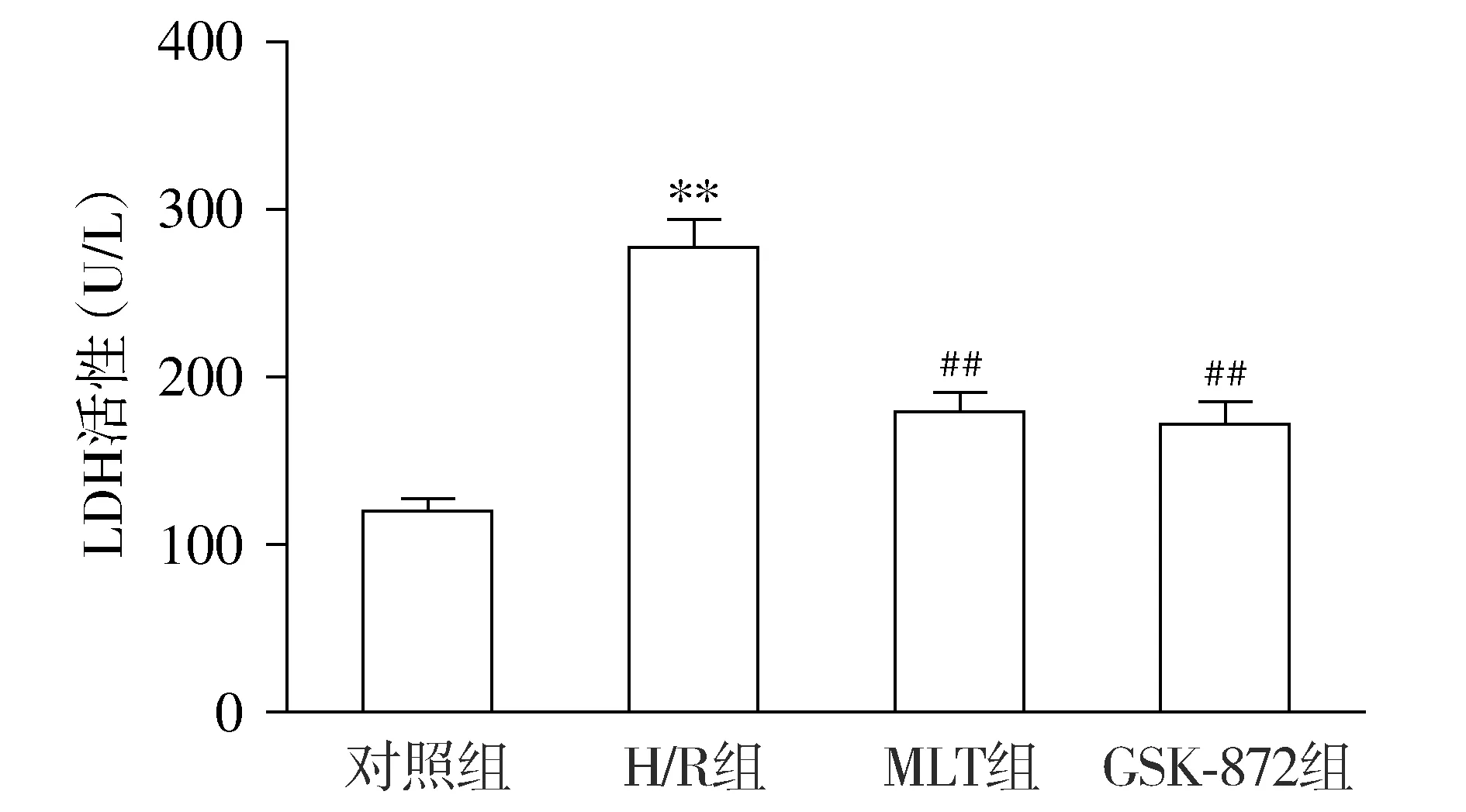
与对照组比较,**P<0.01;与H/R组比较,##P<0.01图2 MLT对H/R处理后H9c2心肌细胞培养液中LDH活性的影响 (n=6)Figure 2 Effect of MLT on LDH activity in cell culture medium after H/R treatment (n=6)
2.3 MLT对H/R处理的H9c2心肌细胞坏死数量的影响
用PI染色观察各组细胞坏死的情况,与对照组比较,H/R组H9c2心肌细胞PI阳性细胞数量显著增加(P<0.01)。与H/R组相比,MLT组H9c2心肌细胞PI阳性细胞显著减少(P<0.01);GSK-872组PI染色阳性细胞数与MLT组相比无显著差异(P>0.05,见图3)。
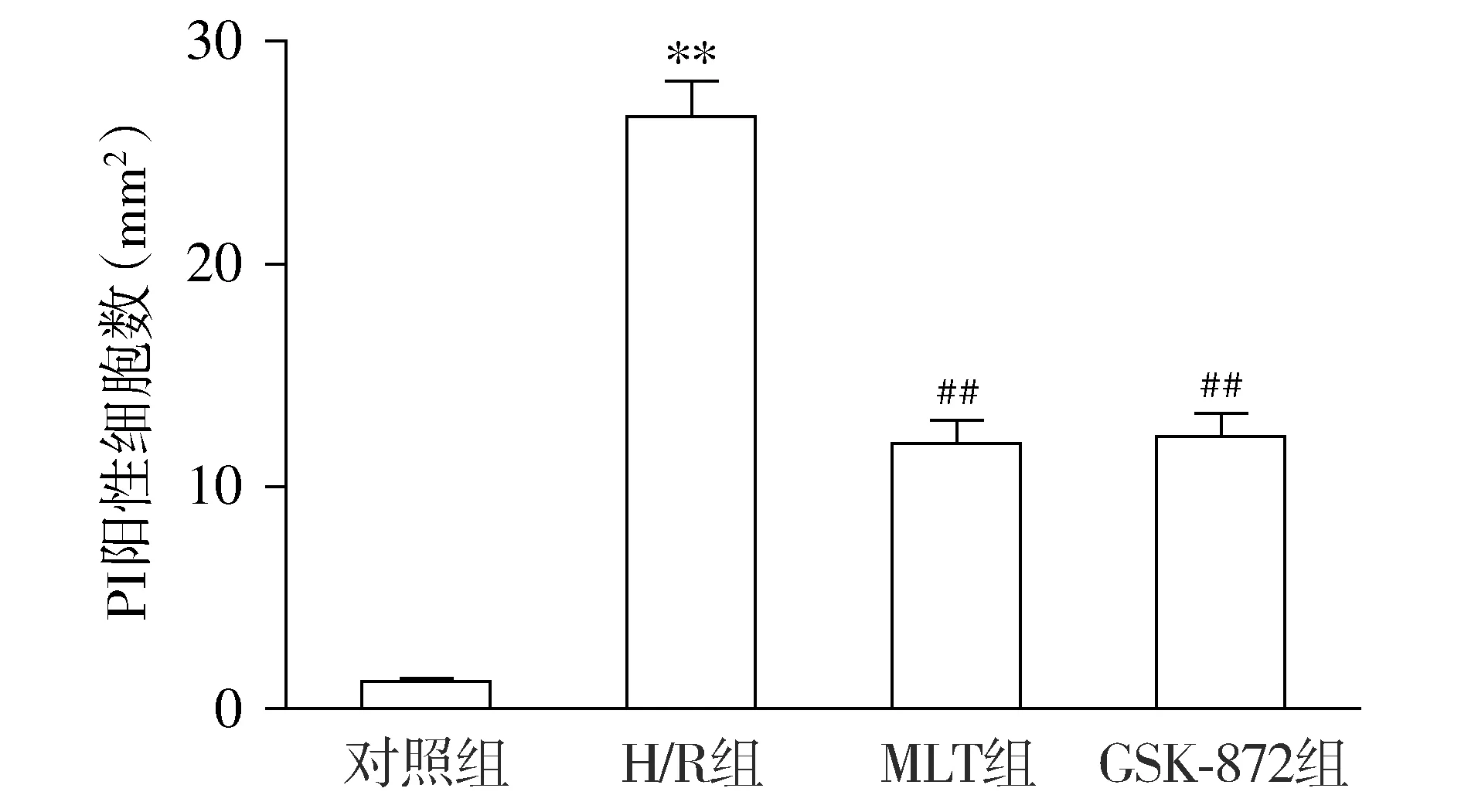
与对照组比较,**P<0.01;与H/R组比较,##P<0.01图3 MLT对H/R处理的H9c2心肌细胞坏死数量的影响 (n=6)Figure 3 Effect of MLT on number of necrotic H9c2 cells after H/R treatment (n=6)
2.4 MLT对H/R处理的H9c2心肌细胞RIPK3和p-CaMK Ⅱ蛋白表达的影响
与对照组相比,H/R组H9c2心肌细胞RIPK3和p-CaMK Ⅱ蛋白的表达均显著增加(P<0.01)。与H/R组相比,MLT组H9c2心肌细胞RIPK3和p-CaMK Ⅱ蛋白的表达均显著下调(P<0.01);而GSK-872组RIPK3和p-CaMK Ⅱ的表达与MLT组相比无显著差异(P>0.05,见图4)。

与对照组比较,**P<0.01;与H/R组比较,##P<0.01图4 各组H9c2心肌细胞中RIPK3和p-CaMK Ⅱ蛋白表达水平的比较 (n=3)Figure 4 Expressionof RIPK3 and p-CaMK Ⅱ proteins in H9c2 cells after different treatment (n=3)
3 讨论
治疗急性缺血性心脏病的核心是快速疏通堵塞或狭窄的冠状动脉,恢复心肌血液供应,但缺血的心肌组织在血供恢复的同时,常常伴有IRI,反而加重心肌损伤,这是AMI患者治疗后出现严重并发症,甚至死亡的主要原因[9]。本研究选用大鼠胚胎期H9c2心肌细胞作为实验对象,先将细胞缺氧处理4 h,然后再复氧6 h以模拟体内心肌IRI,结果显示H/R组H9c2细胞活力明显下降,细胞培养液中LDH释放量明显增加,PI染色阳性细胞数较对照组显著增加,表明经过H/R处理后,细胞坏死的数量明显增多,而Western blot检测显示,H/R组细胞的RIPK3和p-CaMK Ⅱ蛋白表达水平较对照组显著增加,表明这种细胞死亡是由RIPK3/CaMK Ⅱ信号通路介导的程序性细胞坏死,这与文献报道一致[10]。
在心肌IRI中,细胞的死亡方式有两种,即细胞凋亡和细胞坏死。近年研究发现了一种新型的细胞坏死方式,称之为“程序性细胞坏死”,它是可以被调控的,当“死亡信号”被激活或细胞凋亡被抑制时,受体相互作用蛋白激酶1(RIPK1)与RIPK3发生结合,并促使RIPK3磷酸化,进而激活下游信号,如混合谱系激酶域样蛋白(mixed lineage kinase domain-like protein,MLKL),形成坏死小体,最终导致细胞死亡[11,12],并可诱发明显的炎症反应,进一步加重心肌损伤[13]。随着程序性坏死信号通路研究的不断深入,针对其关键分子的干预策略在心肌损伤与重构中逐渐被人们所关注。
MLT是松果体分泌的一种神经内分泌激素,目前研究发现MLT在心血管系统的多种病理模型中具有明确的调节作用,尤其是其具有明显的抗心肌IRI作用,并且由于其属于内源性物质,几乎没有毒副作用,因此,MLT在心血管疾病中的应用将是一个极有前途的研究领域。另有研究结果表明,MLT可降低大鼠心肌IRI的梗死面积,是与其减轻内质网应激、减少细胞凋亡有关[14],但MLT保护心肌的分子机制尚未完全阐明,成为限制其临床应用的瓶颈。本研究结果显示:MLT可显著升高经H/R处理的H9c2心肌细胞的活力,降低细胞培养液中LDH释放量,减少坏死细胞的数量,这表明MLT对H/R处理的H9c2心肌细胞具有显著的保护作用。Wesern blot结果显示,MLT显著下调H/R处理的H9c2细胞中RIPK3和p-CaMK Ⅱ蛋白的表达,提示MLT减少细胞坏死可能与其抑制RIPK3/CaMK Ⅱ信号通路有关。
最近有研究表明,在心肌组织中,CaMK Ⅱ是RIPK3的下游分子,RIPK3可直接与CaMK Ⅱ结合,并使其磷酸化,这是心肌细胞发生程序性坏死的关键[15]。GSK-872是RIPK3的一种特异性抑制剂,能高亲和力结合RIPK3激酶的结构域[16]。本研究将GSK-872预处理的H9c2心肌细胞作为阳性参照,以探讨MLT对H9c2心肌细胞H/R损伤的分子机制和保护效果,结果显示GSK-872可显著增加H/R组细胞的活力,减低LDH的释放,减少坏死细胞的数量,并下调H/R处理后p-CaMK Ⅱ蛋白的表达。
综上所述,本研究用MLT作用于H/R处理的H9c2心肌细胞,研究结果显示MLT可通过抑制RIPK3/CaMK Ⅱ信号通路,从而减少细胞坏死的发生。然而,MLT在H/R损伤中保护H9c2心肌细胞的CaMK Ⅱ下游机制仍然不清楚,是否能通过抑制线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)的开放,降低细胞内钙超载,有待进一步研究。
