γ-Ce2S3 大红色料的研究进展
2020-09-15李月明宋福生王竹梅沈宗洋
李月明,李 新,宋福生,王竹梅,沈宗洋,洪 燕
(景德镇陶瓷大学 材料科学与工程学院;中国轻工业功能陶瓷材料重点实验室;江西省能量存储与转换陶瓷材料工程实验室,江西 景德镇 333403)
0 引 言
γ-Ce2S3大红色料是由法国Rhone-poulenc 公司于20 世纪80 年代推出,并在ColourIndex 进行了权威性登记的一种新型红色色料[1-2]。γ-Ce2S3属于轻稀土倍半型硫化物,具有着色能力强、分散能力高、颜色鲜艳、耐候性好、抗紫外线辐射能力强等优点[3-6]。此外,Ce 元素在地壳中的含量非常丰富,其含量高于Cd、Mo、Cu、Pb 等常用的制备红色色料的元素,使得γ-Ce2S3色料的生产具有天然的价格优势[7],特别是其环保无毒的特点,使其成为替代目前广泛使用的含镉的CdSe1-xSx大红色料的首选材料[8],是近年来各国研究的热点。本文针对γ-Ce2S3大红色料低温易分解和热稳定性差的问题,综述了近年来其在晶体结构、制备方法、离子掺杂改性与包裹稳定等方面的研究进展,并指出了今后研究的方向。
1 γ-Ce2S3 的晶体结构、呈色机理及热稳定性
Ce2S3晶体结构较为复杂,存在α、β 和γ 等三种晶型,其转化关系如(1)所示[9-11]:

式中,α 相为低温相,呈棕黑色,呈Gd2S3型结构,属于正交晶系Pnma 空间群,有确定的化学计量比,稳定存在于900 °C 以下[12]。β 相属于四方晶系,呈棕色、褐色或栗色,其化学组成复杂,稳定温度在900 -1300 °C 之间,通常认为是一种含氧的硫化物[10,13],可表示为Ce10S14O1-xSx(0 ≤x≤1)。γ 相为含Ce 离子缺陷的Th3P4型立方结构,呈大红颜色,属I-43d 空间群,在1300 °C 以上稳定存在,属于Ce2S3的高温相,其化学组成介于Ce2S3和Ce3S4之间,一般可用Ce3-xVxS4(0 ≤x≤ 1/3)表示,其中“V”表示阳离子空位[14-16]。γ-Ce2S3的结构示意图如图1 所示,Ce 离子被8 个S 原子包围,处于正十二面体的中心位置,空位则随机分布于金属原子的位置[10,14,17]。金属离子可以进入上述阳离子空穴中[18,19],这是制备离子掺杂型γ-Ce2S3色料的原因所在。
γ-Ce2S3中的稀土元素Ce 具有4f电子层,其4f与5d电子轨道及其它元素的电子轨道之间易发生电子跃迁,从而发出不同波长的光。其中,Ce4f→Ce5d的电子跃迁时主波长位置处于608 nm左右,使得γ-Ce2S3呈现鲜艳的红色。另一方面,由于S3p→Ce5d的轨道跃迁,使其在紫外光波长区域(250-380 nm)有极高的吸收率,因此,γ-Ce2S3具有较强的抗紫外线辐射能力,其使用过程中能长期保持鲜艳的红色[10]。但是,由于γ-Ce2S3晶体结构内部含阳离子空位(VCe),以及Ce3+离子极易与氧结合,使得γ-Ce2S3在含氧气氛下350 °C 左右即开始氧化分解,从而失去红色,限制了其在高温领域的应用。

图1 γ-Ce2S3 结构示意图[14]Fig.1 Crystal structure of γ-Ce2S3[14]
2 γ-Ce2S3 大红色料的制备
2.1 机械化学法
机械化学法主要是利用球磨、挤压与剪切等方式产生机械力,使原料的物理与化学性质发生变化。如Tsuzuki[20]等人以CeCl3与CaS 为原料,在Ar 气惰性气氛下采用机械球磨的方式,获得了纳米级γ-Ce2S3。但产物中含有CaCl2和β-Ce2S3杂相,虽然可通过蒸馏、超声清洗及离心分离等方式对样品提纯,但其操作繁琐,且需在隔氧条件进行。化学方程式如(2):

2.2 微波辐射法
将稀土金属Ce 与单质S 按2:3 的化学计量比混合,放置于石英管中,抽真空后进行密封处理,放入微波装置加热,利用稀土金属在S蒸气中燃烧,生成γ-Ce2S3[21]。其化学反应方程式如(3):

采用此方法制备γ-Ce2S3色料的过程中需要控制S 蒸气压,防止石英管炸裂。
2.3 液相法
湖南科莱因新材料有限公司采用液相法制备γ-Ce2S3,在底液(云母粉和水配制而成)中使得水溶性三价铈盐(Ce3+)和水溶性硫化物反应生成溶胶,然后过滤并烘干,将所得产物与NH4SCN 混合均匀,在800-1000 °C 煅烧获得γ-Ce2S3[22]。但该方法操作较为复杂,且制备周期较长。
2.4 固-固合成法
包头稀土研究院发明了固-固合成法制备γ-Ce2S3,其采用金属铈屑(Ce)与过量10-30wt.%的ZnS 粉末混合均匀后,压制成料块,放入坩埚中,并置于真空炉内,抽真空至10-1Pa,然后充入压力为 5×104-7×104Pa 的纯净氩气(Ar),升温至1000-1100 °C 下保温5-8 h,反应完成后,多余的ZnS 和反应产物(金属Zn)蒸发成气体凝结在坩埚上端的冷凝器内,将反应后的料块磨细、过筛,即可得到γ-Ce2S3粉末[23]。反应方程式如(4):

包头市宏博特科技有限公司则以Ce 的化合物为原料,碱金属化合物为添加剂,硫磺为硫化剂,活性炭为辅助剂,在高温下反应制备γ-Ce2S3红色色料。该工艺反应物料全部为固体,使用较为安全,便于储运;反应速度快,合成效率高;反应尾气排放量少,容易回收[24],因此,目前工业生产γ-Ce2S3多采用该方法。
2.5 气-固相法
气-固相法也是制备稀土硫化物的主要方法之一,该方法多采用稀土氧化物及其盐在高温条件下与H2S、CS2等硫源反应。采用H2S 硫化的方式,其反应方程式如(5):

以H2S 为硫源,其反应时间短,但反应所需温度在1200 °C 以上,且合成产物存在物相不纯、制备的粉末团聚严重等问题,此外,H2S 本身毒性也较大。北京有色金属研究所对该方法进行了改良,采用两段法制备γ-Ce2S3。将净化处理的H2通入装有硫磺的不锈钢热炉(温度高于300 °C)以产生H2S,富余的H2作为载气,将混合气体载入装有γ-Ce2S3的高温炉中[25]。该方法采用的原料安全且易于保存,避免了H2S 有毒气体发生泄露危害的可能。
采用CS2硫化方式,其反应方程式如(6):
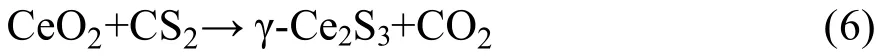
该方法主要利用CS2在常温条件下易挥发的特性,以惰性气体为载气,将CS2气体载入装有γ-Ce2S3的高温炉进行反应,其缺点是当温度过高时CS2会分解,生成的C 和S 会附着在样品表面,使得样品色度降低[26-28]。而Hirai[27]等人采用低温硫化结合真空热压烧结法制备了γ-Ce2S3纯相。该方法首先将CeO2在800 °C 经CS2气氛硫化成α-Ce2S3,制备的α-Ce2S3粉末装入真空烧结炉,在真空度为7.3×10-3Pa、压力为20 MPa 的炉内烧结。结果发现,当烧结温度为1700 °C 时,可制备单相γ-Ce2S3。虽然该方法能够获得高纯度的目标产物,但该方法对设备要求高、能耗大,仅适用于实验室研究。
3 离子掺杂改性研究
从上述介绍的各种制备γ-Ce2S3的方法可知,纯相γ-Ce2S3制备有一定的难度。传统的制备方法多以CeO2为原料,经H2S 在1200 °C 及以上温度保温120 min 获得,但是制备的硫化产物伴随着β杂相,且存在烧结严重、颗粒粒径大等缺点,不利于后续研磨、分散等处理[28,29]。因此,许多研究人员开展了降低γ-Ce2S3合成温度的研究。
由于γ-Ce2S3是具有晶格缺陷的Th3P4立方结构,研究者发现通过引入其它离子,可以有效降低γ-Ce2S3合成温度。其中,研究较多的掺杂离子有碱金属离子、碱土金属离子、稀土离子等金属元素以及碳族、氮族等非金属元素。
3.1 碱金属离子掺杂改性研究
碱金属离子掺杂能降低γ-Ce2S3的合成温度。李月明团队以CS2为硫源,采用气-固相法系统地研究了碱金属离子(Li+、Na+、K+)掺杂对γ-Ce2S3合成温度及性能的影响,结果如表1 及图2 所示。由表1 及图2 可知,上述Li+[30]、Na+、K+[31]离子掺杂均能有效降低纯相γ-Ce2S3的合成温度,由1200 °C 分别降低至900 °C、900 °C、840 °C。Li+离子掺杂制备的γ-Ce2S3,样品颜色整体呈现较好的红色,红度值(a*)与黄度值(b*)随着掺杂量的增加先增大后减小,在nLi/Ce= 0.20 时,样品红度值最佳值为L*= 27.25、a*= 32.83、b*= 13.23;Na+离子掺杂制备的γ-Ce2S3,随着其离子掺杂量的逐渐增加,红度值(a*)与黄度值(b*)也是先增加后减小,样品颜色由暗红色向红色再略向橙红色转变,在nNa/Ce= 0.15 时,样品红度最大值为L*= 27.01、a*= 31.70、b*= 19.62;K+离子掺杂制备的γ-Ce2S3,随着其离子掺杂量的逐渐增加,红度值(a*)与黄度值(b*)均逐渐减小,但黄度值下降相对红度值而言更加缓慢,且黄度值略高于红度值,因此,样品颜色由红色转变为橙红色,最后转变为黄色,当nK/Ce= 0.10 时,样品红度值最大为L*= 33.86、a*= 36.68、b*= 38.15。
由上述结果可知,三种碱金属离子掺杂均能有效降低γ-Ce2S3的合成温度;离子掺杂后都会影响其颜色。随着掺杂离子半径的逐渐增大,碱金属离子掺杂型γ-Ce2S3红度达到最佳值的掺杂量逐渐减小;离子半径较小的Li+、Na+离子掺杂制备的γ-Ce2S3样品颜色随着掺杂量增加,黄移现象不明显,而离子半径较大的 K+离子掺杂制备的γ-Ce2S3样品颜色出现明显的黄移现象。
此外,也有其它课题组研究了碱金属离子Na+掺杂对γ-Ce2S3的合成温度及物相组成的影响。储茂友[25]等人以H2S 为硫源,采用新型硫化方式(两段法),通过Na+掺杂在1000 °C 即可合成γ-Ce2S3,其中,当nNa/Ce= 0.20 时,合成的样品为纯γ-Ce2S3。Vasilyeva[32]等人以H2S/CS2混合气体为硫源,在850 °C 下制备了Na+掺杂型γ-Ce2S3,研究发现Na+离子掺杂在样品表面与内部呈不规则分布;同时,通过Raman 分析,确定了微量的CeS2或CeS2-x等杂相的存在。

表1 不同碱金属离子掺杂型γ-Ce2S3 的合成温度及最佳色度Tab.1 Synthesis temperature and optimal chromaticity of γ-Ce2S3 doped with different alkali metal ions

图2 不同碱金属离子掺杂型γ-Ce2S3 样品的色度值:(a) Li+[30]; (b)Na+; (c)K+[31]Fig.2 Chromaticity values of the γ-Ce2S3 samples doped with different alkali metal ions: (a) Li+[30], (b) Na+ and (c) K+[31]
3.2 碱土金属离子掺杂改性研究
碱土金属离子掺杂也能降低γ-Ce2S3的合成温度。李月明团队采用气-固相法/液相共沉淀法,以CS2为硫源,系统研究了碱土金属离子掺杂对γ-Ce2S3合成温度及性能的影响,结果如表2 及图3 所示。由表2 及图3 可知,碱土金属离子Ca2+、Sr2+、Ba2+均能将 γ-Ce2S3的合成温度降低至900 °C。其中,通过气-固相法制得的Ca2+掺杂型γ-Ce2S3色料,随着Ca2+离子掺杂量的增加,样品由暗红色逐渐转变为红色,最后转变为橙红色;当nCa/Ce= 0.40 时,样品红度最佳值为L*= 31.75、a*= 24.50、b*= 16.01(如图3(a))[33]。采用液相共沉淀法制备Ca2+掺杂型γ-Ce2S3色料,当nCa/Ce=0.08 时,其红度最佳值为L*= 26.90、a*= 21.08、b*= 8.51[34]。采用液相共沉淀法制备的Sr2+离子掺杂型γ-Ce2S3色料,其颜色随着Sr2+离子掺杂量的逐渐增加,由红色转变为橙红色,最后转变黄色。当nSr/Ce= 0.15 时,样品红度最佳值为L*= 33.14、a*= 33.42、b*= 22.16(如图3(b))[35,36]。采用液相共沉淀法制备的Ba2+离子掺杂型γ-Ce2S3色料样品的颜色随着Ba2+离子掺杂量的增加,也由红色转变为橙红色,最后转变为黄色;当nBa/Ce= 0.10 时,红度最佳值为L*= 33.51、a*= 37.07、b*= 27.18(如图3(c))[37]。
此外,也有其它课题组研究了Ca2+掺杂对合成温度及色度的影响,如Urones-Garrote[38]等人以Ca(NO3)2为掺杂源、CS2为硫源,使γ-Ce2S3的合成温度降低至 900 °C,依化学式 Ca(3/2)yR2-y-V0.25-(1/2)yS3,当Ca2+掺杂量为y= 0.30 mol 时,样品红度最佳值为L*= 43.77、a*= 23.21、b*=10.93。
由上述结果可知,碱土金属离子掺杂也均能有效降低γ-Ce2S3的合成温度至900 °C。碱土金属离子掺杂后也会影响其颜色,随着掺杂离子半径的逐渐增大,Ca2+、Sr2+、Ba2+离子掺杂型γ-Ce2S3样品最佳红度值逐渐增大;色料的颜色随着掺杂量增加均出现黄移,但离子半径较小的Ca2+掺杂型γ-Ce2S3色料颜色黄移不明显,而离子半径较大的Sr2+、Ba2+掺杂制备的γ-Ce2S3色料颜色则出现明显的黄移现象。
对于离子掺杂后色料颜色发生的变化,许多研究人员进行了深入的分析,提出了相关机理,如Perrin[14]等人基于Na+掺杂型γ-Ce2S3(nNa/Ce=0.20),从理论上模拟其电子结构,进而从能带角度解释γ-Ce2S3呈色是由于Ce 4f向Ce 5d发生电子跃迁,Na+引入能够使边带能级均匀化,使γ-Ce2S3呈色由红色转变为橙色。再者,碱金属或碱土金属掺杂离子在γ-Ce2S3晶体中固溶度有限,若超过其最大溶限,则易产生第二相,从而影响样品呈色。如当Na+/Ce3+掺杂摩尔比超过0.30 时,硫化产物中便含有暗紫色的第二相NaCeS2,影响色料颜色[39]。

表2 不同碱土金属离子掺杂型γ-Ce2S3 的合成温度及最佳色度Tab.2 Synthesis temperature and optimal chromaticity of γ-Ce2S3 doped with different alkaline earth metal ions

图3 不同碱土金属离子掺杂型γ-Ce2S3 样品的色度值:(a) Ca2+[33]; (b)Sr2+[35, 36]; (c)Ba2+[37]Fig.3Chromaticity values of the γ-Ce2S3 samples doped withdifferent alkaline earth metal ions: (a) Ca2+[33],(b) Sr2+[35, 36] and (c) Ba2+[37]
3.3 稀土离子掺杂改性研究
采用稀土离子掺杂γ-Ce2S3色料,其降低合成温度的作用更加明显。以Eu2+、Dy3+离子掺杂时,可将γ-Ce2S3的合成温度降低至600-800 °C。这是由于这类稀土离子能在较低温度形成相应的γ-RE2S3相(与γ-Ce2S3同结构),此γ 相作为γ-Ce2S3的晶核,直接在晶种表面形成γ-Ce2S3。如罗昔贤[40]等人以Eu3S4作为合成γ-La2S3的有效晶种,使 γ-La2S3的合成温度从 1000 °C 以上降低至700 °C。这是因为在CS2气氛下,Eu2O3在400 °C被硫化成Eu3S4(Eu3S4与γ-La2S3同为立方Th3P4型结构,其晶格常数差仅为2.3%)。在低温时,γ-La2S3直接在Eu3S4晶种表面生长,这个过程跳过了常规的相转化。Marrot[41]等人采用重稀土离子(Dy3+、Ho3+、Er3+等)使 γ-Ce2S3的合成温度降 低至600-800 °C,但是这种相稳定是可逆的,一旦合成温度超过800 °C,便会出现γ 相向β 相逆转化现象。另一方面,稀土离子除La3+和Y3+之外,其它离子均含有4f电子,使得在掺入稀土离子过程中会引入新的电子跃迁,也会对γ-Ce2S3呈色产生影响,如Eu2+掺杂制备的γ-La2S3,其颜色逐渐由黄色逐渐转变成了红褐色。
3.4 碳族离子掺杂改性研究
除了金属离子掺杂能降低γ-Ce2S3色料的合成温度外,采用碳族等非金属元素掺杂也能降低其合成温度。由于C 和Si 具有较强俘获氧原子能力,将它们与Ce 前驱体混合硫化,能够在600-800 °C形成γ-Ce2S3。这是由于C 或Si 元素的引入,使得Ce 与S 能够在低温下迅速形成α 相,促进β 相向γ 相转化,温度越高,促进效果越明显。但由于C和Si 残存于色料中,会导致合成色料发暗[42]。因此,在Ce 前驱体高温硫化的过程中,很多研究者不会直接使用碳粉,而是采用石墨舟[43],且在硫源的选择上,通常采用CS2或NH4SCN 等易储存的含硫化合物[44]。
B 和P 元素也能在低温下合成γ-Ce2S3。如周明明[45]等人通过Na 和B 复合掺杂的方式,在1000 °C 即可合成纯相γ-Ce2S3。通过该方法制备的γ-Ce2S3红色色料,呈色鲜艳,在600 °C 仍稳定存在。但当B/Ce 超过0.40 时,色料易出现其他杂相(如透明的CeBO3和黑色的B2S3),从而影响样品色度。Roméro[42]等人通过P 掺杂,将γ-Ce2S3合成温度降低至800 °C。但一旦合成温度超过800°C,以PS3-形式支撑晶格的P元素便会以P2S5形式脱离体系,致使γ-Ce2S3结构坍塌,从而又转变为α-Ce2S3相。

图4 复合离子掺杂型γ-Ce2S3 样品色度:(a) Sr2+-Dy3+[50], (b) Sr2+-Ho3+ [51], (c) Ba2+-Y3+[52], (d) Ba2+-Sm3+[52]Fig.4 Chromaticity values of γ-Ce2S3 samples doped with multiple ions: (a) Sr2+-Dy3+[50], (b) Sr2+-Ho3+[51],(c) Ba2+-Y3+[52] and (d) Ba2+-Sm3+[52]

表3 不同离子复合掺杂型γ-Ce2S3 的合成温度及最佳色度Tab.3 Synthesis temperature and optimal chromaticity of γ-Ce2S3 doped with different multiple ions
3.5 复合离子掺杂改性研究
许多研究人员进一步研究发现,在单一离子掺杂的基础上,选择合适的其他离子复合掺杂,可进一步有效调控γ-Ce2S3样品的颗粒尺寸、色度等指标,部分离子的引入还可继续降低γ-Ce2S3合成温度(见表3 及图4)。如周明明[45]等人以CS2为硫源,采用气-固相法基于单一Na+掺杂的基础上,通过引入Ca2+离子,在1000 °C 制备了Na+-Ca2+复合掺杂型γ-Ce2S3红色色料。结果显示,通过调控γ-Ce2S3晶体中阳离子空位数,当Na+与Ca2+掺满的空穴数为1/6,Na:Ca 空位比例由1︰0 提升至1︰1 时,样品色度由L*= 39.28、a*= 49.97、b*= 29.75 提升至L*= 52.57、a*= 52.02、b*= 39.12,表明Ca2+的引入可进一步提升样品色度。王竹梅[46]等人以CS2为硫源,采用液相共沉淀法在900 °C 制备Ca2+-Eu2+复合掺杂型γ-Ce2S3红色色料,基于nCa/Ce= 0.16,当Eu2+掺杂量为0.03 mol时,样品色度最佳值为L*= 21.17、a*= 11.26、b*= 5.81,表明通过Eu3+掺杂,可以调控样品颜色。
Romero[42]等人以H2S 为硫源,基于nNa/(Ce+RE)= 0.20,RE = La、Pr、Gd、Dy、Y、Ho、Er、Tm、Yb、Lu、Sc,当RE/Ce ≤0.1 时,合成的为纯γ-Ce2S3相;随着稀土离子的复合掺杂,从反射率R400%及R700%处数值的小幅变化,可知样品颜色出现轻微变化。吴宪江[47]等人采用固-液混合方法引入Na+、Pr3+和Nd3+元素,在1000 °C 时H2S 气氛下制备出新型五元稀土倍半硫化物γ-Na-Ce-Pr- Nd-S 红色色料,制备的色料颗粒均匀,分散性良好。当nPrNd︰nCe︰nNa= 1︰9︰2 时,色度最佳值为L*=50.10、a*= 42.71、b*= 18.99。张树婷[48]等人通过溶胶-凝胶法在850 °C 时,CS2气氛下制备Na+-Y3+掺杂型云母包裹的γ-Ce2S3色料。结果表明,基于nNa/Ce= 0.20,当Y3+掺杂量为0.4 mol(即γ-Ce1.6Y0.4S3)时,制备的云母包裹型γ-Ce2S3的色度最佳值为L*= 58.82、a*= 33.15、b*= 15.94。高轶群[49]等人采用水热法在900 °C 下经CS2硫化制备Na+-Pr3+掺杂型γ-Ce2S3红色色料。基于nNa/Ce= 0.20,当Pr3+掺杂量为0.1 mol 时,所得色料粒径分布均匀,此时色度最佳值为L*= 29.14、a*=30.13、b*= 16.81。
李月明[50]等人采用液相共沉淀法在730 °C 制备了Sr2+-Dy3+复合掺杂型γ-Ce2S3红色色料,基于nSr/Ce= 0.15,当Dy3+掺杂量为0.15 mol 时,相对于单一Sr2+离子掺杂的色料,Sr2+-Dy3+复合掺杂使得 γ-Ce2S3合成温度由 900 °C 进一步降低至730 °C,样品色度由L*= 33.14、a*= 33.42、b*= 22.16 提升至L*= 37.13、a*= 34.77、b*= 29.44。刘琪[51]等人采用液相共沉淀法制备了Sr2+-Ho3+复合掺杂型γ-Ce2S3红色色料,基于nSr/Ce= 0.15,当Ho3+掺杂量为0.10 mol 时,相对于单一Sr2+离子掺杂的色料,Sr2+-Ho3+复合掺杂也使得γ-Ce2S3合成温度由900 °C 进一步降低至730 °C,样品色度则由L*= 33.14、a*= 33.42、b*= 22.16 提升至L*=38.43、a*= 36.38、b*= 30.81。李新[52]等人采用液相共沉淀法在nBa/Ce= 0.10 的基础上, RE3+离子以n(Ba)/n(Ce1−xREx) = 0.10 (RE = Y, Sm,x=0.00, 0.01, 0.03, 0.05, 0.10 mol,简写为S.RE0.00,S.REm0.01,S.RE0.03,S.RE0.05,S.RE0.10)形式引入,结果表明,适宜的硫化温度由 900 °C 降低至850 °C;当RE 为Y3+时,色料的色度值从L*=31.84、a*= 30.95、b*= 23.63(S.Y0.00)增加至L*=36.69、a*= 41.83、b*= 41.00(S.Y0.01);当RE 为Sm3+时,色料的色度值从L*= 31.84、a*= 30.95、b*= 23.63(S.Sm0.00)增加至L*= 34.63、a*= 35.36、b*= 38.88(S.Sm0.01)。
综上所述,在碱土金属离子掺杂的基础上,再引入合适的稀土离子,可有效降低γ-Ce2S3的合成温度,并提升样品的色度值,其中,在Ba2+基础上再掺杂Y3+、Sm3+等离子,其颜色仍然能保持鲜艳的大红颜色,展示了其良好的发色能力。
4 γ-Ce2S3 的热稳定性研究
4.1 离子掺杂型γ-Ce2S3 的热稳定性研究
离子掺杂能有效降低γ-Ce2S3的合成温度,同时也能适当地提高其热稳定性。作者研究团队基于Li+、Na+、K+、Ca2+、Sr2+、Ba2+等离子掺杂型γ-Ce2S3(色度最佳时的样品),分别研究其热稳定性,通过分析其TG-DTA/DSC 曲线,并结合XRD分析其在加热过程中的性能变化,发现离子掺杂能在一定程度上提高其热稳定性,结果如表4、图5 及图6 所示。由表4、图5 及图6 可以看出,对于Li+掺杂型γ-Ce2S3而言,当nLi/Ce= 0.20 时,其DSC 初始放热峰为503.8 °C,该组分色料在空气气氛下450 °C 煅烧30 min 仍呈现纯γ-Ce2S3相[30];Na+掺杂型γ-Ce2S3的DTA 初始放热峰在480 °C;而对于K+掺杂型γ-Ce2S3,发现当nK/Ce= 0.10 时,其DTA 初始放热峰为552.1 °C,将该组分在空气气氛下420 °C 煅烧10 min 仍呈现纯相γ-Ce2S3相[31]。
对于碱土金属离子掺杂制备的γ-Ce2S3而言,Ca2+掺杂型γ-Ce2S3,当nCa/Ce= 0.40 时,其DTA初始放热峰为543.3 °C,该样品置于空气气氛下490 °C 煅烧10 min 仍保持纯γ-Ce2S3相[33]。Sr2+掺杂型γ-Ce2S3,发现当nSr/Ce= 0.15 时,其DTA初始放热峰为499.5 °C,该组分在空气气氛下410 °C 保温30 min 仍保持纯γ-Ce2S3相[35,36]。Ba2+掺杂型γ-Ce2S3,当nBa/Ce= 0.10 时,其DTA 初始放热峰为440 °C,将此组分在空气气氛下440 °C煅烧10 min 仍保持较好红色,其色度值为L* =30.10、a* =25.33、b* =12.71,表明其热稳定性较好(如图7)[37]。此外,随着煅烧温度的提升,样品XRD 物相检测虽然仍显示为纯γ-Ce2S3,但色度逐渐降低,李新[37]等人认为这是由于在高温促进下,样品颗粒逐渐团聚,使得颗粒尺寸增大,而颗粒尺寸的增大不利于样品呈色,因此出现上述现象。
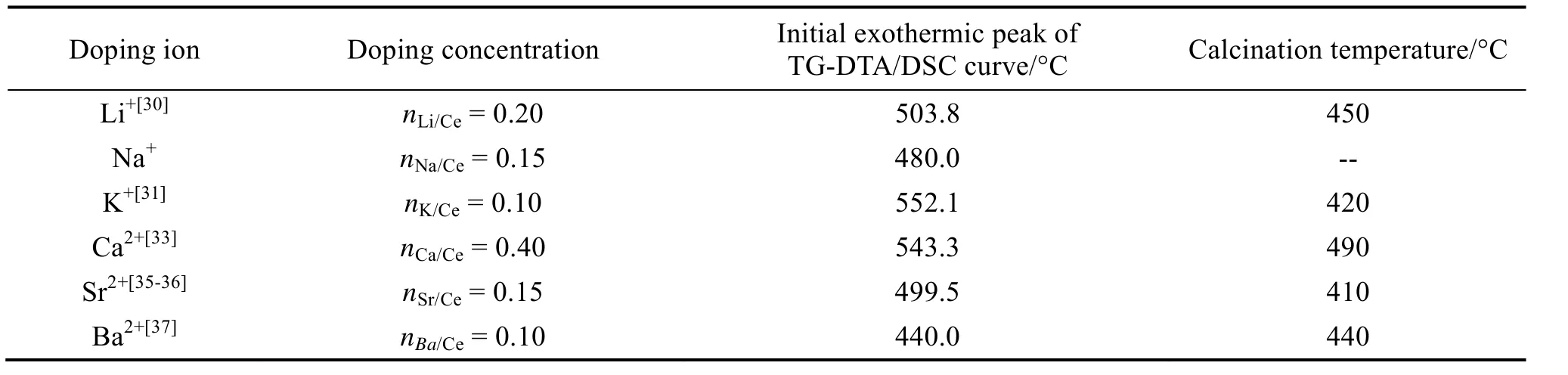
表4 碱金属及碱土金属离子掺杂对γ-Ce2S3 热稳定性的影响Tab.4 Thermal stabilities of γ-Ce2S3 doped with alkali metal and alkaline earth metal ions

图5 碱金属及碱土金属离子掺杂型γ-Ce2S3 的TG-DTA/DSC 曲线图:(a)-(f)分别表示Li+[30]、Na+、K+[31]、Ca2+[33]、Sr2+[35-36]、Ba2+[37]Fig.5 TG-DTA/DSC curves of the γ-Ce2S3samples doped with alkali metal and alkaline earth metal ions:(a) Li+[30], (b) Na+, (c) K+[31], (d) Ca2+[33], (e) Sr2+[35-36] and (f) Ba2+[37]

图6 碱金属及碱土金属离子掺杂型γ-Ce2S3 空气气氛下不同温度点煅烧的XRD 图:(a)-(e)分别表示Li+[30]、K+[31]、Ca2+[33]、Sr2+[35-36]、Ba2+[37]Fig.6 XRD patterns of γ-Ce2S3doped with alkali metal and alkaline earth metal ions after calcination at different temperatures in air: (a) Li+[30], (b) K+[31], (c) Ca2+[33], (d) Sr2+[35-36], (e) Ba2+[37]

图7 nBa/Ce = 0.10 样品在不同温度下煅烧的色度值[37]Fig.7 Chromaticity values of the samples with nBa/Ce = 0.10 calcined at different temperatures[37]
复合离子掺杂也能适当提高γ-Ce2S3的热稳定性。作者研究团队基于 Ca2+-Eu2+、Na+-Pr3+、Sr2+-Dy3+、Sr2+-Ho3+、Ba2+-Y3+、Ba2+-Sm3+复合掺杂型γ-Ce2S3,选择其最优呈色组成的样品,采用相同的研究方法分析离子掺杂后色料的热稳定性,发现复合离子掺杂也在一定程度上提高其热稳定性,结果如表5、图8 及图9 所示。对于Ca2+-Eu2+复合掺杂型γ-Ce2S3红色色料,基于nCa/Ce= 0.16,当Eu2+掺杂量为0.03 mol 时,在空气气氛下测试的TG-DSC 曲线显示,样品的初始放热峰温度为564.0 °C,相较于Ca2+单一离子掺杂时的506.3 °C 以及Eu2+单一离子掺杂时的553.3 °C,Ca2+-Eu2+共掺样品的热稳定性要优于单一离子掺杂[46]。对于Na+-Pr3+复合掺杂型γ-Ce2S3红色色料,基于nNa/Ce= 0.20,当Pr3+掺杂量为0.10 mol 时,所得色料粒径分布均匀,相对于单一Na+离子掺杂的色料,Na+-Pr3+复合掺杂型色料在空气气氛下的热稳定温度由380 °C 提升至470 °C[49]。对于Sr2+-Dy3+复合掺杂型γ-Ce2S3红色色料,基于nSr/Ce= 0.15,当Dy3+掺杂量为0.15 mol 时,该组分色料在空气气氛下410 °C 煅烧30 min 后仍具有较好的色度,其色度值为L*= 31.49、a*= 30.94、b*=25.33[50]。对于Sr2+-Ho3+复合掺杂型γ-Ce2S3红色色料,基于nSr/Ce= 0.15,当Ho3+掺杂量为0.10 mol时,该组分色料在空气气氛下390 °C 煅烧30 min后仍表现较好的色度,其色度值为L*= 32.43、a*= 28.24、b*= 21.65[51]。对于Ba2+-RE3+(RE = Y, Sm)复合掺杂型γ-Ce2S3红色色料,基于nBa/Ce= 0.10,当RE3+掺杂量为0.01 mol 时,该组分色料在空气气氛下440 °C 时仍呈现纯γ-Ce2S3相[52]。
此外,其他课题组也对复合掺杂型γ-Ce2S3的热稳定性做了一些研究。如吴宪江[47]等人通过引入Na+、Pr3+和Nd3+元素,制备了新型五元稀土倍半硫化物γ-Na-Ce-Pr-Nd-S 红色色料。该色料颗粒均匀、分散性良好,在空气气氛下的热稳定温度相对于未掺杂的而言提升了30 °C。

表5 复合离子掺杂对γ-Ce2S3 热稳定性的影响Tab.5 Thermal stabilities of γ-Ce2S3 doped with multiple ions

图8 复合离子掺杂型γ-Ce2S3 的TG-DTA/DSC 曲线图:(a) - (f)分别表示Ca2+-Eu2+[46]、Na+-Pr3+[49]、Sr2+-Dy3+[50]、Sr2+-Ho3+[51]、Ba2+-Y3+[52]、Ba2+-Sm3+[52]Fig.8 TG-DTA/DSC curves of γ-Ce2S3 samples doped with multiple ions: (a) Ca2+-Eu2+[46], (b) Na+-Pr3+[49], (c) Sr2+-Dy3+[50],(d) Sr2+-Ho3+[51], (e) Ba2+-Y3+[52] and (f) Ba2+- Sm3+[52]

图9 复合离子掺杂型γ-Ce2S3 空气气氛下不同温度点煅烧的XRD 图:(a) - (c)分别表示Sr2+-Dy3+[50]、Ba2+-Y3+[52]、Ba2+-Sm3+[52]Fig.9 XRD patterns of γ-Ce2S3 samples doped with multiple ions after calcination at different temperatures in air:(a) Sr2+-Dy3+[50], (b) Ba2+-Y3+[52] and (c) Ba2+-Sm3+[52]
以上分析表明,通过掺杂合适的离子,可将γ-Ce2S3在空气气氛下的热稳定温度由350 °C 提升至380-564 °C。对于离子掺杂可将γ-Ce2S3的热稳定温度提升的原因,吴宪江[47]等人认为一是由于镨钕混合硫化物本身的抗氧化能力较强;二是与铈的倍半硫化物形成置换固溶体后使得γ-Ce2S3发生晶格畸变,增加了其位错阻力,因此提高了色料的热稳定性。作者研究团队[30,31,33,35-37,50]则认为离子的掺入填充了γ-Ce2S3晶体结构内部阳离子空位并取代了部分Ce3+,这使得其位错阻力增加,从而提高了色料的热稳定性。
但是,由上述结果可知,离子掺杂型γ-Ce2S3的热稳定性仍较低。因此,为了更加有效提升γ-Ce2S3色料的热稳定性,研究者们将研究重点投向了在色料表面进行包裹处理。
4.2 包裹型γ-Ce2S3 的热稳定性研究
针对如何提高γ-Ce2S3的热稳定性的问题,研究人员参考ZrSiO4包裹型CdSe1-xSx色料(记为CdSe1-xSx@ZrSiO4)色料的研究,提出在γ-Ce2S3表面包裹耐高温的物质,如ZnO、SiO2、ZrSiO4、Al2O3及MgAl2O4等,在不影响γ-Ce2S3呈色情况下,提高其高温稳定性。这种思路多采用液相法制备上述无色透明物质并定向包裹在γ-Ce2S3颗粒表面,形成核壳或镶嵌结构,达到隔绝O2的作用,从而提高其热稳定性。
毛文鑫[53]等人采用沉淀法结合原位聚合法,在γ-Ce2S3色料表面形成40 nm 厚度的ZnO 包裹层。合成的 γ-Ce2S3@ZnO 色料在空气气氛下380 °C 时仍稳定存在。陈镇华[54]等人采用均相沉淀法,在商用γ-Ce2S3色料表面形成厚度均匀的ZnO 包裹层(如图10)。该方法以六亚甲基四胺为沉淀剂,利用其在不同温度下水解程度不同,控制Zn(OH)2脱水缩合凝胶化形成ZnO,采用该方法制备的γ-Ce2S3@ZnO 色料在空气气氛下380 °C时也仍稳定存在。通过在γ-Ce2S3表面包裹一层ZnO,色料热稳定性有一定幅度的提升(由350 °C提升至380 °C)。

图10 样品的TEM 图: (a)纯γ-Ce2S3,(b) ZnO 包裹γ-Ce2S3[54]Fig.10 TEM images of the samples: (a) pure γ-Ce2S3 and (b) γ-Ce2S3@ZnO[54]
刘顺国[55]等人以SiO2作为包裹层,采用改良的Stöber 法,利用正硅酸乙酯在碱性条件下水解,制备SiO2溶胶包裹商用γ-Ce2S3色料(如图11),在经还原性气氛下埋烧形成γ-Ce2S3@SiO2色料,结果表明,其在空气气氛下的热稳定温度可提升至550 °C。在此基础上,对其进行了二次及三次包裹,二次包裹层的厚度由一次包裹层的70 nm 增厚至100 nm;三次包裹层的厚度由一次包裹层的70 nm增厚至140 nm。经三次包裹的色料空气气氛下在570 °C 仍保持较好红色,其色度值为L*= 25.47、a*= 30.91、b*= 24.59;将其加入到陶瓷釉中,发现620 °C 时仍保持较好红色,其色度值为L*=30.28、a*= 32.45、b*= 26.40[56]。章彧[57-58]等人采用溶剂热法制备了γ-Ce2S3@SiO2,发现当Ce:Si摩尔比为1︰3 时,γ-Ce2S3@SiO2包裹效果最佳,该包裹色料在空气气氛下550 °C 时仍稳定存在且保持较好的红度值,其a*= 29.84(未包裹的色料为a*= 0.73)。在此基础上,章彧[58]等人对γ-Ce2S3色料进行了二次包裹,结果显示,二次包裹的包裹层厚度由一次包裹的0.5 μm 增加至1 μm 左右,在空气气氛下550 °C 煅烧之后,色料的红度值a*为31.98(高于一次包裹的29.84)。于世泳[59]等人以SiO2作为包裹体,通过溶胶-凝胶法预先将CeO2包裹,形成CeO2@ SiO2核壳结构,后对包裹体进行硫化,制备出γ-Ce2S3@SiO2色料,该包裹型色料在空气气氛下550 °C 时仍稳定存在。李月明[60]等人基于γ-Ce2S3@SiO2,通过对比水解法与水解-水热法两种不同的合成方法,结果显示水解-水热法制备的γ-Ce2S3@SiO2包裹效果更佳,当醇水比为7︰1 时,包裹色料表面的SiO2包裹层厚度适中、更加致密,该色料在空气气氛下550 °C 仍保持较好的红度值,其a*= 22.16,表明其热稳定性较好。豆立娜[61]等人采用溶胶- 凝胶法制备了γ-Ce2S3@SiO2,当Si/Ce = 2、H2O/Si = 16︰1 时,水浴温度为40 °C 时,SiO2在γ-Ce2S3表面形成均匀致密的包裹层,该包裹型色料在空气气氛下500 °C 时仍呈现棕红色,其色度值为L*= 16.97、a*= 7.32、b*= 14.85。在此基础上进行二次包裹实验,其包裹厚度明显增加,将包裹色料在空气气氛下经500 °C 煅烧,其颜色与未煅烧色料颜色基本一致。
以上研究结果表明,通过SiO2包裹,可使色料的热稳定温度得到有效提升(由350 °C 提升至500-620 °C);多次包裹相对于一次包裹而言,由于其包裹层厚度增加,使得多次包裹的色料热稳定性更好。
高轶群[62]等人则以ZrO2作为包裹体,采用水解-水热二步法在商用γ-Ce2S3色料表面包裹ZrO2,包裹后的色料色度值为L*=44.38、a*= 31.94、b*= 23.14,将该包裹色料在空气气氛下380 °C 煅烧10 min 后仍保持一定的红色,其色度值为L*=42.71、a*= 26.23、b*= 18.38,表明其热稳定性也得到了提升。乐少文[63]等人采用水热法制备了SiO2/ZrSiO4复合包裹型γ-Ce2S3,结果显示,当nCe/Zr= 1,PVP 添加量为γ-Ce2S3@SiO2质量的20%,pH = 9 时,获得的γ-Ce2S3@SiO2/ZrSiO4,相对于γ-Ce2S3@SiO2色料,其在空气气氛下的热稳定温度提升了147 °C。

图11 不同TEOS 浓度制备的SiO2 干凝胶包裹的γ-Ce2S3 的TEM 照片:(a) 15 mg/mL,(b) 35 mg/mL[55]Fig.11 TEM images of the γ-Ce2S3 particles coated with SiO2 xerogel with different TEOS concentrations:(a) 15 mg/mL and (b) 35 mg/mL[55]
由上述结果可知,在γ-Ce2S3表面包裹处理后其热稳定性有一定的提升,但其提升的幅度还不足以使γ-Ce2S3应用于高温领域。在包裹致密的前提下,γ-Ce2S3的热稳定温度为何不能得到大幅度的提高,在加热过程中依旧会失去红色。究其原因,是由于γ-Ce2S3是含有缺陷的立方Th3P4结构。如果Ce 和S 原子严格按照立方Th3P4结构排布,其化学计量比应是Ce3S4。但实际测量的化学计量比为Ce2.67S4,这说明在γ-Ce2S3的晶体结构存Ce离子空位,其空位的形成过程如式(6)所示:

其中,由于每个Ce 原子与8 个S 原子([CeS8])配位形成三角十二面体,相邻的十二面体在共边或共面时,会产生S4四面体空位[18,64-68]。正是由于这些空位的存在,氧分子容易在晶体中传导,再经热诱导作用,形成新的化合物,从而失去红色。
而包裹只能将γ-Ce2S3与外部环境隔绝,并不能从根本上解决由晶体结构缺陷导致其热稳定性不佳的问题。因此,要想从根本上解决γ-Ce2S3热稳定性差的问题,必须从稳定γ-Ce2S3内部晶格出发,通过不等价离子掺杂,填补空位方式,稳定γ-Ce2S3晶格,再通过外部包裹的协同作用以大幅度提升γ-Ce2S3的热稳定性。
4.3 掺杂/包裹协同型γ-Ce2S3 的热稳定性
Zhang[48]等人采用溶胶-凝胶法通过在云母表面沉积γ-Ce2-xYxS3,制备了云母/γ-Ce2-xYxS3复合红色色料。当云母/γ-Ce1.8Y0.2S3时,该包裹型色料的TG-DSC 曲线显示500 °C 之前无任何吸热或放热峰,且第一个放热峰出现在534 °C,表明其在空气气氛下的热稳定温度达到500 °C。高轶群[69]等人采用微乳液法通过Al 基(刚玉及尖晶石)复合包裹Na+-Nd3+复合掺杂型γ-Ce2S3(如图12、14),当nCe︰nNd︰nAl︰nMg=1.00︰0.05︰8.00︰4.00,pH = 12 时合成的色料经酸洗之后在空气气氛下800 °C 时仍保持较好的红色,其色度值为L*=36.03、a*= 23.97、b*= 21.51。
对于无定型SiO2包裹型γ-Ce2S3,作者研究团队发现,由于在较高温度下无定型SiO2易产生收缩,从而使得原本被包裹严密的色料重新裸露在外;同时,无定型SiO2随着温度的升高发生晶化而收缩,导致包裹层孔隙率随着温度的升高逐渐增大,这使得无定型SiO2包裹的γ-Ce2S3提升热稳定性还是很有限[56]。因此,针对掺杂/包裹协同型研究,在以SiO2为包裹体时,研究者们提出了采用晶型氧化硅(c-SiO2)包裹。如乐少文[70]等人采用Stöber 法通过c-SiO2包裹Sr2+掺杂型γ-Ce2S3,发现当nSr/Ce= 0.15,Ce3+/Si4+= 0.4 mol 时,合成的色料样品色度最佳,其值为L*= 38.22、a*=28.97、b*= 25.49,通过空气气氛下的TG-DTA 分析发现,相对于Sr2+掺杂的γ-Ce2S3,其放热峰由479 °C 大幅提升至883 °C(如图15)。吴福灵[71]等人采用酸、碱分步催化溶胶-凝胶法制备c-SiO2包裹碱金属离子掺杂型γ-Ce2S3(如图13),在空气气氛下于500-900 °C 煅烧后,呈色为鲜艳的红色,其色度值为L*= 36-40.5、a*= 28-38、b*= 27-33,表明该方法制备的γ-Ce2S3@c-SiO2具有优异的热稳定性。
由以上结果可知,通过掺杂/包裹协同作用制备的γ-Ce2S3,其热稳定温度维持在500- 900 °C(空气气氛下),这极大地拓展了γ-Ce2S3的应用范围。但是,γ-Ce2S3应用于高温大红色料领域的公开报道很少,说明还需要做更为深入细致的研究。

图12 Al 基镶嵌型包裹后样品TEM 图[70]Fig.12 TEM image of the sample coated with Al-based mosaic[70]

图13 c-SiO2 包裹后样品TEM 图[72]Fig.13 TEM image of the sample coated with c-SiO2[72]

图14 Al 基包裹型γ-Ce2S3 的TG-DSC 曲线[70]Fig.14 TG-DSC curve of Al-based coated γ-Ce2S3[70]

图15 c-SiO2 包裹型γ-Ce2S3 的TG-DTA 曲线[71]Fig.15 TG-DTA curves of γ-Ce2S3 coated with c-SiO2[71]
5 结 语
随着对γ-Ce2S3色料研究的深入,研究者们已经解决了诸如低温下难以制备颜色鲜艳的γ-Ce2S3色料的难题,通过掺杂、包裹或掺杂/包裹协同作用使γ-Ce2S3的热稳定性得到一定程度的提升,但γ-Ce2S3大红色料的应用研究,仍存在以下问题需进一步解决。
(1) 对于离子掺杂型γ-Ce2S3,掺杂离子是如何改变γ-Ce2S3的禁带宽度,进而使得γ-Ce2S3颜色发生变化,目前尚无确切的理论解释。
(2) 对于包裹型γ-Ce2S3热稳定性的研究,虽然研究者们针对云母、ZnO、Al 基、无定型SiO2、c-SiO2、ZrSiO4等多种包裹体进行了单一或复合包裹研究,但目前在空气气氛下γ-Ce2S3的热稳定温度仅限于500-900 °C,还有待进一步提升。
(3) 为进一步提升γ-Ce2S3的热稳定性,可采用无色透明且高温状态下仍稳定存在的ZrSiO4包裹体。但是γ-Ce2S3@ZrSiO4的制备相对较难,主要是由于Zr 极易在硫化状态下与S 结合,形成锆硫化物,难以形成单独的ZrSiO4包裹层。因此,可以采用多层包裹的制备方法,先在γ-Ce2S3色料表面包裹一层SiO2,然后再引入Zr 源,从而在SiO2表面形成ZrSiO4包裹层。
