AFP阴性原发性肝癌临床特征及预后因素分析*
2020-09-15韩鹏伟王虎明赵天永
韩鹏伟,王虎明,赵天永
原发性肝癌(primary liver cancer, PLC)是全球癌症相关死亡的第二大原因。近年来,大多数国家PLC患者死亡率明显增加,而5 a生存率不到5%。每年肝癌发病为85万例左右,约90%肝癌为肝细胞癌(hepatocellular carcinoma,HCC)[1,2]。HCC的发病是多因素、多步骤的复杂过程,受环境和个体双重因素的影响。测定血清AFP水平不仅应用于肝癌的筛查,也用于临床诊断和患者预后的随访[3]。在我国,约有30%~40%HCC患者血清AFP阴性[4],导致有些患者的早期诊断很棘手,也不利于患者的预后随访。外科手术是治疗HCC最为有效的方法[5],但多数患者经外科手术治疗后仍无法获得良好的预后,术后肿瘤复发率、转移率和患者病死率仍较高[6]。本研究分析了影响血清AFP阴性的PLC患者生存的相关因素,为临床决策提供依据。
1 资料与方法
1.1 一般资料 根据《原发性肝癌诊疗规范标准》(2017年版)[7],选择2013年3月~2017年3月于本院住院治疗的血清AFP阴性的PLC患者34例,男性26例,女性8例;年龄为43岁~82岁,平均年龄为52.45±8.65岁,其中小于60岁者11例,大于等于60岁者23例。所有患者的诊断均经过影像学及术后组织病理学检查证实。所有患者均被告知研究内容并签署知情同意书。
1.2 治疗方法 所有34例患者均接受肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)治疗。根据肿瘤大小、数目和全身情况,给予5-氟尿嘧啶500~600 mg/m2、吡柔比星40~50 mg/m2、奥沙利铂50~150 mg/m2等,应用超液化碘油10 ml,与化疗药混合成乳剂,必要时加用明胶海绵或微球栓塞。然后,根据肝脏肿瘤对治疗的反应和患者肝功能情况,决定下一次TACE治疗,间隔时间为1~2个月。其中19例患者接受了三维适形放疗 (three-dimensional conformal radiotherapy, 3-DCRT),放射野主要为肝脏病灶。

2 结果
2.1 生存率情况 本组34例患者1 a、2 a和3 a生存率分别为91.2%、85.3%和73.5%(图1)。
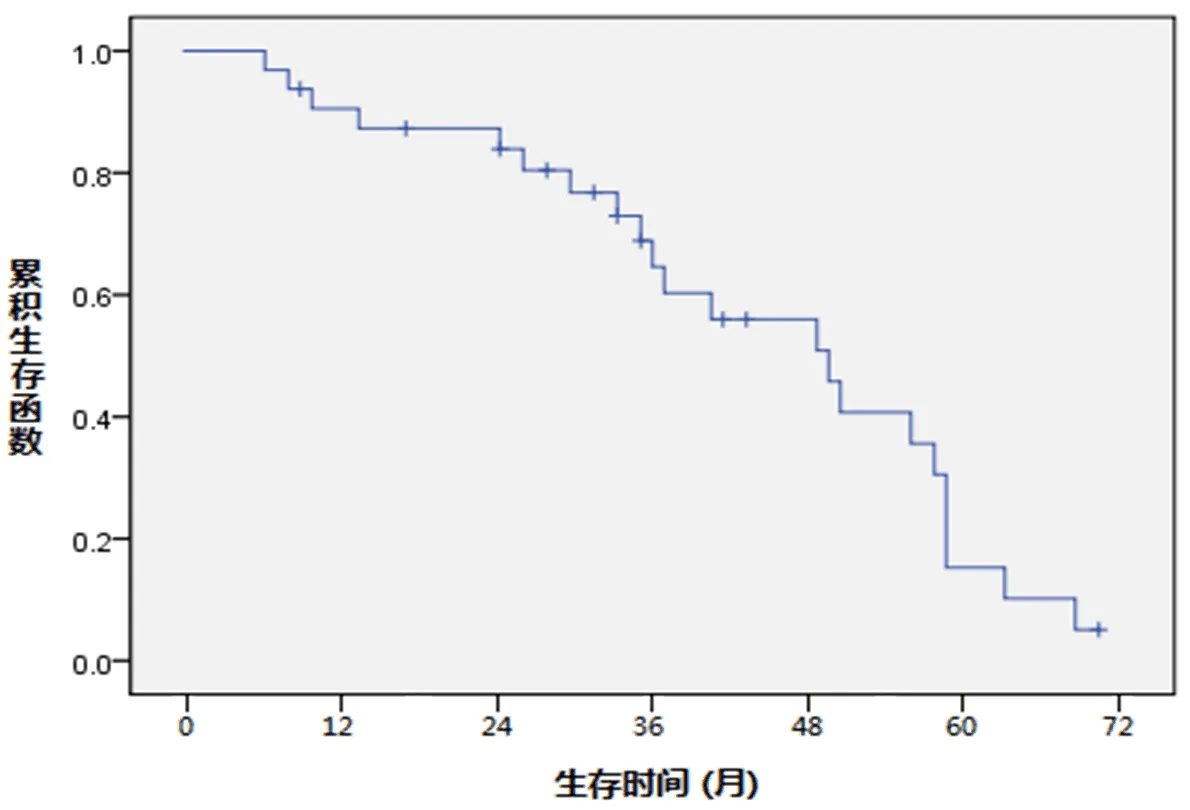
图1 本组34例患者总体生存时间
2.2 影响生存的单因素分析 结果显示肿瘤大小、门脉癌栓形成、Child-Pugh分级、组织学分级、肝外转移、血清CEA水平、疗效和放疗是影响AFP阴性原发性肝癌患者预后的因素(均P<0.05,表1)。
表1 影响AFP阴性PLC患者预后的单因素分析
2.3 COX多因素分析结果 将单因素分析有意义的变量纳入COX回归模型进行分析,结果显示门脉癌栓形成、Child-Pugh分级、组织学分级、肝外转移、血清CEA水平、疗效和放疗是AFP阴性原发性肝癌预后的独立影响因素(均P<0.05,表2)。发生肺转移患者死亡风险较无肺转移患者增加2.067倍(P=0.013,95%CI:1.451~3.012);血清CEA升高较正常患者死亡风险增加1.633倍(P=0.040,95%CI:1.022~2.608);组织学分化低的患者较中/高分化者的死亡风险增高1.823倍(P=0.034,95%CI:1.116~2.431);伴有脉管癌栓者较无脉管癌栓者死亡风险增高了1.079倍(P=0.039,95%CI:1.004~1.160);疗效达到CR者较PD患者死亡风险降低了0.567倍(P=0.020,95%CI:0.355~0.907),PR和SD患者较PD患者死亡风险未见明显降低;放疗较未行放疗治疗的患者死亡风险降低0.621倍(P=0.017,95%.CI:0.419~0.919)。

表2 COX多因素分析结果
3 讨论
本研究单因素分析显示不同肿瘤大小(≤5 cm与>5 cm)患者间存在生存差异(P<0.05),而多因素分析提示肿瘤大小不是其独立的预后因素(P=0.326,P>0.05)。与其他大多数肿瘤类似,对于肿瘤患者,我们一直认为转移灶数量越多,患者生存时间就会越短,且内脏转移的患者较骨和软组织转移预后更差。本组远处转移灶数量<2处和≥2处患者的生存时间单因素分析有统计学差异(P=0.035,P<0.05),但多因素分析却未提示远处转移灶数量是AFP阴性原发性肝癌的独立预后因素(P=0.098),考虑可能为两组临床特点不均衡导致(远处转移灶数量<2处的患者有28例,而≥ 2处的患者仅6例)。
本组11例发生骨转移。单因素分析显示存在骨转移与否患者间存在生存差异(P=0.027,P<0.05),而多因素分析并未提示骨转移是AFP阴性PLC患者的独立预后因素(P=0.618),分析原因可能是本组中所有骨转移患者均在确诊后疾病控制相对较好所致。肺是原发性肝癌最常见的转移器官,约占肝外转移的一半左右[8]。在本研究中有8列患者伴有肺转移,对这8例伴有肺转移的患者研究发现其生存期显著短于无肺转移患者(P=0.002,P<0.05)。
肿瘤组织中的肿瘤标志物含量远远高于正常组织,有研究报道CEA对诊断PLC、评估患者治疗预后均具有重要的价值[9]。Yoshikawa et al[10]研究也显示CEA对于评估PLC的预后有重要价值。本研究中单因素分析CEA升高组较CEA正常组预后差,是影响PLC预后的危险因素(P=0.010,P<0.05)。进一步采用Cox多因素分析发现血清CEA水平是影响HCC患者生存预后的独立因素(P=0.040,P<0.05),也证实血清CEA升高的HCC患者预后较差,本研究结果与有关报道[11]相符。
TACE治疗在HCC患者的生存质量方面取得了令人鼓舞的结果,疗效已被充分肯定[12]。作为一种微创治疗HCC方案已经成为临床上主要的治疗手段[13,14]。Takayasu et al[15]研究探讨了TACE疗效与患者生存的关系,在其研究中提示TACE治疗显著提高了患者的生存率。有研究也显示肝癌术后联合TACE治疗显著提高了患者的生存率【16】。本研究中34例患者均经CT或核磁等影像学检查手段评价疗效,单因素分析提示TACE疗效与总生存之间具有明显的相关性(P=0.001,P<0.05),是影响AFP阴性PLC患者预后的重要因素,并且在多因素分析中提示其是影响AFP阴性PLC患者生存的独立预后因素(P=0.011,P<0.05),与以上研究结果一致。最近,多项研究[16]提示以TACE为主的综合治疗可明显提高患者的生存质量,3-DCRT在PLC患者也取得了良好的临床疗效[17]。本研究行放射治疗患者与未行放射治疗的患者相比生存优势明显(P=0.009,P<0.05),多因素分析也显示放疗是影响AFP阴性PLC患者预后的独立因素(P=0.017)。有报道显示[18,19],放疗联合TACE可成为晚期肝癌伴门静脉癌栓患者一个较好的治疗选择,并较单纯TACE治疗明显提高了中位生存期。有研究也同样显示TACE联合放疗提高了患者的生存质量和生存期[20]。