超声造影检查无创评估放射性肝损伤患者可行性研究*
2020-09-15张贵琼胡小丽
杨 华,曾 畅,罗 芳,张贵琼,胡小丽
近年来,三维适形放疗被越来越广泛地应用于腹部恶性肿瘤的治疗,具有肿瘤治疗大剂量和重要脏器小剂量的效果,临床效果良好。放射性肝损伤(radiation-induced liver injury,RILI)是指一定剂量的辐射对肝细胞造成的损伤所引起的一系列病理生理变化[1]。RILI是腹部肿瘤放疗的常见并发症。在大多数情况下,早期急性RILI是可以恢复的。然而,如果不进行相应的临床对症处理,它可能会继续发展为亚急性RILI,进而最终导致肝功能衰竭,总体病死率很高[2]。因此,早期发现和诊断RILI对肝脏的恢复性治疗具有重要意义。一些研究已经探索了早期诊断和治疗RILI的有效方法,包括建立RILI动物模型和某些影像学诊断方法。当下,对RILI常用的检查手段为CT和MRI检查等,它们主要是能发现与RILI相关的形态学改变。肝损伤的影像学表现并不具有特异性。由于受到放射疗程长短和剂量大小的影响,CT和MR检查对肝损伤的早期诊断和鉴别诊断存有较大的局限性[3,4]。超声造影(contrast-enhanced ultrasonography, CEUS)在对肝脏的肝实质改变、血流信号和血管形态变化方面具有诊断价值。先前,有关RILI动物实验研究表明,CEUS能够直接反映RILI早期微血管循环动力学的变化[5],而有关CEUS诊断RILI的临床研究报道还很少。本研究旨在比较腹部恶性肿瘤患者在三维适形放疗前后CEUS检查肝脏各定量参数的变化,以探索应用其诊断RILI的可能性。
1 资料与方法
1.1 研究对象 2016年6月~2020年1月我院接受放射治疗的腹部恶性肿瘤患者42例,男性30例,女性12例;平均年龄为(60.2±8.8)岁。其中胆管细胞癌12例,壶腹癌17例,胰头癌13例。经组织病理学检查诊断肿瘤。RILI诊断符合以下情况:放射治疗照射野累及肝脏;肝脏密度改变与照射野相一致;既往无肝脏解剖结构改变病史;彩色多普勒超声检查提示肝内光点增粗,回声逐渐增强,可见条状或网格状回声,肝内血管壁增厚,回声增强,血管走行扭曲,少数肝内血管显示不清,血流信号提示充盈差,肝轮廓不规整,肝脏体积缩小;肝功能改变与超声表现相一致[6-8]。纳入标准:肝功能Child-Pugh A级;无三维适形放疗禁忌证;预期生存时间≥6个月。排除标准为:放疗前影像学检查提示肝脏弥漫性病变、肝外转移或远处转移;肝功能Child-Pugh B级或C级;有腹部(肝脏)病灶放疗史;合并严重的内科疾病。本研究经我院医学伦理委员会批准通过,纳入患者签署知情同意书。
1.2 放射治疗方法 使用XHA600D Elekta Infinity直线加速器(医科达医疗器械有限公司,北京)及其配套的时间-强度曲线(TIC)分析软件。嘱患者平静呼吸,双手置于头顶部,在CT模拟机上定位,扫描层厚为3 mm,范围为自膈顶至右肾下极。将图像传入XIO4.80计划系统后,勾画病灶大体肿瘤靶区,由大体肿瘤靶区外放得到计划靶区。按照危及器官勾画全肝,进行评估优化放射治疗方案,照射4~5个照射野,常规分割剂量,照射剂量率为200 cGy/min。应用剂量-体积直方图评估肝脏照射剂量。
1.3 CEUS检查 根据等剂量曲线,选择2400~2600 cGy/25~30次照射剂量区域进行超声检查。使用迈瑞R7型超声诊断仪或GE公司生产的Logiq E9型超声诊断仪(探头频率为2~5 MHz)和SonoVue超声造影剂(Bracco公司,意大利)。先进行二维和彩色多普勒超声检查肝脏,观察肝实质和肝内血管,了解肝脏病变形态和血管条件。根据等剂量曲线选择合适的肝实质区域,避开大血管后行CEUS检查。经肘部浅静脉以团注方式注入造影剂1.5~2.4 ml。使用前,将SonoVue与生理盐水充分混匀,制备成混悬液。采集超过180秒,并以医学数字成像和通信格式存储,用于离线分析。记录以下CEUS定量参数:达峰时间(time to peak,TTP)、曲线上升斜率(gradient,GRAD)和曲线下面积(area under the curve,AUC)。

2 结果
2.1 典型RILI患者超声造影表现 见图1。

图1 RILI患者超声造影表现 62岁男性壶腹癌患者在三维适形放疗治疗2 w后,CEUS表现 A:动脉期表现为肝内光点增粗,回声逐渐增强;B:延迟期见条状或网格状回声区,门静脉内呈明显的“黑洞”,肝区呈“蜂窝状”改变
2.2 CEUS定量参数变化 在放射治疗2 w后,RILI患者TTP显著长于放疗前(P<0.05),GRAD显著低于放疗前(P<0.05),AUC显著小于放疗前(P<0.05);继续放射治疗至3~4 w,TTP更加延长,GRAD更加缩小(P<0.05,表1),而AUC变化缺乏规律性。
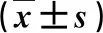
表1 42例RILI患者CEUS定量参数变化
2.3 肝功能变化 腹部恶性肿瘤患者三维适形放疗3w、放疗4w与放疗前、放疗2w ALT、AST、GGT及AKP均具有统计学差异(P<0.05,表2)。
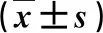
表2 42例RILI患者放疗前后肝功能指标变化
3 讨论
近年来,三维适形放射治疗已广泛应用于腹部恶性肿瘤的治疗,但放疗后引起的RILI已成为影响患者辐射剂量耐受性最重要的因素[9]。因此,早期发现和诊断RILI对肝脏的恢复性治疗具有重要的临床意义。目前,常见的检查RILI的方法是CT和MRI,但早期RILI在CT和MRI上并无特异性的影像学表现。先前的研究业已证明CEUS能够显示出组织器官微循环状况,成像效果与增强CT和MRI检查相一致[10-13]。通过文献检索可知,以前的研究多集中在肝脏肿瘤、肝硬化和肝再灌注损伤等方面[14]。本研究选择TTP、GRAD和AUC作为CEUS的定量分析参数。TTP是反映组织内外血流速度的指标,GRAD反映组织的平均灌注率,AUC则与该区域的血容量和血流速度有关。本研究结果表明,在放疗后2 w和3 w,随着肝损伤程度的加重,TTP逐渐升高,AUC逐渐降低。根据这些研究结果可以获知CEUS可以较好地反映早期RILI患者肝脏血流灌注的变化,能够及时、准确地评估可能发生的RILI的存在,对临床治疗方案的选择、疾病监测和临床预后具有重要的意义。
研究表明,典型的RILI患者肝组织病理学表现为肝静脉闭塞性疾病,其主要特点是肝细胞弥漫性肿胀、变性,并伴有肝细胞坏死、出血,汇管区炎性细胞明显增多,肝窦和中央静脉闭塞、充血[15]。RILI早期病变主要为肝窦充血和肝窦内皮细胞损伤后的炎性细胞渗出。在本研究中,CEUS能够清楚地反映肝脏灌注的变化。我们认为,在放射治疗1个月内的急性RILI,肝实质脂肪变性,肝细胞逐渐肿胀,肝内小静脉和肝窦扩张、充血或出血,导致肝内管腔结构受压、变性,肝实质血流灌注持续减少。随着肝损伤的进展,肝实质内出现炎性细胞浸润,肝细胞变性坏死,炎性坏死组织阻塞肝脏微循环通路,同时肝窦内皮细胞损伤引起的肝窦充血和炎性细胞渗出可能导致肝窦狭窄、阻塞,导致流入肝窦的血流量减少,导致肝窦血流量减少[16]。在照射后半年,肝损伤进一步加重,肝窦毛细血管化,此时肝体积缩小,肝细胞片状变性,窦壁和小血管增厚,形成肝实质纤维化改变。肝内纤维化结构的增加压迫了肝脏的外周小叶下静脉、中央静脉和肝窦,小血管壁和窦壁网状纤维明显增加,导致动静脉压升高,微血管血流量减少,肝脏的总血流量减少[17]。上述原因导致肝实质硬化,TTP升高,并随RILI的加重而逐渐升高。
在放疗后2 w和3 w,随着肝损伤程度的加重,AUC逐渐降低,在放疗后4 w,AUC反而升高。RILI早期可出现类似于连续毛细血管的肝窦毛细血管化,表现为肝窦内皮细胞损伤,内皮细胞窗减少或消失,内皮下形成连续基底膜,这种改变引起肝细胞内物质和氧交换的紊乱,最终导致肝细胞萎缩和肝窦塌陷,肝窦血流减少,AUC逐渐降低[18]。随着肝损伤的加重,肝窦阻塞加重,导致血液回流缓慢,晚期肝脏血流灌注时间延长,AUC又增加。肝内细胞因子,如转化生长因子β-1、结缔组织生长因子和血小板衍生生长因子,是促进肝星状细胞合成胶原纤维并加速其向成纤维细胞转化的驱动因子[19]。成纤维细胞的增殖和它们与周围纤维束的连接导致纤维隔膜的形成。纤维间隔内的血管在肝动脉、门静脉和肝静脉之间形成交通支,分流血液,使肝脏整体血流回升。但RILI病情逐渐进展,早期细胞因子表达不明显,2 w后其表达逐渐增强[20]。
在放疗后2月复查,多数患者超声显示与照射野一致的肝内光点增粗,回声逐渐增强,可见条状或网格状回声区,此时复查患者患者肝功能指标如ALT、AST、GGT和AKP均显著性上升。由这些结果可推测相对于其他肝功能指标,RILI患者血清ALT和GGT变化更为显著,临床上需要谨慎对待,必要时予以及时的处理。