基质辅助激光解吸电离飞行时间质谱检测耐碳青霉烯肺炎克雷伯菌的价值
2020-09-11赵金云许文芳金法祥
赵金云 许文芳 金法祥
革兰阴性杆菌,尤其是肠杆菌科是导致院内及社区获得性感染的主要原因,可引起人体多种系统感染。此类细菌可产生多种耐药酶,包括超广谱茁-内酰胺酶,质粒AmpC型茁-内酰胺酶和碳青霉烯酶等[1],因此可对多种抗生素耐药。碳青霉烯类抗生素被认为是抗感染治疗的最后一道防线,但在过去的十年里,耐碳青霉烯肠杆菌科细菌的出现和传播,尤其是耐碳青霉烯肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae,CRKP)具有较高的发病率和病死率,对公众健康造成了严重威胁[2-3]。快速而准确地鉴定出CRKP可尽早为临床控制和预防感染提供帮助。基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization timeof-fligh mass spectrometer,MALDI-TOF MS)技术作为一种新型快速的微生物鉴定方法,由于其诸多优势越来越受到实验室的青睐[4]。本研究评估MALDI-TOF MS技术在临床实验室中快速鉴定CRKP的价值,现将结果报道如下。
1 材料与方法
1.1 菌株 选择2019年10月至2020年3月本院住院感染患者分离的肺炎克雷伯菌140株(去除重复菌株)。质控菌株为肺炎克雷伯菌ATCC 700603。全部菌株经常规生化及法国梅里埃Vitek 2-Compact全自动细菌鉴定仪鉴定,用亚胺培南纸片筛选出CRKP 33株,检出率为 23.57%。其中 26株(78.79%)来自男性,7株(21.21%)来自女性。标本类型以痰液11例(33.33%)和尿液8例(24.24%)为主,其次为脓液5例(15.15%)、血液5例(15.15%)、导管2例(6.06%)和分泌物2例(6.06%);内科分离菌株数多于外科,其中分离自重症医学科最多,为10例(30.30%),其次为老年医学科8例(24.24%),之后是呼吸科5例(15.15%)、消化内科4例(12.12%)、内分泌科2例(6.06%)、普外科2例(6.06%)和骨科2例(6.06%)。
1.2 试剂和仪器 细菌DNA提取试剂盒、PCR扩增试剂盒以及电泳仪由无锡市克隆遗传技术研究所提供。
1.3 药敏试验 根据美国临床和实验室标准协会(clinical and laboratory standards institute,CLSI)指南,通过微量肉汤稀释法对收集的CRKP进行药物敏感性测定,结果参照CLSI M100-S27标准。
1.4 耐药基因检测
1.4.1 细菌DNA提取 挑取单个菌落置入已预混好的60滋l Triton X-100(终浓度为0.45%)与蛋白酶 K(终浓度为200 ng/ml)溶液中,然后56益温浴90 min,再94益温浴25 min。冷冻保存待检。
1.4.2 耐药基因检测 采用PCR方法检测33株CRKP中的碳青霉烯酶编码基因,包括blaGES、blaKPC、blaIPM、blaVIM、blaNDM和blaOXA-48,引物序列如表1所示。每种基因检测PCR扩增的反应总体积为20滋l:包括重组耐热DNA聚合酶(日本Takara公司产品)1个单位(体积0.2滋l),10倍浓度的缓冲液2滋l;P1引物2滋l(1.0滋mol/L),P2引物2滋l(1.0滋mol/L);dNTP混合液2滋l(各种浓度均2 mmol/L);超纯水7滋l以及菌株DNA提取液4.8滋l。PCR检测扩增热循环为:95益预变性3 min,然后95益变性0.5 min,55益复性0.5 min,72益延伸1.0 min,共30循环,最后72益延长至5 min。经2%琼脂糖凝胶潜水式电泳20 min,出现与阳性对照分子量相同的条带即判别为阳性。对阳性产物进行测序并将获得的DNA序列与NCBI GenBank数据库(https://www.ncbi.nlm.nih.gov/genbank/)中的DNA序列进行比较。

表1 基因引物序列及扩增片段长度
1.5 CRKP鉴定 采用MALDI-TOF MS鉴定CRKP,挑取单个菌落均匀涂抹在靶板样本孔位上,记录位置和编号,滴加1滋l 70%甲酸,晾干后滴加1滋l基质溶液,再次晾干后使用MALDI Biotyper RTC模式进行检测,利用flexAnalysis软件分析蛋白图谱。
2 结果
2.1 CRKP对抗菌药物的敏感性 见表2。
由表2可见,所有菌株对碳青霉烯类和头孢菌素类抗生素的耐药率均为100.00%;仅1株对氨曲南敏感;对氟喹诺酮类抗生素(环丙沙星和左氧氟沙星)的耐药率略低,但均在80.00%左右;对氨基糖苷类抗生素(庆大霉素和阿米卡星)的耐药率最低,但均高于60.00%。共有20株(60.61%)CRKP对上述3种以上抗菌药物耐药,因此定义为多重耐药菌株。
2.2 耐药基因检测结果 见图1-2(图1见插页)。

图1 blaKPC测序结果
由图1可见,blaKPC基因序列图谱与NCBI Gen原Bank数据库中序列一致。进一步检测发现共有24株CRKP携带blaKPC基因,其余9株未检测出碳青霉烯酶编码基因;未检测出blaGES、blaIPM、blaVIM、blaNDM和blaOXA-48基因。
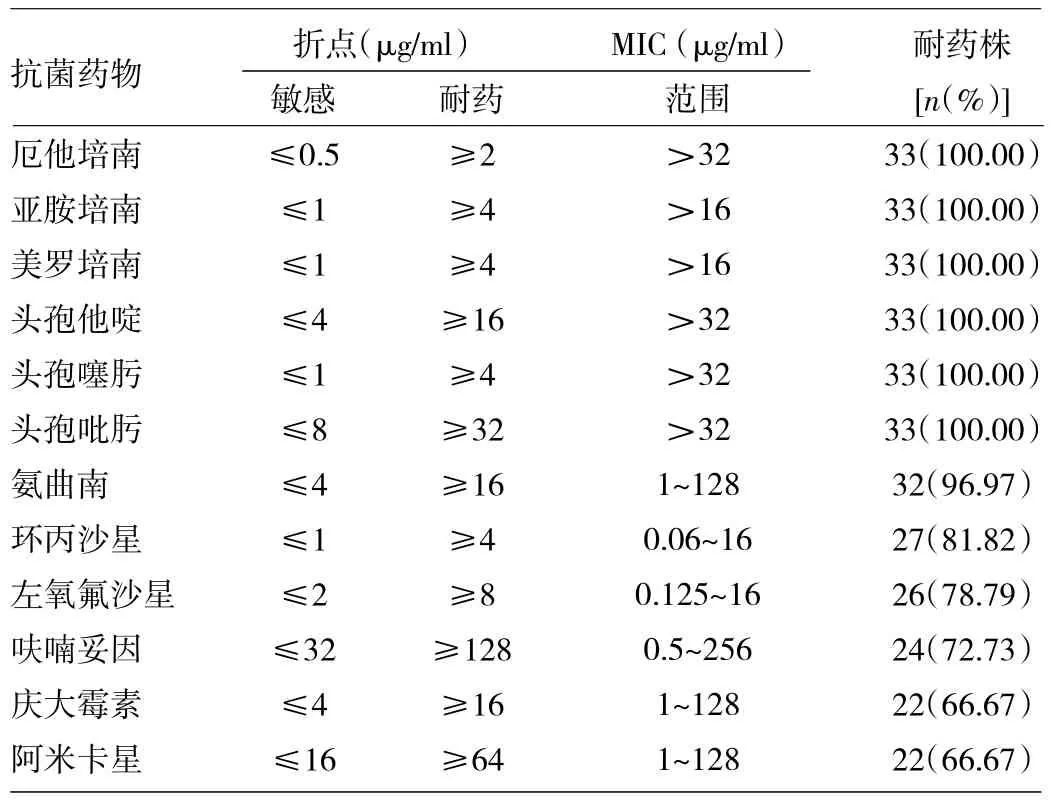
表2 临床分离CRKP对抗菌药物的敏感性
由图2可见,33株CRKP基于碳青霉烯酶编码基因的亲缘关系主要分为两大类。由MLST分型得出,有27株(81.82%)为 ST11型,其余 6株(18.18%)为 ST15,且24株携带blaKPC的CRKP均为ST11型。
2.3 CRKP蛋白图谱 见图3。
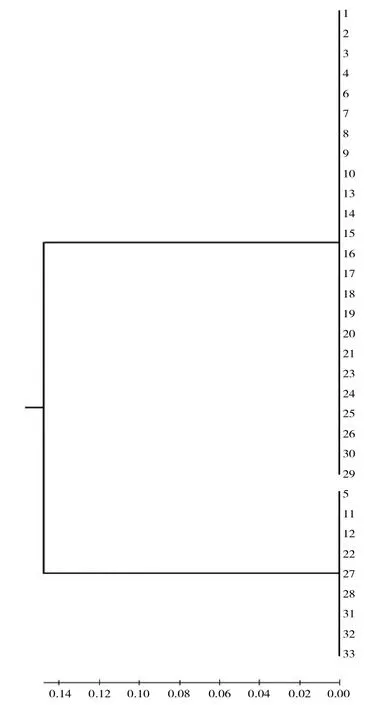
图2 耐碳青霉烯肺炎克雷伯细菌(CRKP)基于碳青霉烯耐药基因的亲缘关系分析
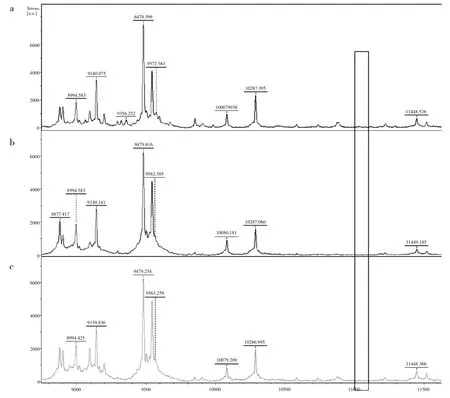
图3 耐碳青霉烯肺炎克雷伯细菌(CRKP)蛋白图谱
如图3所示,其中a为产KPC的CRKP,b为不产KPC的CRKP,c为质控菌株。三者蛋白图谱总体一致,且在11109-Da处均无特征峰。
3 讨论
碳青霉烯酶是肺炎克雷伯菌乃至肠杆菌科细菌对碳青霉烯抗生素产生耐药的主要机制,碳青霉烯酶主要分为以下3类,A类:丝氨酸碳青霉烯酶(KPC,GES);B类:金属-茁-内酰胺酶(MBL)(IMP,VIM,NDM)和 D 类:OXA 酶和类 OXA 酶(OXA-23,OXA-48)[5]。目前,检测碳青霉烯酶的方法主要包括表型测定法和分子检测法,前者主要包括改良的Hodge试验,Carba NP试验和碳青霉烯酶灭活法;而后者主要包括多重聚合酶链反应,微阵列和全基因组测序[6]。如今,越来越多的实验室引入了MALDI-TOF MS技术用于检测耐碳青霉烯的革兰阴性杆菌,尤其是CRKP。
本研究通过VITEK-2 Compact以及亚胺培南纸片共筛选出33株CRKP,大部分分离自痰液和尿液,且多数来源于内科。所有菌株对碳青霉烯类以及头孢菌素类产生耐药,只有对氨基糖苷类抗生素耐药率稍低,通过微量肉汤稀释法检测出20株CRKP(60.61%,20/33)为多重耐药菌株,此比例与长江流域其他地区一致,但高于东北地区[7-8]。33株CRKP中仅检测出blaKPC(72.73%,24/33),说明产碳青霉烯酶并非为本研究中CRKP耐碳青霉烯类抗生素的唯一耐药机制,剩余的9株CRKP可能为外膜孔蛋白减少或缺失伴高水平茁-内酰胺酶的持续产生,亦或是主动外排系统亢进,但仍需进一步进行检测。从国外的研究分析中得出,产KPC肺炎克雷伯菌在11109-Da处有特异峰[9-10],因此笔者将CRKP分为产KPC和不产KPC两组,均用MALDI-TOF MS进行蛋白图谱分析,但并未发现两组CRKP的蛋白图谱有较大区别,且产KPC组在11109-Da处并未出现特殊峰,这与之前的报道并不一致。从菌株的MLST分型结果得出本地区CRKP主要表现出ST11和ST15两种型别,这与其他报道称国内CRKP流行株主要为ST11型相符合[11],而国外报道中则表明国外CRKP流行株主要为ST258型[12],这可能是没有在11109-Da处发现特殊峰的主要原因。当然本研究可能受到菌株数的影响,就碳青霉烯耐药基因而言,菌株亲缘关系较近,同时并未检测到其他碳青霉烯耐药基因以及其他型别,因此,本结论只适用于本院的ST11和ST15型CRKP。
综上所述,本院CRKP对抗菌药物具有较高的耐药率,对碳青霉烯的耐药机制以产KPC酶为主。就本院而言,MALDI-TOF MS无法区分ST11型产KPC和非产KPC的CRKP,也无法区分CRKP的ST11和ST15型,至于能否利用MALDI-TOF MS区分鉴别携带其他碳青霉烯耐药基因的CRKP和其他型别的CRKP尚无明确定论,但以此为基础,可以从绍兴地区其他医院扩大样本量进行更深入的研究,为挖掘出MALDI-TOF MS技术在本地区更多的研究价值提供依据。
