把握守恒规律,比较平衡相对强弱
2020-09-10周纪贤
周纪贤


摘 要:浙江省近五次学选考中第23题均考查溶液中的离子浓度关系,该题能够很好的考查高中化学学科五大素养[1]之一“变化观念与平衡思想”:题目涉及离子反应,离子浓度、百分含量、溶液pH均会发生变化,题型和设问方式也在变化;题目涉及电离平衡、水解平衡等动态平衡。该题知识点较综合,难度较大,如何快速突破溶液中离子浓度大小关系是我们复习时急需解决的问题。
关键词:变化观念;平衡思想;守恒关系;离子浓度;大小比较
一、现状分析:
电离平衡、水解平衡属于重要的化学平衡,溶液中的电荷、物料、质子三大守恒,更是理解上的难点,要解决溶液中的微粒浓度大小需要对上述知识能够融会贯通,难度可想而知,该题得分率偏低。如何让基础好的同学能快速得分;让基础一般的同学尽量得分,是我们每一个高三化学老师要思考的问题,本人在复习这类题时做了一些尝试,结合教学实际和学生的反馈情况与大家共同探讨。
二、实施措施
(1)、研究考题、明确复习方向
高三化学复习时间紧、任务重,不能脚踏西瓜皮,滑到哪里算哪里,要目标明确,提高复习的针对性、有效性。考纲和考试说明圈定了考试的范围和难度,比较抽象,真题是对考纲、考试说明的最好诠释,所以我们必须研究考纲、考试说明和真题。我们通常都是自己分析试题并归纳后把结论告诉学生,这样学生印象不会深刻,我把五次考试试题列出来,让学生自己分析、归纳总结,尝试得出解题策略,这样可以加深印象。
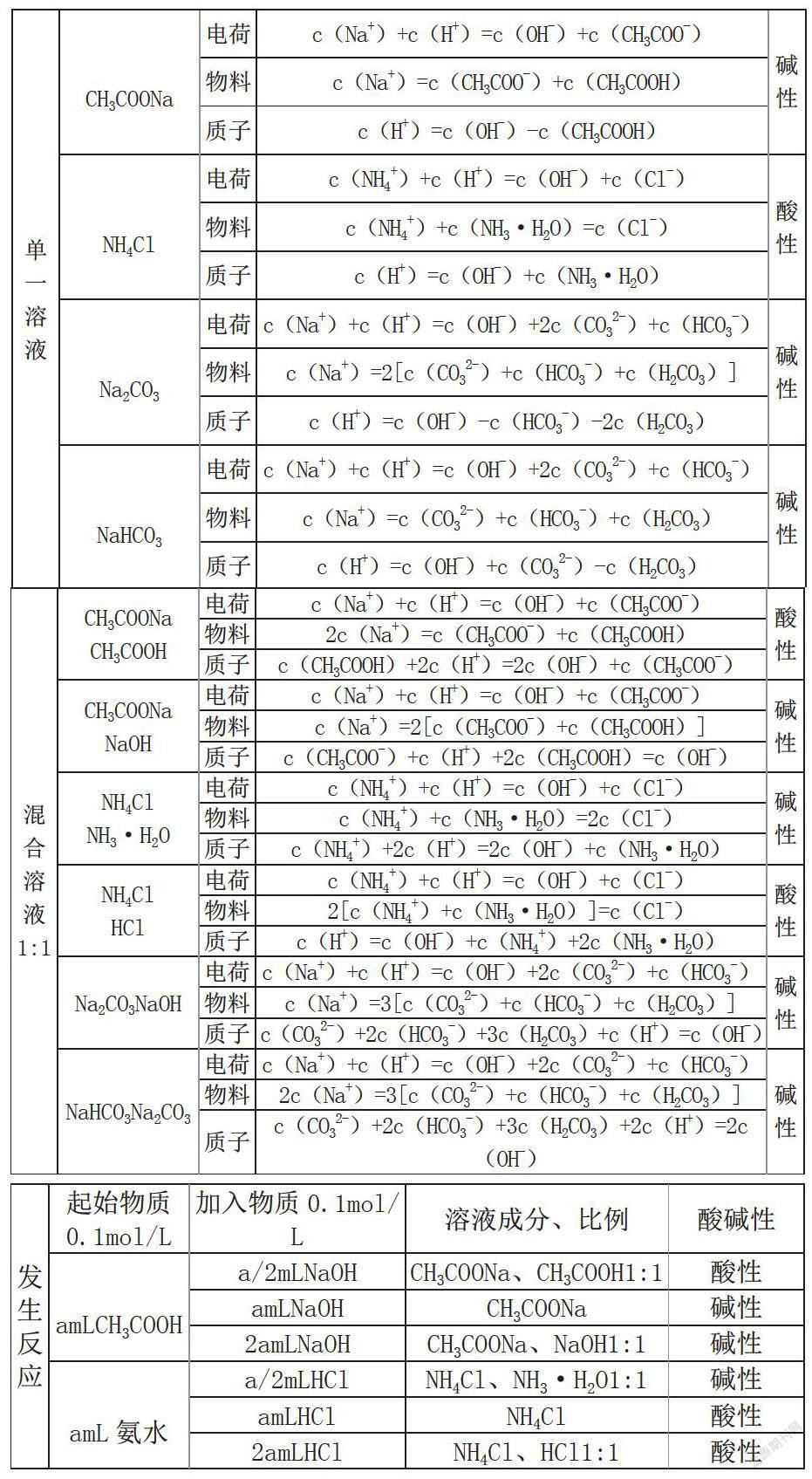
(2)把握规律、夯实基础
分析5次考试真题,我们不难发现题目在变,其落脚点都是溶液中的微粒浓度大小关系,浓度关系常见的就两种:等式关系和不等式关系。变化的是形式,不变的是规律,我們只有掌握了规律之后才能以不变应万变,所以我们要夯实基础,熟悉常见溶液中的守恒关系:
(3)熟悉题型、讲究策略
由于考试时间比较紧张,考生容易紧张,导致思路打不开,只有我们熟悉了常考的题型,对考试考什么?怎么考?了如指掌后,才会胸有成竹,才有可能超常发挥。
题型Ⅰ:溶液pH与加入酸(或碱)溶液体积的关系图像:如2016年4月、2016年10月、2018年4月的第23题。
1、试题分析:此题可以考酸中加碱、碱中加酸、酸和盐的混合溶液中加碱、碱和盐的混合溶液中加酸;酸和碱数量上可以由一种变为两种或三种;从性质上讲可以是强酸(碱)也可以是弱酸(碱)。
2、解题策略:
①结合起点的pH,快速判断酸(碱)的强弱。弱电解质起点要考虑电离平衡、滴定终点要考虑盐的水解、中间过程既有剩余的酸(碱)又有生成的盐,所以既要考虑电离又要考虑水解。如2016年10月,由0.1000mol/L的HX和HY的pH分别为3和1可知HX为弱酸、HY为强酸。
②关注特殊点、定点定物质。考试时为了控制难度,往往会选择一些特殊点来让我们进行比较。溶液的总体积会随着加入酸(碱)的体积变化而变化,但所有的微粒所处的溶液体积相同,所以我们无需计算出某种微粒的物质的量或物质的量浓度,只要确定某个特殊点的物质种类和比例就可以了。以2016年10月23题为例特殊点往往包括:
ⅰ、起点:V(NaOH)=0mL,只有酸,只考虑电离,前面我们已经判定HX为弱酸、HY为强酸,我们知道酸性越弱电离程度越小,所以c(X-) ⅱ、半中和点:V(NaOH)=10mL即一半酸被中和,相当于HX和NaX1:1混合,溶液中的守恒关系参照CH3COONa、CH3COOH1:1混合溶液。此处既要考虑HXH++X-,又要考虑X-+H2OHX+OH-,此时pH=4,说明溶液呈酸性,HX的电离大于X-的水解,即HX转化为X-比X-转化为HX要多,所以c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)。 ⅲ、中和点:V(NaOH)=20mL即酸恰好完全中和生成NaX,此时需要考虑X-的水解,另外OH-主要靠X-水解产生,所以c(Na+)>c(X-)>c(OH-)>c(H+)。 ⅳ、恰好中性点。强酸强碱反应时,恰好中和就是中性溶液,强酸(碱)去中和弱碱(酸),中性点往往出现在中和点的前面;弱酸(碱)去中和强碱(酸),中性点往往出现在中和点之后,HY中和点和中性点重合,即V(NaOH)=20mL,HX的中性点出现在中和点前,即V(NaOH)<20mL,所以两个溶液中c(Na+)不同。 ③变换角度、改变呈现方式。考试一般不会直接考三大守恒,通常会变换形式来考:如2016年4月C选项,c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1000mol/L,实际是把电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-)变换成c(Na+)+c(H+)-c(OH-)=c(CH3COO-)代入物料守恒,再考虑溶液体积增大,所以c(Na+)+c(H+)-c(OH-)+c(CH3COOH)<0.1000mol/L。我们平时要加强变式训练,如把NH4Cl、NH3·H2O1:1混合溶液的质子守恒改为:c(NH4+)-c(NH3·H2O)=2c(OH-)-2c(H+),或者改为已知pH进行定量计算,让学生熟悉常见的变换关系。 题型Ⅱ、溶液中的微粒百分含量(物质的量浓度)和pH变化的关系图像。如:2017年4月、2017年10月第23题。 1、试题分析:pH从左往右是增大的,所以起始的物质往往是一元或二元弱酸,调节pH的方式有加水或加碱(溶液或固体),加水没有引入新的离子,只考虑电离平衡,pH也只能发生量变,即酸性减弱最终接近中性,不可能变成碱性;加碱要考虑与酸的反应,引入阳离子,可以使溶液发生质变,即可能变为碱性,无论是加水还是加碱溶液都会导致溶液总体积增大,所以纵坐标一般采用微粒的百分含量;若纵坐标是微粒浓度的话,只能是加碱固体。 2、解题策略: ①浏览图像,快速确定各曲线代表的微粒种类。如2017年4月23题,CH3COOHH++CH3COO-,逐渐减小的是CH3COOH,逐渐增大的是CH3COO-,若是二元酸H2X,直接减小的代表H2X分子,先增大后减小的代表HX-离子,逐渐增大的代表X2-离子。 ②观察选项,排除简单的选项。如2017年4月的B选项,根据平衡思想a(CH3COOH)不可能等于0,A选项在pH=4.76前作一条辅助线也很容易得出结论;再如2017年11月的A选项,根据图像可知HA-先增大后减小,与题目说的一定增大矛盾。我们排除掉一两个选项后,正确率就高多了。 ③以特殊点的pH推出电离和水解的相对强弱。如2017年11月23题中HA-离子浓度最大时的pH为3左右,可以推出HA-的电离大于水解;根据HA-和A2-两曲线的交点的pH为4.3左右,推出HA-的电离大于A2-水解,即相同浓度时HA-转化为A2-比A2-转化为HA-多,所以B选项中等物质的量的NaHA和Na2A混合物溶于水,所得溶液中a(HA-) ④以电荷守恒为基础,讨论剩余选项的浓度大小关系。调节pH时可以加水也可以加碱,书写电荷守恒时两者有区别:2017年4月23题用水调节:c(H+)=c(OH-)+c(CH3COO-);若用碱调节:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)所以c(OH-)+c(CH3COO-)可能大于c(H+)。2017年11月23题若用水调节:c(H+)=c(OH-)+c(HA-)+2c(A2-),若c(H2A)+2c(A2-)+c(OH-)=c(H+)说明c(H2A)=c(HA-),若用碱调节:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),若c(H2A)+2c(A2-)+c(OH-)=c(H+)则推不出c(H2A)=c(HA-)。 三、备考建议 传统的高三复习方式是老师备课:备三维目标、核心素养,制定计划、设计方案,老师出题-学生做题-老师讲评,老师占据课堂的主导地位。近年来我越来越深刻的体会到“照卷讲题”、“一讲到底”的教学模式的不足,需要积极探索引导学生主动参与的复习课堂。我尝试了: (1)一题两讲。我把试卷中比较典型的错误找出,把任务分到各学习小组,让他们通过独立思考、交流讨论,在第二天的课堂上把审题过程、解题思路、注意点等讲出来,同时回答其他同学的质疑,同组成员进行补充,我做一些必要的点拨、总结。一题两讲可以很好的促进思维能力的发展,学生解题时思路可以是片段的、不连续的,而讲题时思路必须非常清晰、连贯,从能够讲出来到能够写下来思维能力又提高了一个档次,对解主观题帮助也很大。 (2)让学生改题编题。从做题者变成出题者,相当于由猎物变成了猎人,出题者必须非常清楚出题的目的、考查了哪些知识点、设置了哪些陷阱,自己都能设置陷阱了,那要发现其他人设置的陷阱肯定要容易多了。让学生从局部改题开始,逐步过渡到能自己编题,不断相互切磋、实现共同进步。 追求教学有效性任重而道遠,只有在不断摸索中前进,在反思中成长。 参考文献 [1]普通高中化学课程标准[M]2017版北京:人民教育出版社,2017:3-4.
