大豆分离蛋白提取及其植酸脱除的研究
2020-09-10鲁洋史文静王文婷
鲁洋 史文静 王文婷







摘要:大豆分离蛋白(SPI)营养价值较高,但其含有的植酸可与矿物质离子结合并减少蛋白质可利用性,为获得SPI最佳提取工艺并降低其植酸含量,通过碱溶酸沉法从低温脱脂豆粕中提取SPI,利用离子交换法脱除其中的植酸,筛选出最佳树脂,在此基础上,对比分析了脱除植酸前后SPI的理化性质。结果表明,SPI最佳提取工艺为浸提液料液比1∶10,温度50 ℃,pH值9.0,提取率达79.01%。相比于D001,D301和D152型树脂,D201型强碱阴离子树脂对植酸脱除效果最佳。脱除植酸后的SPI与脱除前相比,溶解性有所下降,分散速度略有提高,起泡能力提高而泡沫稳定性降低。
关键词:大豆分离蛋白;提取;植酸;脱除;离子交换法
中图分类号:TS214.9 文献标志码:A doi:10.16693/j.cnki.1671-9646(X).2020.01.044
Abstract:SPI has high nutritional value,but it contains phytic acid that binds to mineral ions and reduces protein availability. In order to obtain optimal extraction process of SPI and reduce phytic acid content,the SPI was extracted from low-temperature defatted soybean meal through the method of alkali-solution and acid-isolation. The phytic acid was removed by ion exchange and the best resin was selected. On the basis,the physicochemical properties of the SPI before and after removal of phytic acid were compared and analyzed. The results showed that the optimal extraction process of the SPI were solid liquid ratio 1∶10,temperature 50 ℃,pH 9.0,and the extraction rate was 79.01%. Compared with D001,D301 and D152 resins,D201 strong base anion resins had the best removal effect on phytic acid. After removal of phytic acid,the SPI had lower solubility,higher dispersion rate,higher foaming ability and lower foam stability.
Key words:soybean protein isolate;extraction;phytic acid;removal;ion exchange method
大豆分离蛋白(SPI)属于全价蛋白,其资源极其丰富,营养较为全面,而且具有溶解性、分散性、起泡性等特殊性能[1]。SPI中普遍含有一种抗营养因子——植酸,植酸会和SPI包括一些酶结合形成植酸蛋白质复合物,从而影响蛋白质的生理功能[2]。当4.5<pH值<9.0时,带负电荷的蛋白质、金属阳离子与带负电荷的植酸形成难溶的复合物[3],影响人体对蛋白质与矿物质的吸收,并且植酸的存在对SPI的溶解性、分散性、起泡性也有一定影响[4]。所以,在SPI的生产中一般都会设法除去植酸。使植酸含量减少的方法主要有溶剂萃取法、膜分离法和离子交换法。其中,溶剂萃取法作为传统工艺,虽操作简单,却有经济效益差、得到的产品杂质较多等不足之 处[5]。膜分离法是采用有选择性的高分子生物膜,通过膜两端的一定浓度和压力差来选择性提取原料组分,但膜分离法中交换液的大分子物质容易堵塞超滤膜,清理较为麻烦[6]。离子交换法则是通过离子交换树脂对植酸的吸附作用来得到低植酸含量的产品,该方法较适合食品工业生产[7]。
在单因素试验的基础上,通过正交试验优化,探究通过碱溶酸沉法从低温脱脂豆粕中提取SPI的最佳工艺,然后利用离子交换法研究D001,D201,D301和D152等4种类型树脂对SPI中植酸脱除的效果,筛选出最佳树脂,在此基础上,对比分析脱除植酸前后SPI的理化性质。以上研究能够为低植酸含量的SPI提取及生产提供一定的理论参考。
1 材料与方法
1.1 主要原料与试剂
1.1.1 主要原料
低温脱脂豆粕,山东万德福实业集团提供。
1.1.2 主要试剂
氢氧化钠、盐酸、浓硫酸、丙酮,国药集团化学试剂有限公司提供;无水乙醇,安徽安特食品股份有限公司提供;植酸钠,Sigma;D001、D201、D301、D152型树脂,安徽三星树脂厂提供。
1.2 主要仪器
HH-S型恒温水浴锅,江苏国盛实验仪器厂产品;SHZ-D(Ⅲ)型循环水式真空泵,巩义市予华仪器有限公司产品;T系列电子天平,上海越平科学仪器有限公司产品;UV-5100H型紫外可见分光光度计,上海元析仪器有限公司产品;20 mm×200 mm离子交换柱,安徽千玻教学仪器有限公司产品;HL-2型恒流泵、BSZ-160型自动部分收集器,上海滬西分析仪器厂产品;pHS-3C型pH计,上海仪电科学仪器股份有限公司产品。
1.3 大豆分离蛋白的提取试验
1.3.1 工艺流程
低温脱脂豆粕→碱溶→离心→酸沉→离心→洗涤、过滤沉淀→烘干得SPI。
1.3.2 操作要点
(1)原料。将豆粕稍加烘干,除去结块后备用。
(2)碱溶。向豆粕中加入适量水,调pH值至碱性条件,在一定温度下搅拌50 min,溶解其中蛋白质。
(3)离心。在4 ℃条件下以转速4 000 r/min离心15 min,弃去沉淀。
(4)酸沉。将上清液pH值调至酸性条件,摇匀,室温下静置30 min。
(5)离心。在4 ℃条件下以转速4 000 r/min离心15 min,去除上清液。
(6)洗涤、过滤沉淀。用蒸馏水洗涤沉淀并抽滤,直至滤液pH值为中性。
(7)烘干。将得到的SPI凝乳放入烘箱中烘干,粉碎,粉状物即为SPI[8]。
1.3.3 蛋白质含量的测定
参照GB 5009.5—2016(第一法),凯氏定氮法。
1.3.4 SPI提取率的计算
SPI提取率=■×100%.
1.3.5 SPI提取单因素试验
(1)浸提液料液比对SPI提取率的影响。按料液比1∶6,1∶8,1∶10,1∶12,1∶14配制浸提液,并将pH值调至10.0,在45 ℃水浴中浸取50 min,调pH值为4.5,以沉淀提取SPI[9]。
(2)pH值对SPI提取率的影响。料液比为1∶ 10时,调浸取液的pH值分别为8,9,10,11,12,在45 ℃水浴中浸提50 min,调pH值为4.5,以沉淀提取SPI[9]。
(3)温度对SPI提取率的影響。浸提液料液比为1∶10,pH值为10的条件下,分别在35,40,45,50,55 ℃水浴中浸提50 min,调pH值为4.5,以沉淀提取SPI[10-11]。
1.3.6 SPI提取正交试验
按照以上3个单因素试验结果进行正交试验。
SPI提取正交试验因素与水平设计见表1。
1.4 脱除植酸最佳树脂的选择
1.4.1 树脂预处理
试验选择4种常见的离子交换树脂,分别为D001大孔强酸性阳离子交换树脂、D201大孔强碱性阴离子交换树脂、D301大孔弱碱性阴离子交换树脂和D152大孔弱酸性阳离子交换树脂。预处理方法参照GB/T 5476—2013。
1.4.2 树脂吸附能力的测定
分别称量3.0 g(湿质量)4种不同型号的树脂于500 mL烧杯中,再各加入5%的SPI溶液400 mL,调溶液pH值至8.0,于室温下静置12 h后测树脂对植酸的吸附能力[12]。
树脂对植酸的吸附能力=
式中:C1——SPI溶液中植酸的含量,mg/mL;
C2——离子交换后SPI溶液中植酸的含量,
mg/mL;
V1——离子交换后SPI溶液的体积,mL;
G——树脂的湿质量,g
1.4.3 SPI中植酸脱除工艺流程
SPI→溶解→进入离子交换柱→流出液调pH值至7.0→干燥[13-14]。
1.4.4 SPI中植酸含量测定
参照GB 5009.153—2016测定SPI中植酸含量。
1.5 大豆分离蛋白的理化性质
1.5.1 溶解性
将最佳工艺条件下提取的SPI进行植酸脱除后干燥,收集备用。溶解度的测定方法参照GB 5413.29—2010,测量每100 g SPI样品在规定条件下溶解后全部溶解的质量。
1.5.2 分散速度
室温下向50 mL烧杯中加入20 mL纯水,再加入0.2 g SPI,搅拌30 s,过60目滤网,量取其中5 mL滤液,于105 ℃下烘干,然后称质量[15]。
式中:G——5 mL滤液固形物质量,g。
1.5.3 起泡性和泡沫稳定性
(1)起泡性的测定方法。向250 mL烧杯中加入200 mL纯水,取5 g SPI溶于水,以转速10 000 r/min离心2 min,记录刚离心后的泡沫体积[15]。
式中:V1——泡沫体积,mL;
200——纯水体积,mL。
(2)泡沫稳定性的测定方法
泡沫稳定性=■.
式中:V1——上述刚离心后的泡沫体积,mL;
V2——静置30 min后的泡沫体积,mL。
2 结果与分析
2.1 大豆分离蛋白提取单因素试验结果与分析
2.1.1 碱溶浸取液料液比对SPI提取率的影响
浸提液料液比对SPI提取率的影响见图1。
从图1可以看出,在料液比为1∶6~1∶10时,SPI提取率逐渐上升,在1∶10之后逐渐下降。料液比升高时,酸沉提取过程使蛋白乳清中溶解的球蛋白变多,随之丢失的蛋白也变多,SPI的提取率就会降低。故选择碱溶最佳料液比为1∶10。
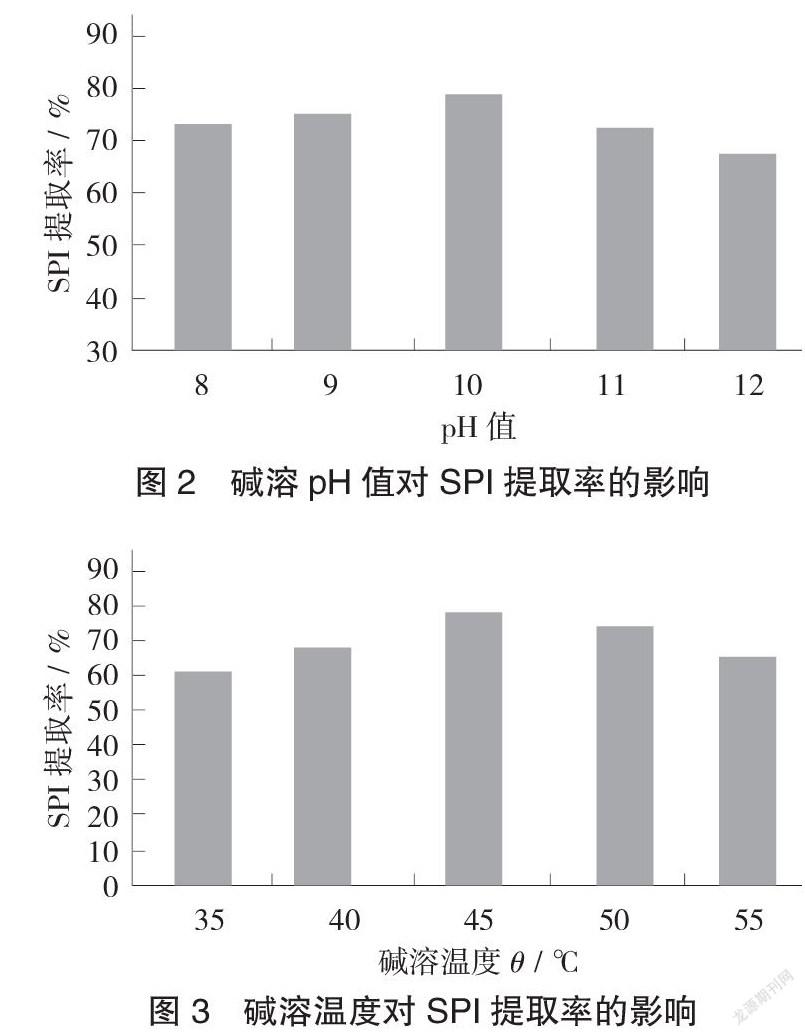
2.1.2 碱溶pH值对SPI提取率的影响
碱溶pH值对SPI提取率的影响见图2。
从图2可以看出,pH值为8~10时SPI的提取率越来越高,pH值为10~12时逐渐减小。这可能是因为当pH值变大时蛋白分子的表面电荷变多,溶解的蛋白质增加,提取的SPI也随之增多,然而pH值过高会使蛋白质变性,降低了SPI提取率。因此,选择最佳pH值为10。
2.1.3 碱溶温度对SPI提取率的影响
碱溶温度对SPI提取率的影响见图3。
从图3可以看出,SPI提取率在35~45 ℃时逐渐升高,超过45 ℃逐渐降低。温度升高使SPI溶解度变大,温度降低溶解度变小,但温度过高会使SPI变性,溶液黏度增加,其溶解度随之降低,从而减小了SPI的提取率。故可得出最佳碱溶温度为45 ℃。
2.2 大豆分离蛋白提取正交试验结果与分析
SPI提取正交试验结果见表2。
从表2可以看出,3个因素对SPI提取率的影响程度为A>B>C,即料液比对SPI提取率的影响最大,温度最小。最佳工艺条件为A2B2C3,即料液比1∶10,碱溶pH值9,温度50 ℃。在最佳工艺下进行验证试验,得到SPI提取率为79.01%。
2.3 最佳脱除植酸树脂选择的结果与分析
不同树脂对植酸的吸附能力见图4。
不同类型离子交换树脂对植酸的脱除能力不同,从图4可以看出,阴离子交换树脂D201脱除植酸能力比D001,D301,D152型树脂要强。这可能是由于SPI溶液中植酸易解离出质子,其本身带有较多的负电荷,与D201强碱性阴离子交换树脂中的负离子进行交换吸附,使植酸能够被大量脱除。故选择D201型树脂作为最佳树脂用于SPI中植酸的脱除。
2.4 脱除植酸前后SPI理化性质分析
2.4.1 SPI溶解度
脱除植酸前后SPI在不同温度下的溶解度见图5。
从图5可以看出,在20~50 ℃时,经植酸脱除的SPI溶解度逐渐增大,超过50 ℃时溶解度变化不明显,该变化趋势与未经过植酸脱除的SPI基本一致,但脱除植酸后的SPI溶解度有所降低,溶解度下降的原因可能是SPI在离子交换过程中与树脂发生了交换反应造成。在食品加工生产中SPI的溶解性十分重要,其与SPI其他功能特性,如分散速度、起泡性等均有关,因此研究SPI在不同温度下的溶解性有一定实际意义。
2.4.2 SPI分散性
脱除植酸前后SPI的分散性见图6。
从图6可以看到,经脱除植酸处理的SPI分散性为65.9%,稍高于未经植酸脱除的SPI分散性,这可能是因为不溶性植酸-蛋白质复合物的解离所引起的,经植酸脱除后的SPI能更好、更快地分散于水中。
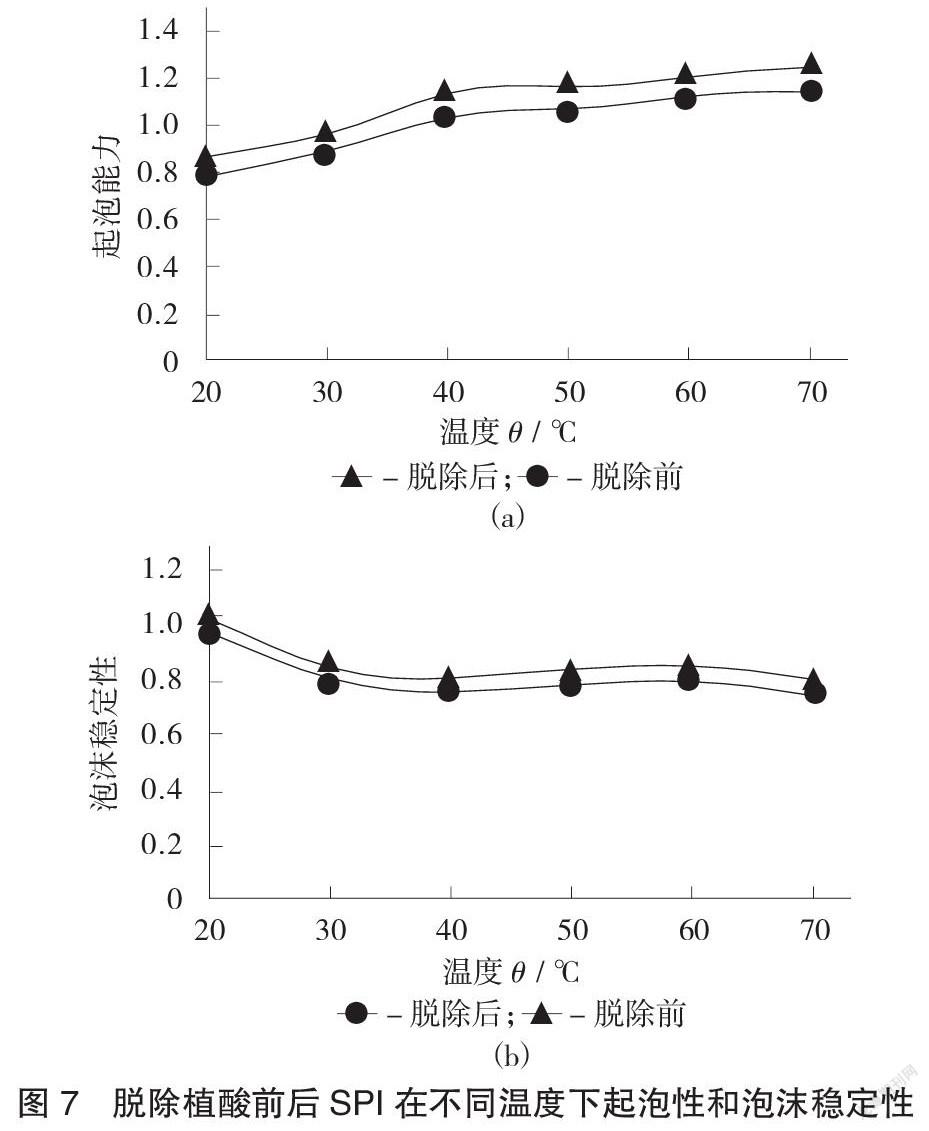
2.4.3 SPI起泡性和泡沫稳定性
脱除植酸前后SPI在不同温度下起泡性和泡沫稳定性见图7。
由图7(a)可以看出,脱除植酸后SPI的起泡能力随温度升高而变大,在20~50 ℃变化较明显,这一趋势与未经植酸脱除的SPI一致,且经过植酸脱除后起泡能力有所增加。由图7(b)可以看出,随着温度升高,泡沫稳定性逐渐下降,且经植酸脱除的SPI泡沫稳定性与未经脱除的相比有所降低,可能是由于分子构象发生变化引起。温度的升高使SPI溶解性变大,从而改变了SPI的起泡性和泡沫稳定性。
3 結论
在单因素试验基础上,利用正交试验优化得出大豆分离蛋白的最佳提取工艺为碱溶浸提液料液比1∶10,碱溶pH值9,碱溶温度50 ℃,此时SPI提取率达79.01%。D201,D001,D301和D152这4种树脂对植酸的脱除效果不同,结果表明D201型树脂对植酸的脱除效果最好。脱除植酸后,SPI的溶解度、分散性、起泡能力和泡沫稳定性都有变化,其中,溶解度降低,分散性稍有增加,起泡能力提高而泡沫稳定性有所下降。研究得出了一些对提取低植酸含量的SPI有参考和借鉴价值的参数和结论,总体上提高了SPI的营养价值。
参考文献:
吴谋成. 功能性食品研究与应用[M]. 北京:化工工业出版社,2004:214-220.
吴道银. 大豆中抗营养因子简介[J]. 四川粮油科技,2003(1):51-52.
OKubo K,Waldorp A,Iacobucci G,et al. Preparation of low-phytate soybean protein isolate and concentrate by ultra-filtration[J]. Cereal Chemistry,1975,52(2):263-271.
Gosal W S,Ross-Murphy S B. Globular protein gelation[J]. Current Opinion in Colloid and Interface Science,2000(3):188-194.
袁建,王艳,范哲,等. 响应面法优化小麦麸皮中植酸的提取工艺[J]. 粮食与饲料工业,2013(12):13-17.
史冰清. 植酸的测定及其提取工艺[J]. 现代食品,2017(15):78-80.
钱庭宝,朱常英. 离子交换树脂在食品工业中的应用[J]. 现代化工,1987(4):57-58,46.
李大鹏,赵睿. 低温脱脂豆粕中大豆分离蛋白提取工艺的研究[J]. 农产品加工,2014(12):22-24.
石彦国,任莉. 大豆制品工艺学[M]. 北京:中国轻工业出版社,1998:154-170.
陈姿含,管骁,李景军. 响应面法优化低温豆粕大豆分离蛋白提取工艺[J]. 生物加工过程,2012,10(3):39-44.
尹秀莲,赵瑜辉,管明,等. 大豆分离蛋白提取及其凝胶制备影响因素研究[J]. 食品与发酵科技,2017,53(6):62-66.
王琳,罗建平,查学强,等. 阴离子交换树脂对米糠植酸的吸附解析性能[J]. 农业机械学报,2011,42(5):160-165.
陶然,范玲慧,李雯,等. 离子交换法制备低植酸含量大豆蛋白的研究[J]. 大豆科学,2015,34(2):293-297.
李健秀,王建刚. 植酸的制备及应用发展[J]. 化工进展,2006,25(6):629-633.
王一熹. 半干法改性对大豆分离蛋白特性的影响[D]. 泰安:山东农业大学,2016. ◇
