持续光照法与海马Aβ注射构建AD样大鼠模型实验比较*
2020-09-10李宜培彭蕤蕤
李宜培,彭蕤蕤,任 力,王 黎△
( 1.河南医学高等专科学校病理生理学教研室;2.河南省脑退行性疾病医学重点实验室,郑州 451191)
阿尔茨海默病(Alzheimer’s disease,AD)是一种严重危害老年人身体健康的神经系统退行性疾病,临床主要表现为进行性记忆能力下降、认知障碍和痴呆,其发病率不断增加[1]。AD自1906年发现并命名以来,发病机制尚未完全阐明,主要原因之一是与人类AD患者相似的动物模型并未真正复制。目前,被公认的建立AD动物模型的方法主要有转基因小鼠模型、胆碱能神经损毁模型、D-半乳糖注射模型、β-淀粉样蛋白(β-Amyloid peptide,Aβ)注射模型等[2]。但这些动物模型只能模拟AD诸多病理变化中的某一个方面,且多为创伤性,与AD多因素病因和隐匿的发病过程不完全相符。因此,建立一种可以在行为学、病理改变、超微结构等方面较好模拟AD自然发病过程的动物模型是目前研究的重点。研究[3-4]表明,AD的发生与患者睡眠节律紊乱有关,约50%的AD患者在发病早期就出现睡眠功能障碍。光线的明暗变化节律和人、动物的生物节律密切相关,明暗周期的改变会严重影响生物的生理节律,尤其是睡眠节律。因此,本研究采用持续光照方法改变大鼠的明暗周期,致使动物睡眠节律紊乱,探讨此方法复制AD 动物模型的可能性;并与公认的Aβ海马注射造模方法做比较,探讨2种方法的可行性和优劣性。
1 材料与方法
1.1 动物与分组 清洁级雄性wistar大鼠36只,7~8周龄,体质量200~250 g,大鼠购自河南省实验动物中心[SCXK(豫)2017-0001]。经Morris水迷宫筛选后的大鼠按随机数字表法分为正常对照组、光照组和Aβ注射组,每组12只。按照清洁级动物饲养标准,环境温度20 ~25 ℃,相对湿度30%~60%,自由饮水和摄食。所有动物实验符合河南医学高等专科学校实验动物伦理委员会要求。
1.2 方法
1.2.1 试剂与仪器 Aβ1-40(美国Sigma公司),多克隆抗体R134d、单克隆抗体PHF-1(识别tau蛋白磷酸化Ser396/404位点)、单克隆抗体tau-1(识别tau蛋白磷酸化Ser199/202位点)、辣根过氧化物酶标记的二抗、碱性磷酸酶标记的二抗(美国Santa Cruz公司),多聚甲醛(美国BBI试剂公司),Morris水迷宫视频跟踪分析系统(成都泰盟软件有限公司,WMT-100S),脑立体定位仪(成都泰盟软件有限公司,DW-2000/DW-2000D),振荡切片机(德国TPI,LEICA,S100型),FEI TecnaiG2透射电子显微镜(荷兰)。
1.2.2 Aβ1-40孵育 将1 mg Aβ1-40溶于500 μL PBS,稀释为浓度2 g·L-1,37 ℃恒温箱中连续孵育12 d,4 ℃保存使用。
1.2.3 大鼠处理 正常对照组大鼠不做任何处理。光照组:用40 W白炽灯泡悬于鼠笼中央正上方,光照强度为800 lux。人工光照时间为7 pm至次日7 am,自然光照时间是7 am至7 pm[5]。Aβ注射组:大鼠腹腔注射质量分数6%水合氯醛溶液麻醉(300~360 mg·kg-1)后固定于脑立体定位仪上,参照《大鼠脑立体定位图谱》,海马定位[6]。注射组大鼠采用微量进样器于每侧海马注射2 g·L-1Aβ1-40 5 μL。
1.2.4 Morris水迷宫行为学测试 Morris水迷宫分为四个象限,大鼠每天在四个象限各学习1次,每次限时1 min。即1 min内未找到平台的大鼠,潜伏期记为60 s。测试者引导大鼠站立于平台上,持续学习30 s。取出大鼠放于鼠笼中,休息30 s后再进行下一次训练。以第一象限的潜伏期记录为实验成绩。连续7 d测试正常对照组、光照组(光照30 d)和Aβ注射组(术后10 d)大鼠,记录大鼠每天第一象限的潜伏期时间来反映其空间记忆能力。光照组和Aβ注射组中每只大鼠1~7 d潜伏期的平均值和正常对照组的平均值作统计学分析,P<0.05表明造模成功,计算大鼠复制成功率。
1.2.5 免疫组织化学法检测 Morris水迷宫测试结束后,随机选取光照组和Aβ注射组复制成功的大鼠4只,麻醉后质量分数4%多聚甲醛心脏插管灌注、固定,取大鼠脑组织于固定液中浸泡固定48 h,振荡切片。选择一抗孵育,4 ℃过夜,ABC法,DAB 显色。检测各组大鼠总tau 蛋白,PHF-1和tau-1的表达。每组随机选取5张切片,光学显微镜下,选择10×100倍视野下观察,每张切片在海马CA1区连续选取3个不同视野(共15个视野区),保存图像,应用图像分析软件Image-Pro Plus 6.0分析免疫组化染色结果。
1.2.6 海马电镜标本的制作及观察 Morris水迷宫测试结束后,随机选取光照组和Aβ注射组复制成功的4只大鼠用于透射电子显微镜取材。大鼠麻醉后质量分数4%多聚甲醛心脏插管灌注、固定,取大脑组织剥离海马,切数块海马组织块约1 mm3,经漂洗液充分洗涤后,梯度脱水。SPURR包埋剂包埋后,透射电子显微镜下观察并照相,应用图像分析软件Image-Pro Plus 6.0分析结果。
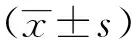
2 结果
2.1 Morris水迷宫行为学测试结果 各组大鼠随着学习次数的增加,寻找平台的潜伏期均缩短。从第5、6、7天的数据发现,与正常对照组比较,光照组和Aβ注射组潜伏期均延长,差异有统计学意义(P<0.05),而后2组间比较差异无统计学意义(P>0.05)。但光照组的成功率仅为58.33%(7/12),远远低于Aβ注射组的91.67%(11/12),差异有统计学意义(P<0.05)。从游泳轨迹来看,光照组和Aβ注射组大鼠呈曲线式搜索,正常对照组大鼠基本成直线式搜索。见表1,见图1。
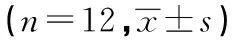
表1 各组大鼠Morris水迷宫测试结果
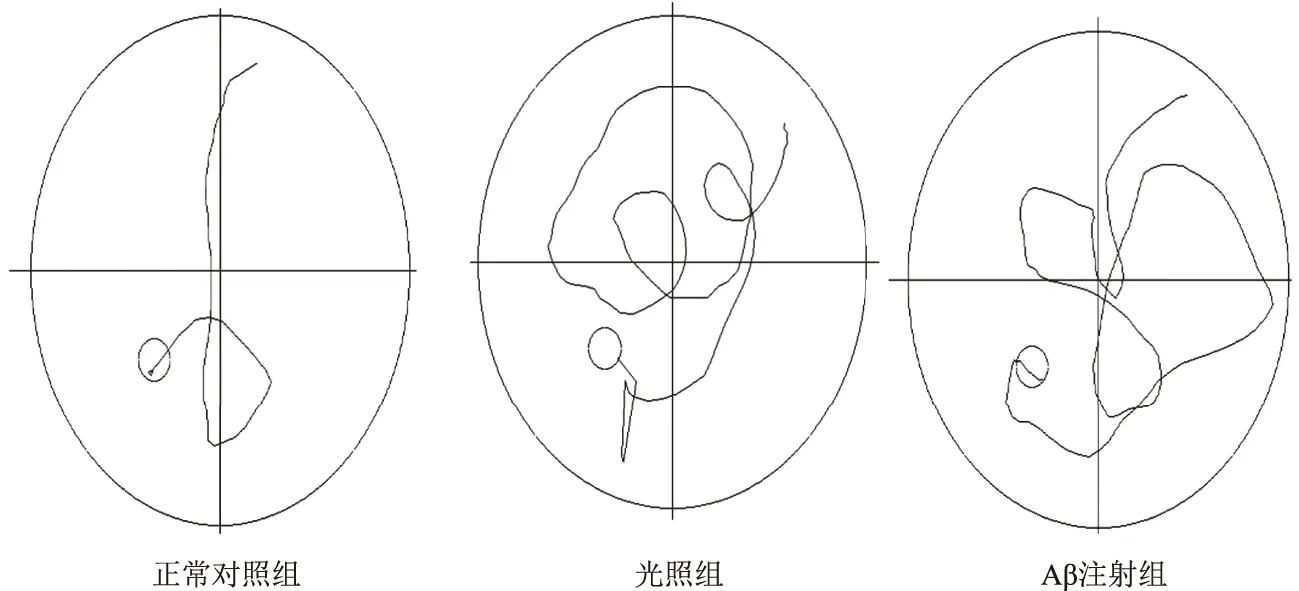
图1 各组大鼠寻台搜索轨迹比较
2.2 免疫组织化学法染色结果 R134d抗体染色结果显示,3组大鼠海马组织总tau蛋白表达阳性的细胞数比较无明显差异,见图2。与正常对照组比较,光照组和Aβ注射组PHF-1、tau-1表达阳性的细胞数在海马CA3区明显增多,见图3-4。
2.3 大鼠海马超微结构的改变 正常对照组大鼠电镜下海马组织线粒体呈椭圆形,双层膜结构完整;微管排列整齐,结构清晰;突触间隙清晰,前后膜均一,厚度适中,突触小泡多见,见图5A。光照组和Aβ注射组大鼠海马线粒体肿胀,脊模糊断裂,甚至出现空泡状改变;突触前、后膜结构模糊,突触小泡数量减少;微管排列紊乱扭曲,出现轴突水肿,微管崩解,胞浆内出现大量脂褐素颗粒。见图5B-C。
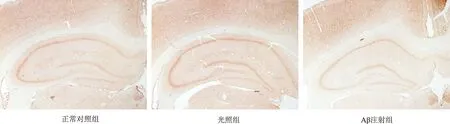
图2 各组大鼠海马组织R134d表达结果比较(免疫组织化学法,×100)

图3 各组大鼠海马组织PHF-1表达结果比较 (免疫组织化学法,×100)

图4 各组大鼠海马组织tau-1表达结果比较 (免疫组织化学法,×200)

图5 各组大鼠海马透射电子显微镜下超微结构(×2 000)
3 讨论
建立理想的动物模型是AD研究的基础,理想的AD动物模型应具备三个条件:神经细胞外Aβ沉积所形成的老年斑(senile plaque,SP)、神经细胞内异常磷酸化tau蛋白聚集构成的神经元纤维缠结(neurofibrillary tangles, NFTs),皮质、海马选择性的神经元变性,突触缺失[2]。Aβ的生成和蓄积是AD发病的中心环节[7-8],1991年,KOWALL提出将Aβ注射入大鼠的海马内,进而导致神经纤维缠结的形成、氧化和脂质过氧化、谷氨酸兴奋毒性反应、炎症、凋亡细胞死亡等级联反应,复制出AD样大鼠,该方法已得到研究学者的认可[9]。但临床AD患者发病往往漫长、无创、自然发病,这促使人们研究更加符合AD 发病过程、反映特征性三大病理改变的动物模型。研究[10-12]表明,约44%的AD患者有睡眠障碍,而且随着病情的进展和认知功能的损害而逐步加重,临床主要表现为失眠、夜间睡眠障碍或者白天嗜睡,这表明睡眠节律紊乱可能是AD的病因。本研究采用光照打乱大鼠睡眠节律,建立AD样大鼠模型。同时以经典的大鼠海马Aβ注射复制AD大鼠模型作对照,评价2种方法的构建效果。该模型和大鼠海马Aβ注射后都可降低大鼠记忆能力,诱导tau蛋白出现过度磷酸化,同时损伤其超微结构,但2种方法比较有各自的优缺点。海马Aβ注射复制AD样大鼠模型操作可靠、重复性好、模型复制成功率高,但该方法为创伤性,与AD的自然发病不相符。而且海马Aβ注射有一定的手术技巧,同时对术者进行海马的定位及微量注射器插入的深度要求较为严格,在操作中常出现动物脑出血或蛛网膜下腔出血等情况,且术后要预防感染等。持续光照复制动物模型操作简单、影响因素少、可重复性强,对术者和造模环境要求不高,且无创伤,符合AD患者发病的自然过程,但该方法复制模型的成功率相对较低,有待实验者进一步研究与改进。
